肝癌肝葉切除患者術前口服碳水化合物聯合術后早期進食效果觀察
馮金華,李卡,韓薔,馮緩,許瑞華
原發性肝癌發病率居全球惡性腫瘤第 6 位,病死率高居第3位[1]。我國是肝癌高發國,每年因肝癌致死者超過30萬,且有逐年增長的趨勢[2]。手術是其首選治療方法。肝癌患者由于腫瘤的消耗,術前伴有不同程度的免疫抑制和肝功能受損,手術會加重機體炎性應激反應和肝功能損害[3]。傳統的圍術期飲食管理為術前8 h禁食,術后肛門排氣后經口進食[4-5]。歐洲腸內腸外營養指南[6]指出,長時間禁食可能會降低胰島素敏感性、延緩傷口愈合,而縮短術前禁食時間和術后早期經口進食有利于降低術后并發癥發生率。我國加速康復外科圍手術期管理專家共識[7]也強調術前口服碳水化合物,術后早期進食以促進患者快速康復。但目前我國手術患者依舊面臨術前及術后長時間禁食現狀,關于術前口服碳水化合物聯合術后早期經口進食是否會減輕機體的創傷應激反應尚未見報道。本研究對原發性肝癌肝葉切除患者采用術前口服碳水化合物聯合術后早期經口進食方案,評價其對患者術后創傷應激反應及康復的影響,為優化原發性肝癌患者圍術期飲食管理方案提供參考。
1 資料與方法
1.1一般資料 本研究為前瞻性隨機對照研究,經四川大學華西醫院倫理委員會審核批準(2017-128)。選取2018年1月至2020年2月四川大學華西醫院膽道外科收治的原發性肝癌患者為研究對象。納入標準:①病理檢查確診為原發性肝癌;②CT檢查病變局限,腸系膜上靜脈和門脈系統主干血管未受病變累及,無廣泛轉移;③無胃排空障礙因素;④既往無心肺疾患或充血性心力衰竭等疾病,無潰瘍、凝血功能障礙,無糖尿病病史;⑤無藥物依賴病史;⑥年齡18~70歲;⑦ASA分級Ⅰ~Ⅲ級,肝功能分級(Child-Pugh)為A或B級;⑧血漿白蛋白>35 g/L,血紅蛋白>90 g/L;⑨擬擇期或限期行肝葉切除術。排除標準:①妊娠期、哺乳期婦女;②術前接受放化療。剔除標準:①最終放棄手術治療;②術中聯合其他臟器切除;③術中輸血;④術中無法切除病灶,僅行剖腹探查或改行胃空腸吻合術;⑤自愿退出研究。按上述標準共入選患者174例。由專人(不參與其他研究環節,只負責病房分配、患者分組及資料收集)按隨機數字法分為觀察組和對照組各87例,兩組分別入住預先確定的病房(避免沾染)。最終觀察組86例(1例放棄手術被剔除)、對照組82例(3例聯合其他臟器切除被剔除,2例自行退出研究)完成研究。兩組一般資料比較,見表1。

表1 兩 組 一 般 資 料 比 較
1.2方法
1.2.1干預方法 兩組患者均按加速康復外科實施術前準備與術后護理[8]。對照組飲食方案:術前禁食8 h,禁飲6 h;術后待肛門排氣后試飲水,無惡心嘔吐不適,給予清流質飲食,逐步過渡到流質飲食至普食。觀察組飲食方案:術前2 h給予碳水化合物營養制劑200 mL(能量807 kJ ,碳水化合物48 g,鈉 3 mg;我院營養科配制)。術后采取梯度遞增法,即麻醉清醒后即口服溫開水20~30 mL,根據患者耐受程度,逐漸增加飲水量,觀察有無腹痛腹脹、嘔吐及惡心不適。若無不適,口服營養制劑200 mL(能量979 kJ,蛋白質8 g,脂肪1 g,碳水化合物50 g, 鉀30 mg,鈉13 mg,鈣50 mg;我院營養科配制);術后1 d給予清流質飲食,逐漸過渡至半流質飲食、軟食及普通飲食。
1.2.2評價方法 ①炎性應激指標。于患者入院后第1天,術后第1天、第3天及第5天清晨空腹采集血標本檢測C反應蛋白(CRP)、白細胞介素6(IL-6)及白細胞計數。②術后并發癥。統計手術當天至出院期間發生的誤吸、肺部感染、胸腔積液、胃潴留、傷口感染、下肢深靜脈血栓情況。③術后相關康復指標。包括術后首次經肛門排氣時間、術后住院時間、術后30 d再入院。出院后的資料通過公共微信平臺、電話或門診隨訪相結合收集。
1.2.3統計學方法 采用SPSS20.0軟件進行統計分析,行t檢驗,χ2檢驗、Fisher確切概率法、秩和檢驗及重復測量的方差分析,檢驗水準α=0.05。
2 結果
2.1兩組炎性應激指標比較 見表2。
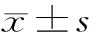
表2 兩組炎性應激指標比較 分,
2.2兩組術后并發癥發生率比較 兩組均未發生誤吸,其他并發癥發生情況見表3。

表3 兩組術后并發癥發生率比較 例
2.3兩組術后相關康復指標比較 見表4。

表4 兩組術后相關康復指標比較
3 討論
3.1優化飲食管理有利于降低患者術后炎性應激反應 肝臟在正常生理狀態下能為機體提供20%~30%的能量來源,肝癌患者由于代謝失衡,常存在營養不良和高分解代謝,同時肝臟能量代謝效率處于較低水平[3],肝葉切除術后產生的應激反應和肝功能損傷是生存質量的重要影響因素。術前口服碳水化合物聯合術后早期進食,為患者補給能量,可避免代謝失衡,降低炎性應激反應[9-10]。本研究結果顯示,兩組患者術后血清CRP、IL-6、白細胞計數較術前均顯著上升(時間效應均P<0.05),說明患者經歷手術、麻醉、失血等創傷應激,機體出現了炎性應激反應,觀察組炎性指標術后第1天達峰值,對照組術后第3天達峰值。觀察組患者術后第1天、第3天及第5天的血清CRP及IL-6水平顯著低于對照組(均P<0.05),且峰值濃度更低,提示術前口服碳水化合物聯合術后早期進食相對于常規禁食有助于降低術后創傷應激反應水平。Gianotti等[11]的研究表明,術前口服碳水化合物的患者,術后應激反應水平更低。Choi等[12]的研究指出,過度禁食者容易發生低鉀血癥、酮癥、低血容量和排尿減少;并且肝糖原的耗竭會影響單核巨噬細胞系統功能,進一步擴大機體的炎性應激反應。CRP和IL-6是急性時相反應蛋白,當機體遭受創傷、感染時會迅速升高,且CRP和IL-6與手術創傷大小密切相關[13]。本研究中觀察組患者術前2 h給予碳水化合物補充,可為機體提供能量,降低由于饑餓、口渴造成的機體應激反應;癌灶切除后,早期進食可增加腸道和肝臟血流,保護肝網狀內皮系統,及時為機體補充能量來源,一定程度上減輕機體創傷應激反應,維持機體內環境穩態[14]。兩組白細胞水平比較差異無統計學意義,尚需大樣本、延長監測時間來探究該策略實施下白細胞的變化規律。
3.2優化飲食管理不會增加患者術后并發癥發生率 相關指南與專家共識[6,10]均強調,術前6 h進食固體食物、術前2 h進水是安全的。本研究中觀察組術前2 h口服碳水化合物,結果在兩組麻醉時間、手術時間相當(均P>0.05)的前提下,均未發生誤吸,說明術前口服碳水化合物,不增加患者術中誤吸風險,同時不會延長麻醉時間。術后早期進食已被證實是改善機體營養狀態、維護機體穩態、降低并發癥發生率的重要策略[4,6,10]。結果顯示,兩組并發癥發生數均較少,且差異無統計學意義(均P>0.05),觀察組發生數相對更少。對觀察組患者于術后麻醉清醒即予少量溫開水試口服,然后視個體耐受程度采取梯度遞增法依次給予溫開水、營養制劑、清流質、半流質、軟食、普食過渡,既有效利用了消化系統功能,又確保進食安全。再次證明早期進食是安全和有益的。
3.3優化飲食管理可促進患者術后早期康復 有研究表明,縮短圍術期禁食時間可有效保護腸黏膜屏障的完整性,降低腸源性感染發生率,有效促進腸道功能恢復[4,15-16]。本研究中,觀察組患者術后首次排氣時間顯著早于對照組、住院時間短于對照組(P<0.05,P<0.01)。分析原因可能為,在保護消化系統功能和降低創傷應激反應雙重效應下,為術后早期活動和功能鍛煉奠定了基礎,從而有利于術后康復和縮短住院時間。本研究中觀察組有2例非計劃性再入院,1例因為出血,進行非計劃性再手術;另1例由于脂肪液化導致傷口感染。2例均非術前和術后進食原因導致。對照組3例非計劃性再入院,1例傷口出血,進行手術,另2例因傷口感染引起。這從另一側面證實本優化飲食管理方案有效且安全。
4 小結
優化飲食管理即術前口服碳水化合物聯合術后早期進食能有效減輕原發性肝癌肝葉切除術患者術后炎性應激反應程度,有利于術后康復。但本研究樣本量較少,圍術期優化飲食管理方案對術后并發癥的影響有待進一步探索。下一步可開展多中心、大樣本研究,進一步驗證術前口服碳水化合物聯合術后早期進食的作用。

