淺談高三化學一輪元素化合物知識復習策略
——以鹵素及其化合物為例
廣西 金敖然
元素化合物知識是中學化學知識的重要組成部分,是高三一輪復習教學中的重點內容。在高考中對基本概念、基本理論、化學實驗、工藝流程、化學計算的考查都是以元素化合物知識為載體的。因此元素化合物知識在高考中所占的比重是比較大的,而鹵素及其化合物又是元素化合物中最重要的部分,具有很好的代表性。然而學生對這部分知識的學習都在高一時完成,課時較少,而此部分內容多,因此復習時任務重。高三階段對元素化合物這部分內容如果復習不到位,則高中化學其他版塊的復習效果必然大打折扣。那么如何做好這部分內容的復習呢?我們就以鹵素及其化合物為例,淺談高三化學一輪元素化合物復習策略。
一、近三年全國卷對鹵素及其化合物的考查情況

表1

續表
二、高三一輪復習鹵素及其化合物時存在的問題
鹵素及其化合物是高中元素化合物知識的重要組成部分,也是高考重點的考查內容。但是鹵素及其化合物所涉及的知識紛繁復雜且知識比較分散,分布也比較廣,關聯高中化學必修1、必修2、選修3、選修4等教材內容,其中包含大量的化學方程式,大量的記憶性知識,以及一些特性。考查方式一般為方程式書寫,物質的物理、化學性質及用途等。通常還會融合到工藝流程、電化學知識、綜合實驗等題型中,記憶性知識多,綜合性高,難度比較大。通常學生在學習這部分內容后依舊對細碎的知識感到比較陌生,由于記憶性知識比較多,學起來也容易遺忘,還經常出現張冠李戴的情況。主要原因在于學生在復習過程中往往浮于表面,流于形式,復習過的知識都是孤立的,不能把紛繁復雜、缺乏規律的知識形成網絡化,不能構造系統、網絡化的知識,更談不上綜合應用,最終無法達成一輪復習目標。另外教師在一輪復習中依舊沿用傳統的教學模式,按照教材順序依次講授和復習,以“講”為主,導致知識相對獨立缺乏關聯。教師沒有關注到學生“學”的過程,學生只是被動接受,缺乏知識關聯的整體觀。還有教師一味地講授課本知識,沒有給學生進行適度地知識擴展、再深度整合,使得學生對知識掌握以及能力和思維的提升非常有限,嚴重影響了一輪復習效果。
三、高三一輪元素化合物的復習策略
1.教學中注重貫徹整體思維
(1)重視知識網絡構建,在高三一輪復習時,教師在教學過程中一定要滲透整體性思維,即知識不是孤立的,各知識點之間是存在聯系的。教師在講授鹵素及其化合物的時候,可以將整塊的知識以“點—線—網”的方式,系統梳理,構建知識網絡,從而實現一輪復習的高效性、有效性。下面筆者將氯元素及其化合物的轉化關系構建成物質轉化關系圖,如圖1所示。

圖1 氯元素及其化合物轉化關系圖
利用轉化關系圖使學生系統、清晰地掌握物質之間的轉化關系及相關方程式。在講授鹵素及其化合物時,結合圖1所示關系,重點講授Cl2的氧化性以及NaClO的性質和轉化關系,同時引導學生進行物質轉化或是純度、質量分數相關計算的訓練。同時重點還要強調Cl2、NaClO、ClO2等在人類生產、生活中的用途。對氯元素及其化合物的轉化關系構建,使得生澀難記的知識網絡化、系統化,提升學生吸收消化知識的效果。
(2)重視元素周期表和元素周期律。在一輪元素化合物的學習時,利用元素周期表把零亂的元素統一起來,使其條理化、綱領化。再用元素周期律把這些元素變成有序的、可推理的知識。這樣使學生進行有推理有規律的記憶,方便了學生記憶和掌握,從而形成高效復習。以鹵素為例,鹵素是第ⅦA族元素的總稱,包括F、Cl、Br、I、At。他們最外層都有7個電子,反應中容易得電子顯負一價,體現氧化性,故鹵素分別與物質反應時化學方程式非常相似。但是由于原子半徑依次增大,原子核對電子的吸引能力逐漸減弱,氧化性依次減弱。這個性質在鹵素與變價金屬反應時表現得尤為明顯,如Fe與Cl2反應生成Fe3+而Fe與I2反應則生成Fe2+。
2.依據教材、考綱進行適度拓展知識、深度整合
通常在一輪復習過程中,學生雖然掌握了知識,但是如果用新物質為載體來考查已學知識,學生常常出現完全沒有思路的情況,或者跟著感覺走,進而做出錯誤的結論。這種情況多出現在“工藝流程題”和“實驗綜合題”里。如果能將一些常考的單質或者化合物適度拓展學習,學生根據拓展的知識、類比拓展的知識應用到解題過程當中,就能達到意想不到的效果。教師在復習過程中應結合教材、考試要求對一輪復習內容進行“二次加工”再深度整合。以鹵素為例,教師可以適當講些鹵素互化物來知識拓展。
【例1】(2021·全國甲卷·26)碘(紫黑色固體,微溶于水)及其化合物廣泛用于醫藥、染料等方面。回答下列問題:
(1)I2的一種制備方法如圖2所示:

圖2
①加入Fe粉進行轉化反應的離子方程式為_____________________________________,生成的沉淀與硝酸反應,生成________后可循環使用。
②通入Cl2的過程中,若氧化產物只有一種,反應的化學方程式為_________________;若反應物用量比

(2)以NaIO3為原料制備I2的方法是:先向NaIO3溶液中加入計量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反應得到I2,上述制備I2的總反應的離子方程式為____________________。



(3)4;防止單質碘析出


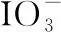

【備考建議】2021全國甲卷以碘及其化合物的性質為載體,具體考查陌生方程式書寫、氧化還原原理、計算、物質的化學性質等知識。我們在高三一輪復習備考中注意鹵素及其化合物之間性質的聯系和遷移,系統地、整體地把握元素化合物這塊知識的復習學習,從而提高備考活動中的高效性和有效性。
【例2】(2021·全國乙卷·28節選)一氯化碘(ICl)是一種鹵素互化物,具有強氧化性,可與金屬直接反應,也可用作有機合成中的碘化劑。回答下列問題:
(1)歷史上海藻提碘中得到一種紅棕色液體,由于性質相似,Liebig誤認為是ICl,從而錯過了一種新元素的發現,該元素是________。
【答案】溴(或Br)
【解析】紅棕色液體,在已知的鹵族元素單質中,可推測為溴單質,因此錯過發現的元素是溴(或Br)。
【備考建議】本題考查鹵素中溴單質的物理性質。同時我們也注意題中出現的鹵素互化物,我們在復習鹵素及其化合物知識的時候,適當引入鹵素互化物、擬鹵素等知識,不但可以拓展學生的知識面,也可以將這部分知識加以延伸,提升學生分析問題和知識遷移的能力。


