8種試劑盒的水稻DNA提取效果比較研究
肖婉鈺 孫藝嘉 周賢玉 任海龍 鄒集文 張晶 許東林


摘? ? 要:水稻種子DNA的提取質量直接影響水稻種子真實性檢驗的效果。選取市面上常見的8種植物基因組DNA提取試劑盒(K1~K8)進行水稻種子DNA提取效果比較研究,結果表明,試劑盒K2提取得到的水稻種子DNA在0.8%瓊脂糖凝膠電泳檢測中,條帶最明亮、整齊且無拖尾,質量最高,試劑盒K8、K3的提取質量次之;試劑盒K1、K6提取的水稻種子DNA純度最佳,試劑盒K2、K3、K5、K7、K8的提取產物純度次之。因此,試劑盒K2的提取效果最好,K8、K3次之,8種試劑盒均適用于基于SSR片段分析的水稻品種真實性檢測。
關鍵詞:水稻;DNA提取試劑盒;品種真實性
文章編號:1005-2690(2021)18-0005-02? ? ? ?中國圖書分類號:S511? ? ? ?文獻標志碼:B
種子真實性檢測是加強知識產權保護、促進種業健康發展的保障[1]。目前,我國水稻、玉米等大宗農作物已普遍開展種子真實性檢測,無論是目前主流第二代分子標記即SSR(簡單重復序列)的檢測方法,還是新一代SNP分子標記的檢測方法,都需要高質量的基因組DNA作為基礎。因此,確保植物DNA提取的質量是種子真實性檢測能否保質保量完成的關鍵因素。
在種子真實性檢測中,選取的材料大多為水稻新鮮葉片、幼苗或水稻幼嫩莖 [2-7]。但將水稻的種子播種,發苗之后再進行核酸抽提耗時太久,如能直接用水稻種子抽提核酸,將大大提升試驗效率,但是在水稻的各部位組織中,種子稻米的成分最為復雜,含更多的淀粉等物質,所以提取水稻種子基因組DNA 難度更大。通過比較不同DNA試劑盒水稻種子DNA的提取效果,旨在為今后種子真實性檢測提供技術支持。
1? ?材料和方法
1.1? ?試驗材料
以10個雜交水稻品種的干種子為試驗材料,材料均來自于2020年廣東省種子監督抽查的備份樣品。試驗樣品編號如下,A:深優9516,B:野香優莉絲,C:恒豐優778,D:荃優絲苗,E:創優華占,F:隆優3206,G:廣8優金占,H:軟華優6100,I:廣8優金占,J:恒豐優387。
1.2? ?單粒種子DNA提取
取 1 粒水稻干種子,用MP FastPrep-24組織勻漿器磨成粉末,再用8種DNA提取試劑盒(見表1)分別提取上述10個水稻品種的DNA,按照每種試劑盒中的使用說明來進行提取,共獲得80個水稻基因組DNA。
1.3? ?DNA產物質量測定
1.3.1? ?瓊脂糖凝膠電泳檢測
用超純水將80個DNA模板稀釋到50 ng/μL,吸取5 μL DNA 與1 μL 上樣緩沖液混勻, 0.8%的瓊脂糖凝膠,85 V電壓,電泳20 min,用Proteinsimple AlphaImager HP凝膠成像系統上觀察和拍照。
1.3.2? ?DNA 質量濃度和純度的測定
用Thermo Scientific NanoDrop One超微量分光光度計檢測80個DNA 模板的質量濃度和純度。其中A260/A280的大小代表DNA 純度;DNA 模板在260 nm?的吸光度代表DNA 質量濃度,A260=1代表DNA 質量濃度為50 ng/μL[8]。
1.4? ?水稻SSR的PCR擴增與毛細管電泳檢測
引物來自于2014 年原農業部水稻品種鑒定標準《水稻品種鑒定技術規程:SSR 標記法NY/T 1433—2014》。選用5 對引物進行PCR 擴增,見表2。
20 μL 反應體系:10×buffer 2μL,dNTP0.5 μL,Taq酶0.5 μL,10 μmol/L的正向熒光引物1 μL,1 μL 10 μmol/L的反向普通引物,50 ng/μL 的模板DNA1 μL,加無菌水補齊至20 μL。
擴增條件:預變性94 ℃ 4 min;變性94 ℃ 45 s,退火50~67 ℃ 45 s,延伸72 ℃ 1 min,30 個循環;72 ℃延伸8 min。
上機準備:PCR 結束以后,取一塊96 孔板加入70%乙醇至總體積為50 μL,震蕩充分混勻。3 700 r/min,4 ℃離心30 min。靜置15 min 后加入內標LIZ500 和HiDi,振蕩充分混勻,離心10 s。放入PCR 儀,95 ℃ 條件下4 min 變性。放到Thermo Scientific ABI 3500中進行毛細管電泳。
2? ?結果與分析
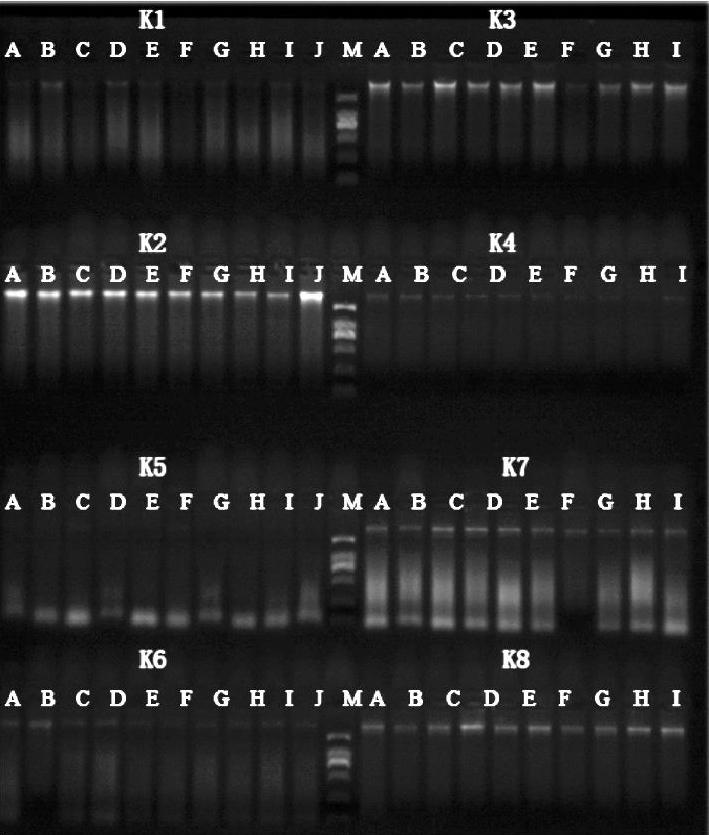
2.1? ?DNA 提取物瓊脂糖凝膠電泳檢測結果
由圖1可見,試劑盒K2呈現出整齊清晰的條帶,無拖尾現象;試劑盒K3和K8條帶亮度較弱,也無拖尾現象;試劑盒K7條帶明亮,但拖尾現象嚴重;試劑盒K1、K4、K5、K6條帶亮度很弱,有明顯拖尾現象。
2.2? ?DNA提取物濃度和純度檢驗結果
由表3可知,8種試劑盒提取方法的DNA質量濃度中,試劑盒K7的濃度為25.4~266.3 ng/μL,濃度最高;試劑盒K1、K2、K3、K5、K8的DNA質量濃度在18.4~137.4 ng/μL,濃度適中;試劑盒K4、K6的DNA質量濃度低于20 ng/μL,濃度較低。
8種試劑盒提取方法的A260/A280比值情況如下:純DNA 的A260/A280 約為1.8,>1.8 表明有RNA污染,<1.8 表明有蛋白質污染[9-10]。試劑盒K2、K3、K8的A260/A280為1.74~2.06,純度最高;試劑盒K1、K5、K6、K7的A260/A280在1.42~2.29,純度次之;試劑盒K4的A260/A280為1.04~1.74,純度最低。
2.3? ?毛細管電泳結果
在ABI3700 基因分析儀器上利用熒光標記的PCR 產物進行毛細管電泳,8個樣品在5個位點上擴增片段帶型清晰,8個試劑盒的表現一致。
3? ?討論
試劑盒K2、K3、K8提取質量和產量都比較高。采用試劑盒K2、K3、K8提取得到的DNA純度較高,DNA 帶清晰; PCR擴增結果較好,每個引物均可擴增出清晰的波峰,但操作比較煩瑣,耗時耗力,提取10個基因組DNA需2.5 h,所用試劑對人體有毒。與試劑盒K2、K3、K8相比,試劑盒K6步驟簡單,用時少,擴增效果也較好,但DNA 純度較低,也用到了一些對人體有害的試劑,安全性不高。試劑盒K1、K4、K5、K7步驟較復雜,提取得到的DNA純度較低;試劑盒K7的DNA質量濃度太高,需要稀釋才能使用;試劑盒K1、K2、K3、K5、K8的DNA質量濃度適中;試劑盒K4、K6的DNA質量濃度低于20 ng/μL,濃度較低。
在進行SSR-PCR 反應中,模板DNA 如果含有多糖、酚類、蛋白質等雜質[10], 會影響DNA 聚合酶活性,干擾引物與模板的結合。試劑盒K2提取的數量多,PCR 結果穩定,重復性也好, 在進行水稻干種子DNA 抽提時,試劑盒K2是實驗室提取水稻基因組DNA 的一種好方法。
通過對8種DNA提取試劑盒提取10個水稻品種的DNA進行DNA提取試劑盒篩選,結果表明,試驗篩選出最優DNA提取試劑盒具有穩定、高效和可重復性的特點,可應用于水稻真實性檢測工作。
參考文獻:
[ 1 ] OECD.Consensus document on compositional considerations for new varieties of rice(Oryza sativa):key food and feed nutrients and antinutrients[R].Paris:OECD,2004.
[ 2 ] 李炫麗,王世才,許雙全.水稻單粒種子DNA提取及SSR-PCR反應體系的正交設計優化[J].中國種業,2011(8):46-49.
[ 3 ] IKEDA N,BAUTISTA N S,YAMADA T.Ultra-Simple DNA extraction method for marker-assisted selection usingmicro-
satellite markers in rice[J].Plant Molecular Biology Reporter,2001(19):27-32.
[ 4 ] WU Gang,WU Yuhua,NIE Shujing,et al.Real-time PCR method for detection of the transgenic rice event TT51-1[J].Food Chemistry,2010(119):417-422.
[ 5 ] 朱世楊,羅天寬,張小玲,等.8種水稻基因組DNA提取方法的比較[J].安徽農業科學,2009(5):1929-1931.
[ 6 ] 趙紅霞,謝攀,黃志堅,等.一種改良的水稻總DNA提取方法[J].湖北大學學報(自然科學版),2006(4):389-392.
[ 7 ] COLLARD B C Y,DAS A,VIRK P S,et al.Evaluation of quick and dirty DNA extraction methods for marker-assisted selec-
tion in rice(Oryza sativa L.)[J].Plant Breeding,2007(126):47-50.
[ 8 ] CHAPELA M J,SOTELO C G,PEREZ-MARTIN R I,et al.Comparison of DNA extraction methods from muscle of canned
tuna for species identification[J].Food Control,2007(18):1211-1215.
[ 9 ] SHARMA A D,GILL P K,SINGH P.DNA isolation from dry and fresh samples of polysaccharide-rich plants[J].Plant Mol Biol Rep,2002(20):415.
[ 10 ] 李娟,文建成,譚學林.從水稻單粒糙米中快速制備基因組DNA的方法[J].分子植物育種,2007(5):735-737.

