鐵死亡在胃癌中的研究進展*
王 黎 綜述,嚴 萍,李雪梅,范紅平,樊玉娟,趙衛(wèi)東△ 審校
1.大理大學臨床醫(yī)學院,云南大理 671000;2.大理大學第一附屬醫(yī)院,云南大理 671000
胃癌(GC)是一種常見的消化系統(tǒng)腫瘤。據(jù)2018年全球癌癥數(shù)據(jù)統(tǒng)計,胃癌的發(fā)病率在惡性腫瘤中排第5位,病死率排在第3位[1]。胃癌的危險因素包括幽門螺桿菌感染、年齡、吸煙、飲酒、飲食、EB病毒感染、遺傳背景等[2]。然而,胃癌的發(fā)生、發(fā)展機制尚未完全明確,深入了解胃癌的發(fā)病機制將有助于尋找藥物作用的新靶點,提供新的臨床治療途徑。目前,隨著細胞死亡相關研究的深入,鐵死亡作為一種新型調(diào)節(jié)性細胞死亡模式逐漸受到關注。鐵死亡在形態(tài)學、分子機制、免疫特征上不同于其他類型的細胞死亡,如凋亡、程序性壞死、自噬等[3]。已有文獻證明,鐵死亡參與多種癌癥的調(diào)節(jié),包括胃癌[4]。但目前鐵死亡與胃癌相關的研究仍較少,因此,本文就鐵死亡的機制以及與胃癌的相關研究進展作一綜述。
1 鐵死亡
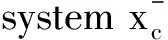
2 鐵死亡機制

3 鐵死亡與腫瘤
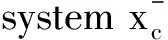
4 鐵死亡與胃癌
4.1鐵異常與胃癌 鐵是人類生活的基本元素,只有一小部分膳食鐵被吸收。體內(nèi)的鐵含量通常通過測量游離鐵、鐵蛋白、總鐵結合力(TIBC)和轉鐵蛋白飽和度(TS)來評估。鐵主要與血紅蛋白結合,大約30%的鐵以鐵蛋白的形式儲存。鐵蛋白代表肝臟、脾臟和骨髓中的鐵水平,在缺鐵時減少,在肝病、感染、炎癥等疾病中增加[21]。
研究表明身體鐵狀況與胃癌風險之間存在負相關,鐵蛋白被認為是體內(nèi)儲存鐵的最具特異性的分子[22]。鐵負荷太大會導致DNA損傷,從而增加致癌風險。然而,也有證據(jù)表明,缺鐵和貧血也可能導致氧化應激水平和DNA損傷增加,增加致癌風險,特別是一些鐵依賴的正常生物過程和代謝途徑因缺鐵而功能異常(例如癌癥激活細胞的免疫反應、毒物的新陳代謝,以及DNA生物合成和修復的氧化還原調(diào)節(jié)過程)[23]。血清鐵蛋白以及其他鐵代謝標志物與胃癌發(fā)生風險呈負相關,這可能與胃癌早期病變導致的出血以及慢性胃炎引起的酸中毒或低氯血癥有關。這些因素和機體鐵狀態(tài)在胃癌發(fā)生中的相互作用還需要進一步的研究。

Perilipin2(PLIN2)又稱脂肪分化相關蛋白(AdRP),免疫組化顯示PLIN2在胃癌組織中顯著過表達。有研究發(fā)現(xiàn),PLIN2是抑制胃癌脂代謝異常所致的鐵死亡過程中不可或缺的蛋白。PLIN2通過調(diào)節(jié)轉錄因子PRDM11和IPO7下調(diào)ACSL3、ALOX15、LC3A、PRDM11的表達來調(diào)節(jié)鐵死亡途徑[27]。經(jīng)PLIN2刺激后IPO7水平升高,作為胃癌基因和細胞輸入蛋白,為細胞增殖提供能量,抵抗鐵死亡。因此,PLIN2可能成為一種潛在的胃腫瘤診斷和治療靶點的生物標志物,特別是在肥胖患者腫瘤的預測方面。
microRNA(miRNA)在包括胃癌在內(nèi)的多種惡性腫瘤的發(fā)生、發(fā)展中起著重要的作用[28]。一些研究已經(jīng)探索了miRNA在癌癥中的治療靶點,miRNA能夠引起鐵死亡也已經(jīng)得到證實[29]。有研究發(fā)現(xiàn),miR-103a-3p可作為惡性腫瘤早期診斷的生物標志物,miR-103a-3p在胃癌中表達上調(diào),抑制miR-103a-3p的表達會使患者有更好的預后[30]。敲除miR-103a-3p靶向分子谷氨酰胺酶2(GLS2)能夠抑制細胞活力,促進胃癌細胞鐵死亡。miR-103a-3p對GLS2表達的下調(diào)在胃癌中發(fā)揮抗腫瘤作用。這些發(fā)現(xiàn)為胃癌的治療提供了新的治療靶點。
環(huán)狀RNA(CircRNAs)是一系列具有閉合環(huán)狀結構的非編碼RNA。CircRNA在調(diào)節(jié)包括胃癌在內(nèi)的多種人類癌癥的進展過程中起著至關重要的中介作用。比如Circ-SFMBT2在胃癌中增加,并且Circ-SFMBT2的增加促進了胃癌細胞的發(fā)展[31]。Circ-104916通過抑制細胞生長和轉移而在胃癌的發(fā)展中發(fā)揮抑制作用[32]。研究發(fā)現(xiàn),Circ-0008035在胃癌組織和細胞中表達升高,促進了胃癌細胞的生長。在Erastin或RSL3處理的胃癌細胞中,在Circ-0008035基因敲除后細胞發(fā)生鐵死亡,細胞內(nèi)鐵、過氧化脂質(zhì)、ROS升高,線粒體膜電位降低[33]。還有研究表明,Circ-0008035通過與miR-375相互作用促進胃癌的發(fā)生[34]。

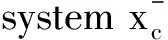
獼猴桃根(ACP)是一種中草藥,獼猴桃屬植物獼猴桃的根,具有抗腫瘤、免疫調(diào)節(jié)等功能,是已被批準的臨床抗腫瘤藥物。然而,ACP對胃癌耐藥的具體機制尚不清楚。研究發(fā)現(xiàn),ACP通過抑制Gpx4和SLC7A11蛋白而增加ROS的積累,調(diào)節(jié)細胞鐵死亡[39]。丹參酮ⅡA是從中草藥丹參根莖中分離得到的一種活性藥理成分。已有報道顯示丹參酮ⅡA對胃癌具有抗癌作用,能夠影響胃癌AGS細胞的糖代謝,通過抑制表皮生長因子受體(EGFR)、胰島素樣生長因子受體(IGFR)、血管內(nèi)皮生長因子受體(VEGFR)的表達,阻斷PI3K/Akt/mTOR、Ras/Raf/MEK/ERK信號通路,抑制胃癌AGS細胞的生長[40]。丹參酮ⅡA促進了脂質(zhì)過氧化,上調(diào)了鐵死亡的兩個標志物Ptgs2和Chac1的表達,導致細胞內(nèi)谷胱甘肽和半胱氨酸水平下降,細胞內(nèi)ROS水平升高,P53基因敲除可減弱其誘導的脂質(zhì)過氧化和鐵死亡[41]。因此,丹參酮ⅡA可能通過誘導P53上調(diào)而增強其介導的鐵死亡來抑制胃癌的增殖。
5 小 結
鐵死亡作為新發(fā)現(xiàn)的細胞死亡模式是目前研究的熱點,關于鐵死亡的生物學機制已經(jīng)開展了許多研究。然而,鐵死亡與腫瘤之間的關系仍然有待進一步研究,特別是在腫瘤微環(huán)境以及腫瘤免疫的相關領域。胃癌作為在我國發(fā)病率和病死率均第2位的惡性腫瘤,其發(fā)生、發(fā)展機制和診斷、治療都被密切關注。本文闡述了鐵死亡的相關機制以及與腫瘤發(fā)生、發(fā)展的關系,總結了目前胃癌相關生物分子介導的鐵死亡過程以及一些作用于鐵死亡途徑的藥物,為以后鐵死亡的機制研究以及胃癌的治療提供幫助。

