高產蛋白酶米曲霉菌株的選育及對醬油風味生成的影響
樊嘉訓,劉松,2,陸信曜,陳堅*
1(糧食發酵工藝與技術國家工程實驗室(江南大學),江蘇 無錫,214122) 2(江南大學 生物工程學院,江蘇 無錫,214122)
醬油是一種受歡迎的東方發酵調味品,由豆粕、麩皮與米曲霉、酵母菌和乳酸菌混合,經過制曲(固態發酵)和醬醪(鹽水發酵)兩步發酵而成[1]。醬油生產過程中,米曲霉產生的蛋白酶不僅可以分解原料,決定醬油的氨基酸態氮含量,而且通過降解原料蛋白釋放出氨基酸或多肽,改善醬油的風味、色澤和口感。因此,蛋白酶的酶活力高低是米曲霉菌種的衡量指標。蛋白酶活性的高低決定了蛋白質的利用率,高酶活力不僅可以更好地分解原料,提升醬油的氨基酸態氮含量,進而決定了最終產品的風味、色澤和口感[2]。目前,獲得高蛋白酶活性菌株以提高原料氮利用率的育種技術[3]主要包括物理化學誘變[4]和原生質體融合技術[5]等。與傳統的誘變方法相比,近年來興起的常壓室溫等離子體(atmospheric room temperature plasma, ARTP)誘變對遺傳物質的損傷機制多樣,獲得突變型的多樣性可能性增大,且操作簡單安全[6],廣泛應用于絲狀菌的育種。
在絲狀菌的誘變后初篩中,傳統的平板培養技術存在通量低、耗時多、勞動強度大且商業生產成本高的弊端。因此,構建一種高效、快速、高通量的篩選方法來獲得目標菌株有助于縮減絲狀菌的育種周期。流式細胞術是一種快速、準確、客觀的技術,可同時檢測單個粒子的多種特征,識別細胞或顆粒所攜帶的熒光染料,并對特定群體進行分選[7]。本研究通過ARTP和基于碘化丙啶和熒光素二乙酸酯雙染色的流式分選初篩獲得了1株高酶活力的米曲霉突變株,并對其在醬油生產中的應用進行模擬分析,以期為絲狀菌的高通量誘變育種和醬油現代釀造品質的提升提供借鑒。
1 材料與方法
1.1 材料
1.1.1 菌株及主要試劑
菌株:米曲霉(Aspergillusoryzae)滬釀3.042,紹興至味食品有限公司。
主要試劑:熒光素二乙酸酯(fluorescein diacetate, FDA)、碘化丙啶(propidium iodide, PI)、福林酚試劑、干酪素等。
1.1.2 培養基及培養條件
PD培養基(g/L):新鮮去皮土豆(去離子水煮沸30 min) 200,葡萄糖20,K2HPO43,MgSO4·7H2O 1.5。固體培養基在以上基礎上加入20 g/L瓊脂。
種子培養基(g/L):葡萄糖30,胰蛋白酶6,K2HPO40.56,NaH2PO4·2H2O 0.75,Na2HPO40.75。
種曲培養基(質量分數):80%麩皮,20%面粉,向上述固體中加水至含水量80%~85%,分裝入250 mL三角瓶,1 cm厚。
48深孔板液態培養基(g/L):麩皮浸提液64,面粉浸提液16, (NH4)2HPO416, K2HPO40.32, MgSO4·7H2O 0.16。
1.2 實驗方法
1.2.1 ARTP誘變文庫的構建
培養成熟后的米曲霉用無菌水洗滌,經200目篩網過濾后獲得孢子懸液,離心后洗滌、懸浮備用。ARTP誘變中,誘變條件設為:通氣量10 SLM、功率100 W、時間分別設為0、20、40、60、80、100、120 s。誘變處理后的載片于PBS中洗脫,將洗脫液稀釋不同倍數后涂布,0 s計數為A,其他時刻計數為B[8]。致死率按公式(1)計算:
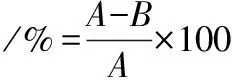
(1)
式中:A,誘變后存活孢子數;B,誘變前總孢子數。
將誘變后的樣品放入含有無菌等離子水的新試管中懸浮備用。
1.2.2 基于流式細胞術的高通量篩選
FDA單染:將不同體積的FDA染料與不同質量濃度的孢子懸浮液混合,使每個樣品的最終質量濃度為50、100、150、200、250 μg/mL,室溫下暗箱孵育5、10、15、20 min后涂布平板,計算致死率[9]。
PI單染:將不同體積的PI染料與不同質量濃度的孢子懸浮液混合,使每個樣品的最終質量濃度為1、3、5、7、9 μg/mL,4 ℃暗箱孵育5、10、15、20 min后涂布平板,計算致死率[10]。
將處理好的樣品上流式細胞儀進行檢測。沒有經過染色的樣品設置為陰性對照,與FDA染料結合的活性樣品發綠熒光由FITC-Log通道檢測,與PI染料結合的無活性樣品發紅熒光由RPE-TR-Log通道檢測。以單細胞模式將單個活性孢子分選入48孔板發酵培養基中,而后于30 ℃,220 r/min在多孔板搖床上發酵,24 h后系統地轉移至48深孔板中,在高速振蕩培養箱中相同發酵條件下繼續發酵48 h。然后采用高通量移液技術將發酵上清液轉移至另一個48深孔板里進行蛋白酶活力測定。最后將反應液轉移至96孔酶標板上,于660 nm處進行吸光度檢測。至此,基于以上實驗方法構建了一套完整的篩選高產蛋白酶米曲霉菌株的方法,如圖1所示。
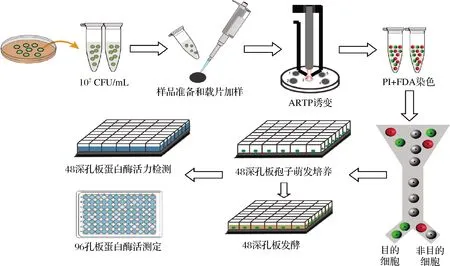
圖1 高產蛋白酶米曲霉菌株的篩選流程Fig.1 Screening process of Aspergillus oryzae with high-productive proteaso
1.2.3 種曲胞外蛋白分析
固態培養基中胞外蛋白的提取遵循ODA等[11]的方法。將提取出的蛋白沉淀在室溫下溶于1×NuPAGE LDS樣品緩沖液中1 h以上,得到蛋白質溶液。采用Bradford法測定蛋白質溶液的濃度,調整樣品濃度至相同,最終確定每泳道的上樣量為10 μL,凝膠電泳后用考馬斯亮藍染色。
將需要鑒定的條帶切成約1 mm大小的膠粒于離心管中,加入測序級胰蛋白酶溶液于37 ℃反應過夜,吸出酶解液,轉移至新離心管。原管加入100 μL 0.1%三氟乙酸溶液,超聲15 min后合并酶解液并凍干。此時樣品制備完成,加3 μL 0.1%三氟乙酸溶液復溶,點樣,進行質譜分析[10]。
串聯飛行時間質譜儀型號為AB SCIEX 5800 MALDI-TOF/TOF,激光源為349 nm波長的Nd:YAG激光器,加速電壓為2 kV,采集數據模式為正離子模式和自動獲取數據的模式。用Mascot 2.2軟件對質譜檢測的原始文件進行相應的數據庫檢索,最終確定了蛋白鑒定結果。
1.2.4 RNA收集、cDNA合成和實時熒光定量PCR分析
利用布氏漏斗抽濾收集發酵液中的菌體,無菌水洗滌菌體2次后提取總RNA。將收集的菌體于液氮中研磨至白色細膩粉末狀,按照植物RNA提取試劑盒方法提取目標RNA。提取完的 RNA 使用 Nanodrop ND-2000分光光度計在 260 nm/280 nm 條件下進行定量。使用 DNA 酶處理所有的總 RNA 樣品,以去除殘留的基因組 DNA。
使用PrimeScript?RT reagent Kit with gDNA Eraser Perfect Real Time試劑盒法將提取的RNA逆轉錄成cDNA。根據基質輔助激光解吸電離飛行時間質譜(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)鑒定結果,在NCBI上查詢米曲霉甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因序列、pepA(aspergillopepsin-1)基因序列、ALP(alkaline protease,partial)基因序列和AO090001000135(neutral protease 2 homolog AO090001000135)基因序列。使用SYBR Premix Ex Taq試劑盒法配制反應體系并在StepOnePlus實時定量PCR儀上進行反應。以米曲霉GAPDH基因作為參比基因,所用引物如表1所示。
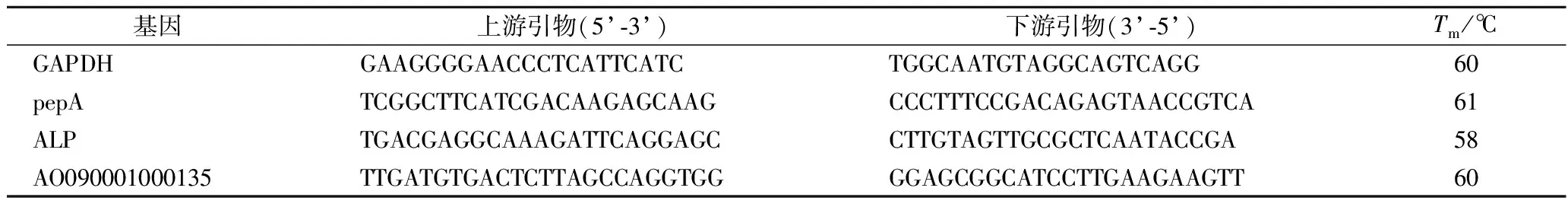
表1 實時熒光定量 PCR 所用引物Table 1 Primers for RT-qpcr
1.2.5 實驗室醬油模擬發酵工藝
制曲工藝:將豆粕與麩皮按4∶1的體積比混合均勻,121 ℃滅菌15 min,冷卻至室溫。接入質量分數0.2%,濃度107CFU/mL的米曲霉孢子懸液,30 ℃恒溫培養,保持濕度,適時翻曲直至曲料表面長滿黃綠色菌絲即可[12]。
發酵工藝:成曲按照1∶1.7的質量比加入13 °Bé、50 ℃的鹽水于40 ℃發酵25 d[13]。工藝流程如圖2所示。
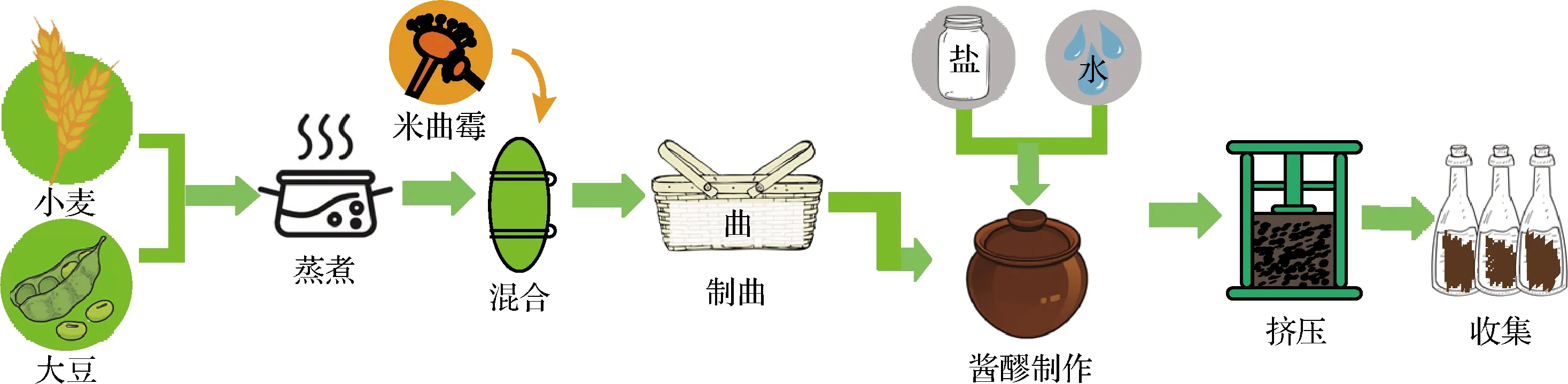
圖2 醬油模擬工藝Fig.2 Simulation producing technology of soy sauce
醬醪理化指標的測定:在第5、10、15、20、25 天進行取樣。醬醪樣品于12 000 r/min離心后取上清液并經孔徑為0.22 μm的濾膜過濾。氨基酸態氮的含量測定采用甲醛滴定法[14],總氮的測定采用凱氏定氮法[15],游離氨基酸的測定采用高效液相法[16],有機酸的測定采用高效液相色譜法[17],揮發性物質的測定采用固相微萃取聯合氣質聯用技術(solid phase microextraction-gas chromatography-mass spectrometry,SPME-GC-MS)[18]。
2 結果與分析
2.1 ARTP誘變及高通量篩選
控制誘變時間為唯一變量,獲得致死率與誘變時間的關系曲線(圖3-a)。隨機挑取一定數量的單菌落于48深孔板發酵,統計發酵48 h后蛋白酶酶活力,獲得正突變率與致死率的關系。如圖3-b所示,孢子的致死率與誘變時間呈正相關,正突變率整體呈現先上升后下降的趨勢,考慮到高致死率有利于縮小突變庫,故誘變條件確定為:通氣量10 SLM、功率100 W、時間100 s。
FDA通過活細胞的細胞膜,被細胞中的非特異性酯酶分解產生熒光素并積蓄在活細胞中產生熒光[19]。PI可以透過死細胞的細胞膜使細胞核紅染[20]。根據2種染料的特性將誘變后的活孢子與死孢子區分開來。通常染料濃度越高、染色時間越長,染色效果越明顯。然而,相應地,染料對細胞的致死作用也越嚴重。所以考察了2種染料的毒性以及染色時間對米曲霉孢子的影響。結果表明,質量濃度為100 μg/mL FDA在室溫下染色20 min,PI質量濃度為6 μg/mL在4 ℃下染色10 min效果最佳,當致死率低于10%時,染色效果與染料濃度和染色時間呈正相關關系(表2)。
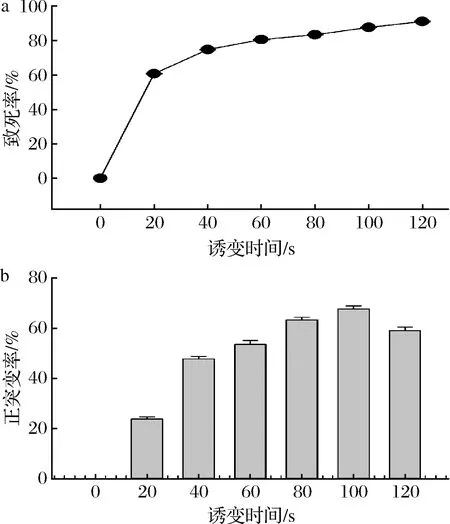
a-致死率;b-正突變率圖3 ARTP誘變的致死率和正突變率Fig.3 Lethality rate and positive mutation rate of ARTP mutagenesis
根據優化后的最優染色條件,對誘變后的樣品進行FDA-PI雙熒光復染,上流式細胞儀檢測。建立雙對數坐標軸,將沒有進行染色操作的孢子懸液作為陰性對照(圖4-a);活孢子經FDA單染后,主要集中于FDA+區域(圖4-b);死孢子經PI單染后,主要集中于PI+區域(圖4-c);樣品經FDA-PI雙染后,死活孢子各自分布于PI+區域和FDA+區域(圖4-d)。
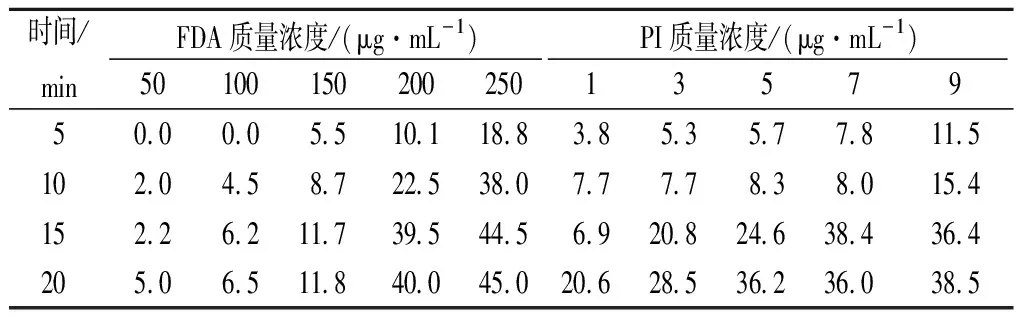
表2 染料的濃度和染色時間對孢子的致死率單位:%
經流式細胞儀分選后,借助高通量孔板培養、酶標儀檢測器等高通量設備,構建好初篩方法,測定孔板內蛋白酶反應液的OD值(圖5-a)。經過4輪誘變,總共獲得4 032株突變菌株,初篩選出16株產量較高的菌株。如圖5-b所示,將初篩得到的高產的16株突變菌株和出發菌株制曲72 h的中性蛋白酶活性進行再測試,突變菌株H34的中性蛋白酶活性達到3 684.3 U/g,較出發菌株的酶活力提高了145.6%。為了驗證突變株H34傳代過程中的遺傳穩定性,將該菌株定期傳代7次,在傳代培養過程中,突變株H34蛋白酶活性波動較小且穩定,遺傳穩定性較好(圖5-c)。
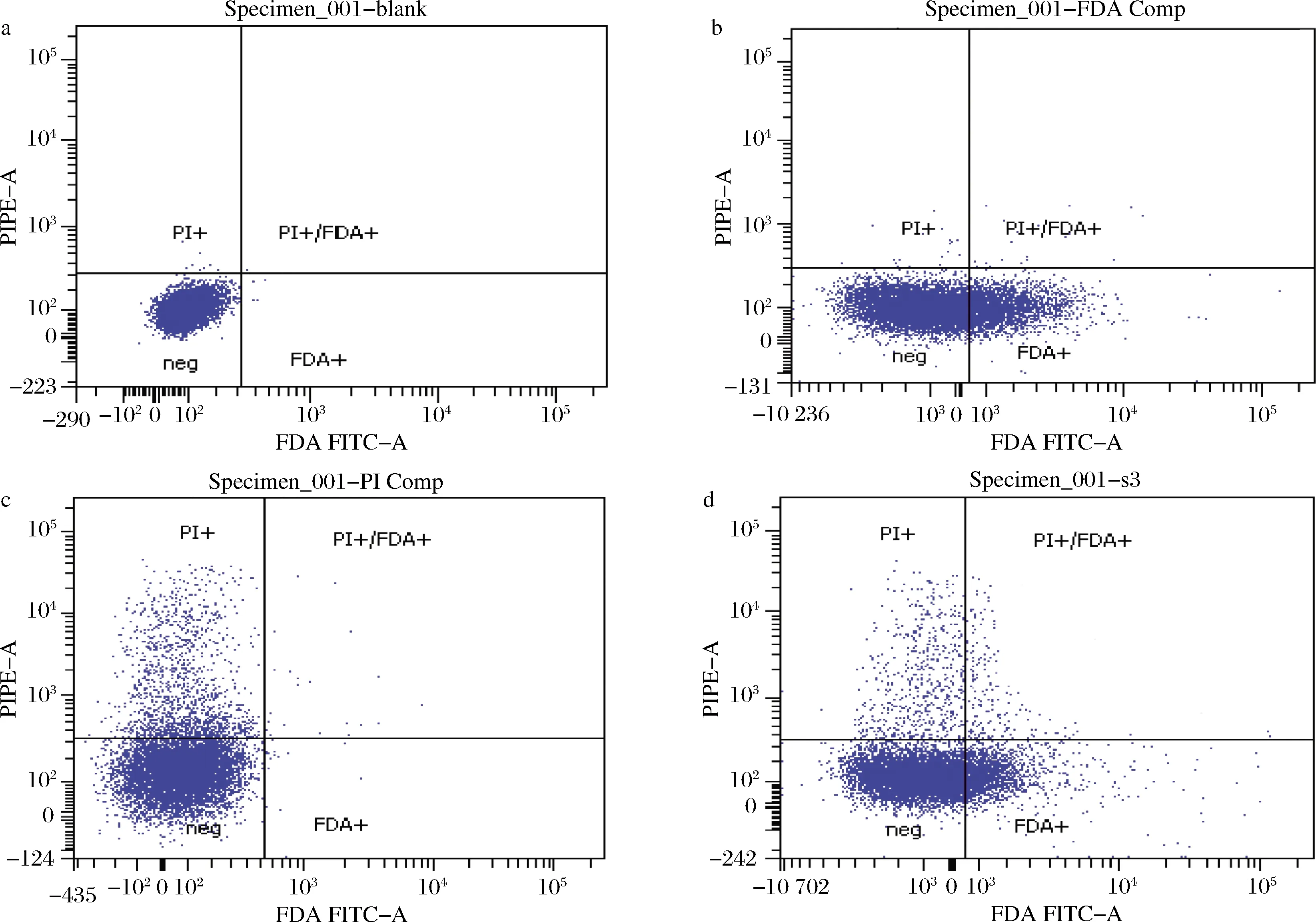
a-對照;b-FDA單染;c-PI單染;d-FDA-PI雙染圖4 熒光染色流式細胞儀檢測分析Fig.4 Sorting based on flow cytometry
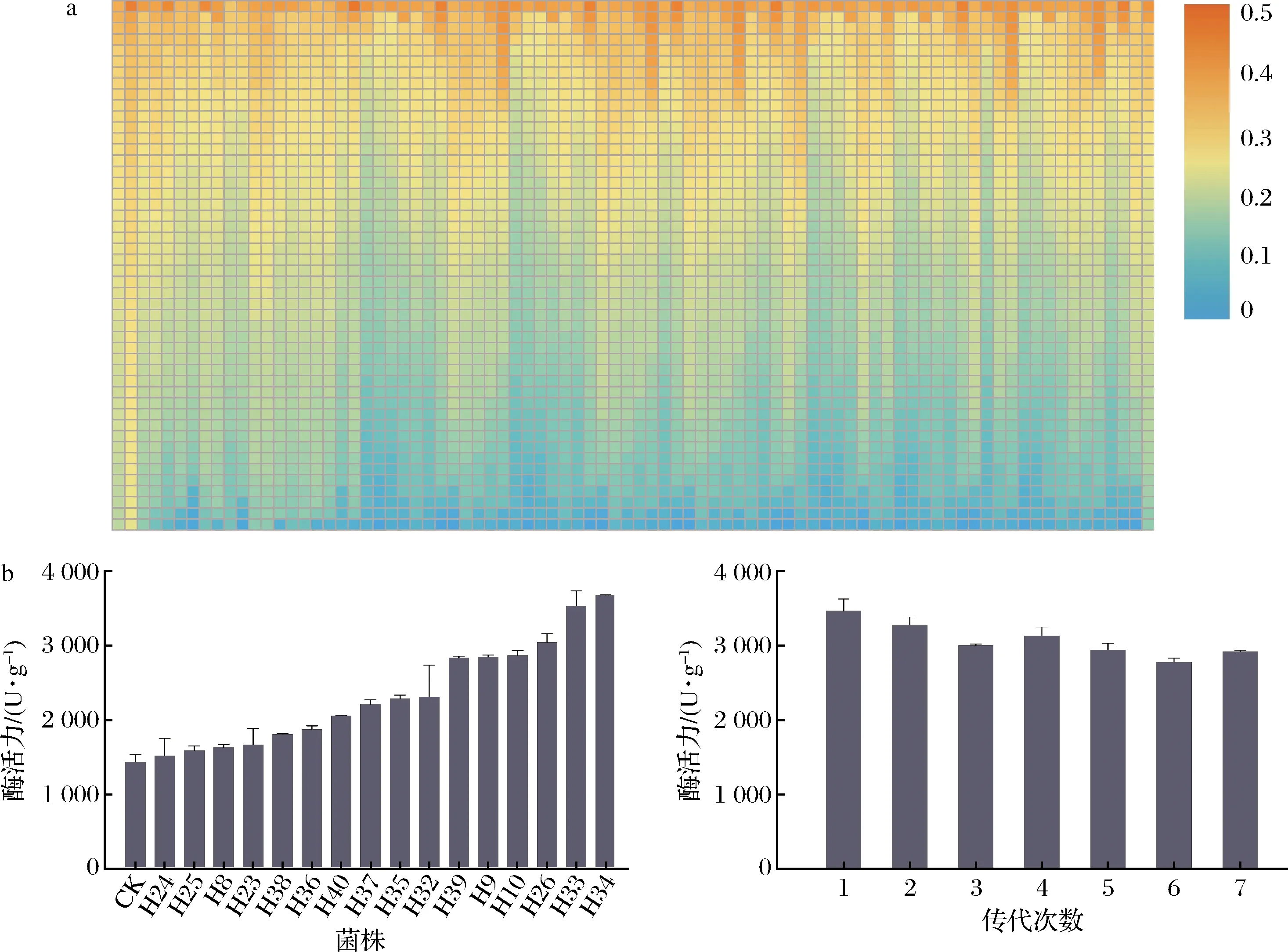
a-初篩結果;b-復篩結果;c-遺傳穩定性驗證結果圖5 篩選結果Fig.5 Screening results
2.2 種曲胞外蛋白鑒定與基因轉錄表達水平分析
通過SDS-PAGE,獲得了米曲霉3.042和高產菌株H34在制曲條件下的胞外蛋白譜(圖6-a)。選取蛋白含量相差明顯的條帶(條帶1、2和3),對其進行MALDI-TOF/TOF比對分析。其中條帶1被鑒定為酸性蛋白酶(aspergillopepsin-1),條帶2被鑒定為堿性蛋白酶(alkaline protease,partial),條帶3被鑒定為中性蛋白酶(neutral protease 2 homolog AO090001000135)。Aspergillopepsin-1,原名Aspergillus peptidase A,是從用于發酵日本傳統清酒和燒酒的微生物中分離出來的[20]。由alp基因編碼的堿性蛋白酶對醬油的品質至關重要,它的主要作用是水解大豆蛋白產生大量的多肽[21],中性蛋白酶是米曲霉分泌的一種重要蛋白酶。醬油企業常用中性蛋白酶的活性作為判斷醬油曲品質的指標之一[13]。
如圖6-b,高產蛋白酶菌株H34中ALP、pepA和AO090001000135的基因轉錄水平分別高于原始菌株米曲霉45%、233%、256%。說明ALP、pepA和AO090001000135基因轉錄水平的提高是引起種曲發酵酶活力提高的主要因素。ARTP處理可能加強了米曲霉ALP、pepA和AO090001000135基因的轉錄水平,進而提高了蛋白酶的酶活力。
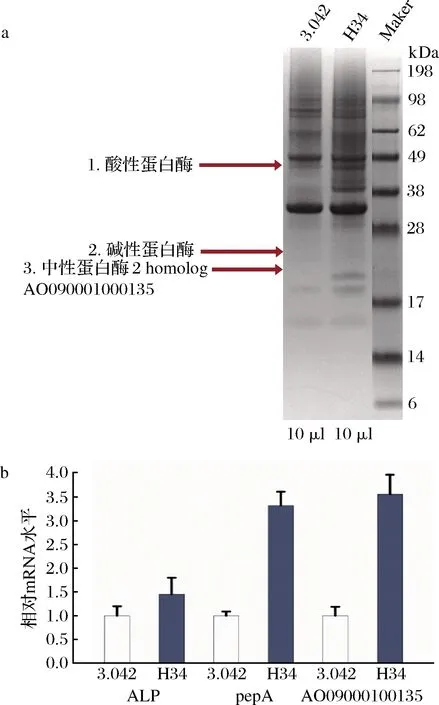
a-種曲胞外鑒定結果;b-基因轉錄表達水平分析圖6 種曲胞外蛋白鑒定與基因轉錄表達水平分析Fig.6 Extracellular protein profiles and gene expression levels of two strains
2.3 兩株米曲霉產醬油風味物質和理化指標的比較分析
氨基酸態氮和總氮2個指標越高,代表醬油中氨基酸的含量豐富,口感鮮美。2個發酵組醬醪中全氮的變化情況如圖7-a所示,誘變菌株H34在發酵終點較出發菌株全氮的質量濃度提高了6%,總氮利用率較出發菌株提高了8.4%,在經濟性方面應用誘變菌株H34將減少原料消耗并增加企業經濟效益。如圖7-b所示,2組醬醪中氨基酸態氮前期積累程度相似,但后期菌株H34的積累量緩慢升高,發酵終點較出發菌株3.042約提高了6.8%。
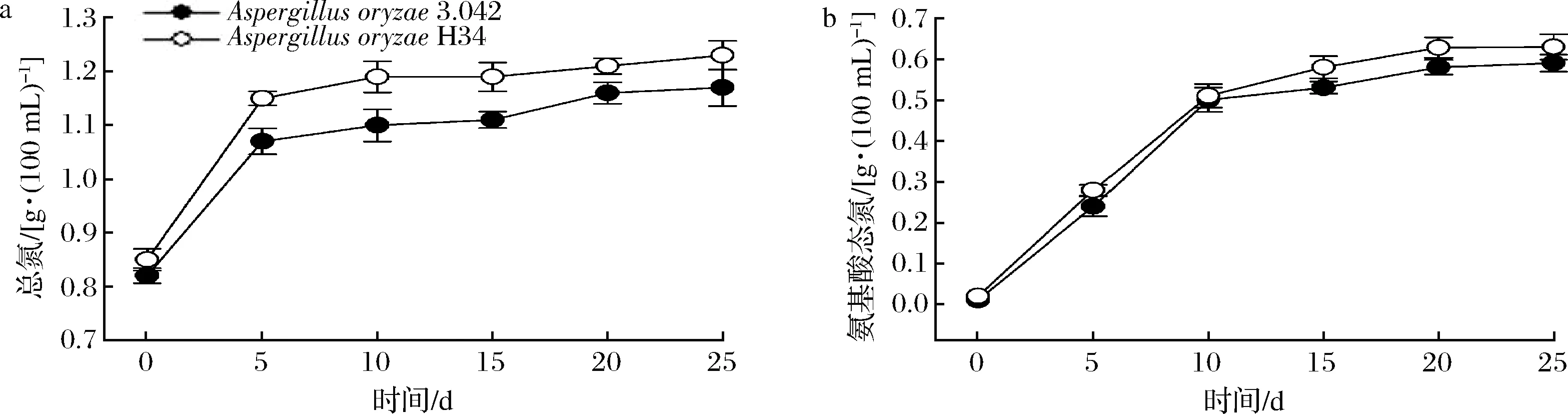
a-總氮;b-氨基酸態氮圖7 醬醪發酵階段總氮和氨基酸態氮變化情況Fig.7 Changes of total nitrogen and amino acid nitrogen during moromi period
游離氨基酸對以蛋白為主要發酵基質的大豆發酵食品獨特滋味和香氣的形成具有重要作用[22],不同的氨基酸可以提供不同的口味[23]。如圖8所示,誘變菌株H34發酵醬油中鮮味、甜味、苦味氨基酸總量相對有所增加,但總體上呈味氨基酸并沒有太大變化。由此推測,米曲霉H34所分泌的蛋白酶更加具有優勢且釀造出的醬油在呈味方面沒有太大變化,可以投入實際生產應用中。
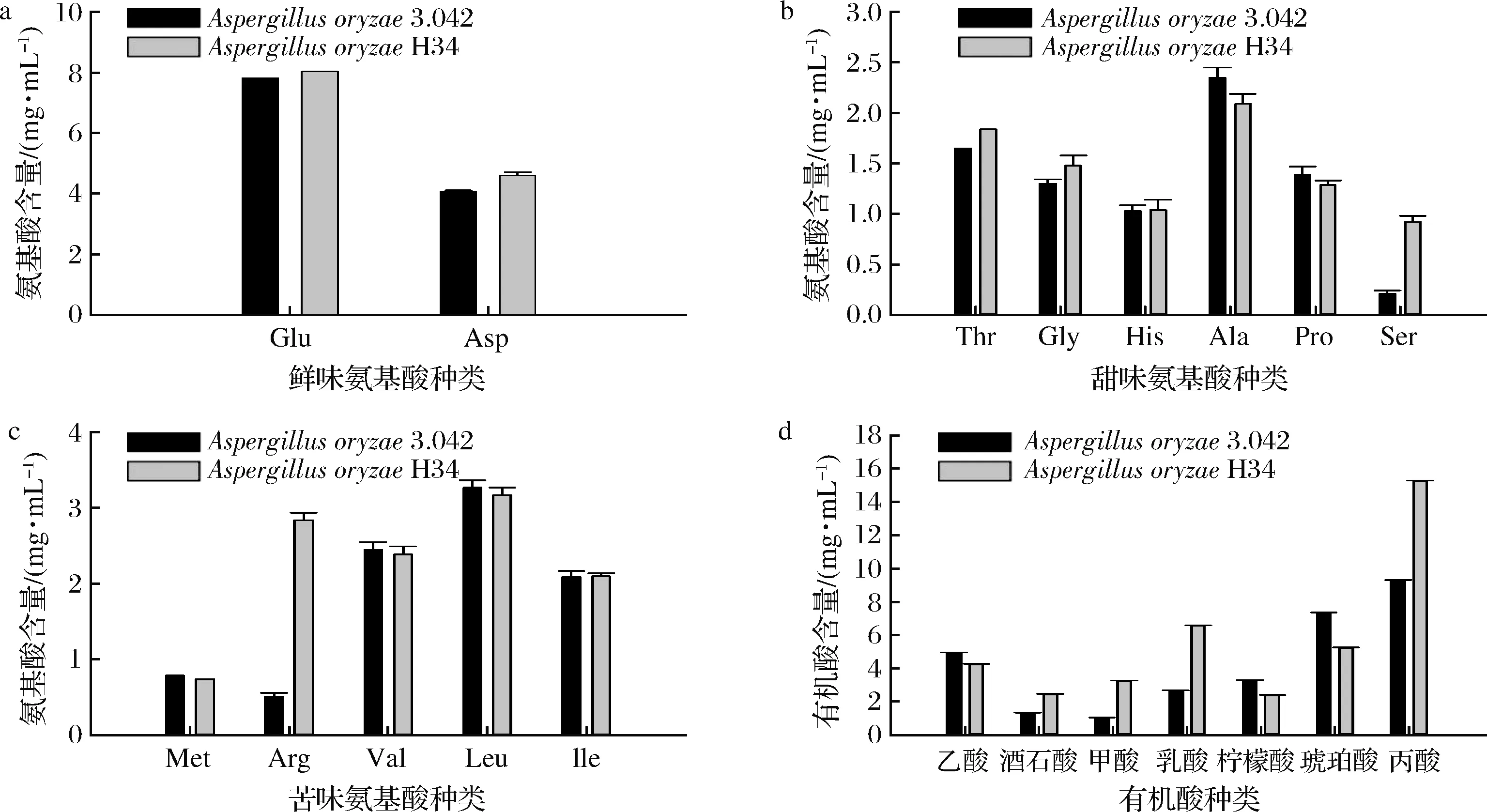
a-鮮味氨基酸;b-甜味氨基酸;c-苦味氨基酸;d-有機酸圖8 醬油樣品中呈味氨基酸含量和有機酸含量Fig.8 Content of flavor amino acids and organic acids in soy sauce samples
利用HPLC法對2個發酵組進行有機酸檢測分析,結果如圖8-d所示。發酵終期H34較出發菌株產醬油中酒石酸、甲酸、乳酸、丙酸含量均增高。且乳酸作為脂類物質前體,乳酸的增多也導致了脂類香氣物質的增多[24]。酒石酸主要是食品中酸味成分的主要來源,構成了食品中的酸性口味[25]。
通過SPME-GC-MS分析方法共檢測出49種揮發性化合物(表3),米曲霉H34發酵的醬油中,醇、酮、醛、酯類物質成分含量均有所提高。醇類主要是在酵母作用下生成,有機酸與醇類作為脂類物質的前體,其含量增多又相應地帶動了脂類物質含量的提高[26]。酯類物質具有香味清、散逸快、遠、突出的特點;醇類物質是醇香和助香劑的來源,是構成脂類物質的前提;醛類通常具有刺激性氣味,適當含量的醛類物質具有調和香氣的作用,并且能與醇類物質反應,形成一系列復雜的風味化合物使醬油風味更加豐富[27]。
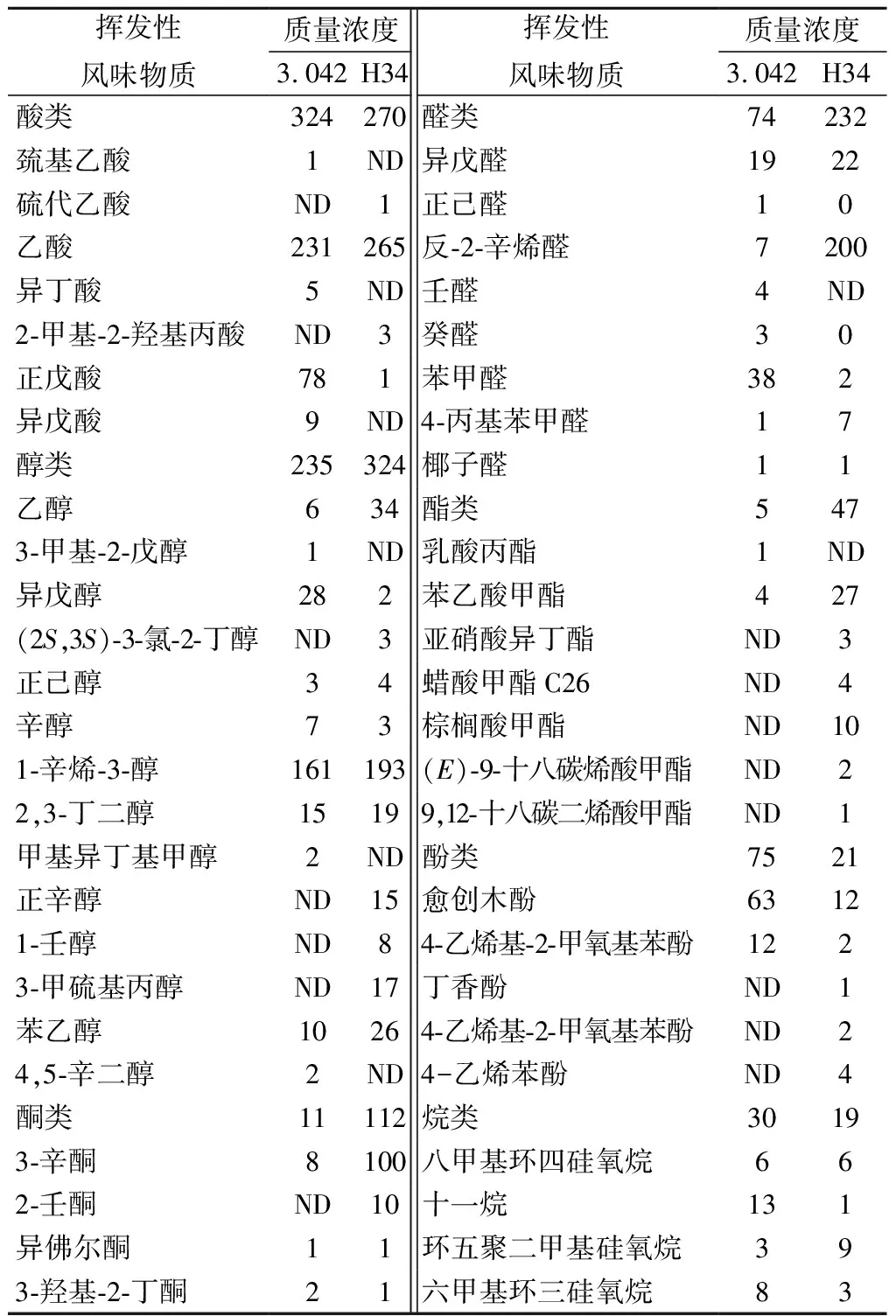
表3 醬醪中的揮發性物質成分分析 單位:μg/mL
3 結論
本研究建立了一種基于流式細胞術的高通量篩選高產蛋白酶米曲霉菌株的方法,以提高米曲霉分泌中性蛋白酶的酶活力,進而提高釀造醬油的全氮利用率和蛋白質利用率,改善最終產品的風味、口感。米曲霉的傳統篩選方法受限于自身單個菌落直徑較大的問題,從而分選通量極小,且對人力的依賴性很強,本研究中流式細胞術的應用使單次通量提高了11倍。
與米曲霉3.042相比,通過誘變育種高通量篩選所篩選的H34菌株使中性蛋白酶的活性增加了2倍以上,酸性蛋白酶和堿性蛋白酶的分泌也相應增加。重要的是,具有優良蛋白酶活性的菌株,可以在醬油釀造過程中一定程度上提高原料的蛋白質利用率。通過實驗室醬油模擬釀造實驗,對米曲霉H34和3.042產醬油的理化指標、氨基酸、有機酸、揮發性物質進行了測定和比較分析,確定了米曲霉H34在實際應用中的優勢。研究結果為改進傳統醬油技術和促進現代生物技術在醬油生產中的應用提供了參考,也對流式細胞術在絲狀真菌選育中的應用具有指導和借鑒作用。

