同時降解兩種真菌毒素的食品級重組酵母培養(yǎng)條件優(yōu)化
夏雨,吳梓鳳,胡修玉,包紅朵,何瑞,秋楊煜,程倩倩,王周平
1(江南大學 食品學院,江蘇 無錫,214122)2(中國生物發(fā)酵產(chǎn)業(yè)協(xié)會,北京,100833) 3(江蘇省農(nóng)業(yè)科學院 農(nóng)產(chǎn)品質(zhì)量安全與營養(yǎng)研究所,江蘇 南京,210014)
全球糧食作物和食品原料中真菌毒素污染問題嚴峻,正嚴重威脅著人類的生命健康[1]。其中,黃曲霉毒素B1(aflatoxin B1,AFB1)和玉米赤霉烯酮(zearalenone,ZEN)作為兩種主要的真菌毒素,容易污染花生、玉米及常見谷物,會造成肝癌、神經(jīng)毒性、破壞生殖系統(tǒng)等嚴重后果[2-4]。對于真菌毒素的降解,除了常用的物理、化學方法外[5-6],生物法被認為是一種可以溫和、高效降解這兩種真菌毒素的有效方法[7-8]。一些已經(jīng)發(fā)現(xiàn)的降解酶能在一定程度上單獨實現(xiàn)對AFB1和ZEN的降解,且大多數(shù)酶都在大腸桿菌、酵母等表達系統(tǒng)中成功實現(xiàn)了重組酶的表達[9-10]。
乳酸克魯維酵母(Kluyveromyceslactis)作為一種食品級酵母,其蛋白質(zhì)分泌能力強、表達系統(tǒng)和發(fā)酵過程安全,被廣泛應(yīng)用于食品、醫(yī)藥工業(yè),也逐漸應(yīng)用于真菌毒素降解領(lǐng)域的研究[11]。孫瑩[12]研究了3種來源的錳過氧化物酶并在乳酸克魯維酵母中實現(xiàn)了表達,優(yōu)化后的酶PhcMnp對AFB1的降解率達到75.71%。徐榮榮[13]將ZEN水解酶ZHD101進行了突變,且在乳酸克魯維酵母中實現(xiàn)了突變體的分泌表達,其對飼料樣品中ZEN的降解率為74.60%。
目前,針對真菌毒素的生物法降解研究,主要集中在降解微生物和酶的篩選、酶的突變改造、重組菌的構(gòu)建與表達、毒素降解機理研究和降解條件優(yōu)化等[14-15],而能降解真菌毒素的重組菌高密度發(fā)酵培養(yǎng)研究偏少,特別是針對食品級乳酸克魯維酵母重組菌的高密度發(fā)酵培養(yǎng)條件優(yōu)化和工藝研究鮮見報道。而發(fā)酵工程的一個重要任務(wù)是提高菌體培養(yǎng)前期的細胞密度,為后期的發(fā)酵產(chǎn)物生產(chǎn)提供更多的生物量[16-17]。因此,為提高食品級重組乳酸克魯維酵母在食品和飼料行業(yè)的商業(yè)化應(yīng)用價值,需要對該菌進行高密度培養(yǎng)條件優(yōu)化研究。
本研究以本實驗室已構(gòu)建的可同時降解AFB1和ZEN的食品級重組乳酸克魯維酵母GG799(pKLAC1-ZPF1)為主要研究對象,通過單因素試驗、響應(yīng)面試驗、正交試驗等方法優(yōu)化了該菌的培養(yǎng)基成分和培養(yǎng)工藝參數(shù),然后以5 L發(fā)酵罐擴大培養(yǎng)來驗證優(yōu)化結(jié)果,旨在為該食品級重組酵母的工業(yè)化應(yīng)用提供理論依據(jù)和參考數(shù)據(jù)。
1 材料與方法
1.1 實驗材料
1.1.1 菌株及質(zhì)粒
宿主菌乳酸克魯維酵母(Kluyveromyceslactis)GG799株、表達載體pKLAC1由本實驗室保藏。可同時降解AFB1和ZEN兩種毒素的食品級重組乳酸克魯維酵母GG799(pKLAC1-ZPF1)由本實驗室構(gòu)建[18],其中ZPF1為能同時降解AFB1和ZEN兩種毒素的融合酶。
1.1.2 培養(yǎng)基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)液體培養(yǎng)基:1.0%酵母提取物、2.0%蛋白胨、2.0%葡萄糖,加蒸餾水至1.0 L,調(diào)pH 6.0,115 ℃滅菌20 min備用。
YEPD固體培養(yǎng)基:1.0%酵母提取物、2.0%蛋白胨、2.0%葡萄糖、2.0%瓊脂粉,加蒸餾水至1.0 L,調(diào)pH 6.0,115 ℃滅菌20 min,冷卻至50 ℃左右混勻后注入9 cm直徑滅菌的平皿,冷卻后備用。
黃豆芽培養(yǎng)基:稱取適量黃豆芽于蒸餾水中,煮沸并維持30 min,過濾棄濾渣,加入20.0 g葡萄糖,再加水至1.0 L,115 ℃滅菌20 min備用。
脫脂乳培養(yǎng)基:7%白砂糖和12%脫脂乳粉,加蒸餾水至1.0 L,于110 ℃滅菌15 min備用。
麥芽汁培養(yǎng)基:根據(jù)市售麥芽汁培養(yǎng)基濃縮液說明書,用蒸餾水進行稀釋,115 ℃滅菌20 min備用。
馬鈴薯葡萄糖肉湯(potato dextrose broth,PDB)培養(yǎng)基:稱取200.0 g去皮、切塊的馬鈴薯于蒸餾水中,煮沸并維持30 min,趁熱過濾棄濾渣,加入20.0 g葡萄糖,再加水至1.0 L,115 ℃滅菌20 min備用。
1.2 儀器與設(shè)備
SBA-40ES雙通道生物傳感分析儀,濟南延和生物科技有限公司;5 L微生物發(fā)酵罐,上海百侖生物科技有限公司;Mobile Minor噴霧干燥機,中國基伊埃工程技術(shù)有限公司;SCIENTZ-10 N真空冷凍干燥機,寧波新芝生物科技股份有限公司;ZQZY-70B振蕩培養(yǎng)箱,上海知楚儀器有限公司;1300系列Ⅱ級A2型生物安全柜,美國賽默飛世爾科技公司;LDZX-50kBS立式壓力蒸汽滅菌器,上海申安醫(yī)療器械廠;超高效液相色譜串聯(lián)四級桿質(zhì)譜聯(lián)用儀,美國沃特世公司;Synergy H1多功能酶標儀,美國伯騰儀器有限公司;LRH-70生化培養(yǎng)箱,上海一恒儀器公司。
1.3 實驗方法
1.3.1 菌株培養(yǎng)方法
菌株活化:從-80 ℃冰箱中取出保存的重組乳酸克魯維酵母GG799(pKLAC1-ZPF1)甘油管,劃線接種于YEPD固體培養(yǎng)基平板中,30 ℃培養(yǎng)3~5 d進行活化。
一級種子液培養(yǎng):挑取平板上的單菌落接種于100.0 mL YEPD液體培養(yǎng)基中,于30 ℃、220 r/min培養(yǎng)18~22 h。
二級種子液培養(yǎng):按照體積分數(shù)1%的接種量將一級種子液轉(zhuǎn)接于含有500.0 mL YEPD培養(yǎng)基中,于30 ℃、220 r/min培養(yǎng)18~22 h。
發(fā)酵罐高密度培養(yǎng):按照體積分數(shù)5%的接種量將OD600=1.0的二級種子液轉(zhuǎn)接于含有2.0 L培養(yǎng)基的5 L發(fā)酵罐中,于28 ℃、220 r/min、通氣量1.5 vvm條件下培養(yǎng)18~35 h。
1.3.2 基礎(chǔ)培養(yǎng)基的篩選方法
將一級種子液分別接入YEPD液體培養(yǎng)基、麥芽汁培養(yǎng)基、PDB培養(yǎng)基、黃豆芽培養(yǎng)基、脫脂乳粉培養(yǎng)基中,各培養(yǎng)基體積均為500.0 mL。于30 ℃、200 r/min培養(yǎng)28 h,每隔2~4 h取樣,測定OD600值。根據(jù)數(shù)據(jù)繪制生長曲線,選擇最佳基礎(chǔ)培養(yǎng)基。
1.3.3 培養(yǎng)基成分的優(yōu)化方法
1.3.3.1 單因素試驗
1.3.3.2 響應(yīng)面試驗
根據(jù)單因素試驗結(jié)果,選擇葡萄糖、蛋白胨、酵母提取物、KH2PO4、MgSO4為主要參考因素,設(shè)計5因素3水平響應(yīng)面試驗表,如增強出版附件表2所示。根據(jù)響應(yīng)面試驗數(shù)據(jù)和分析結(jié)果,確定復(fù)合因素下的最佳培養(yǎng)基成分。
1.3.4 培養(yǎng)參數(shù)的優(yōu)化方法
1.3.4.1 單因素試驗
按照1.3.3的最佳培養(yǎng)基成分,進行培養(yǎng)參數(shù)的單因素優(yōu)化試驗,方案如增強出版附件表3所示。測定生物量和活菌數(shù)以確定單因素下的最佳培養(yǎng)基成分。
1.3.4.2 正交試驗
根據(jù)1.3.4.1單因素試驗結(jié)果,設(shè)計3因素3水平的正交試驗以確定復(fù)合因素下的最佳培養(yǎng)參數(shù),方案如增強出版附件表4所示。
1.3.5 發(fā)酵罐擴大培養(yǎng)試驗方法
經(jīng)過幾十年發(fā)展,電力通信技術(shù)取得較大進步,已與電力工業(yè)深度融合,構(gòu)成支撐智能電網(wǎng)建設(shè)的關(guān)鍵業(yè)務(wù)基礎(chǔ)。由于具備單位質(zhì)量輕、傳輸衰減小、抗干擾能力強、保密性好等優(yōu)點,當前,電力通信光纜已取代電纜、高壓電力線和微波等,成為現(xiàn)代電網(wǎng)通信線路的主要載體。
1.3.5.1 發(fā)酵罐擴大培養(yǎng)方法
按照1.3.3和1.3.4試驗得到的最佳培養(yǎng)基成分和最佳培養(yǎng)條件,對重組酵母進行5 L發(fā)酵罐高密度培養(yǎng)試驗。具體參數(shù)如下:裝液量2.0 L,接種量5%,接入OD600=1.0的二級種子液。發(fā)酵初始條件:28 ℃、通氣量1.5 vvm。控制發(fā)酵過程中溫度28 ℃、溶氧100%。培養(yǎng)基pH優(yōu)化:使用優(yōu)化后的培養(yǎng)基和培養(yǎng)條件,探究3種不同pH(4.5、5.0、5.5)對重組酵母高密度培養(yǎng)時生物量的影響。每隔一定時間取樣,測定生物量和剩余葡萄糖濃度。
1.3.5.2 樣品預(yù)處理及相關(guān)測定方法
在整個擴大培養(yǎng)過程中,周期性取菌液檢測細胞干重和葡萄糖濃度。細胞干重測定方法[19]:取50.0 mL發(fā)酵液于離心管中,8 000 r/min離心10 min,棄上清液收集菌體。將菌體用去離子水洗滌后,放入干燥箱中于80 ℃干燥至恒重,稱重并計算細胞干重。葡萄糖濃度測定采用SBA-40ES雙通道生物傳感分析儀進行。
2 結(jié)果與分析
2.1 重組乳酸克魯維酵母基礎(chǔ)培養(yǎng)基的篩選
選擇YEPD培養(yǎng)基、麥芽汁培養(yǎng)基、黃豆芽培養(yǎng)基、PDB培養(yǎng)基和脫脂乳培養(yǎng)基,在30 ℃、200 r/min條件下培養(yǎng)0~30 h進行對比和篩選試驗。基礎(chǔ)培養(yǎng)基篩選試驗結(jié)果見圖1。從圖1可知,重組酵母細胞生長密度達到最高時的OD600值分別為:YEPD(4.43)>麥芽汁培養(yǎng)基(3.73)>黃豆芽培養(yǎng)基(3.58)>PDB(3.52)>脫脂乳粉(2.99)。因此,選擇YEPD培養(yǎng)基為最佳基礎(chǔ)培養(yǎng)基。在5種不同培養(yǎng)基的培養(yǎng)下,重組乳酸克魯維酵母的生長趨勢接近。0~8 h處于調(diào)整期,菌體生長較緩慢;在8 h后進入對數(shù)期,菌液逐漸渾濁;在18 h時進入穩(wěn)定期,活菌數(shù)進入動態(tài)平衡。
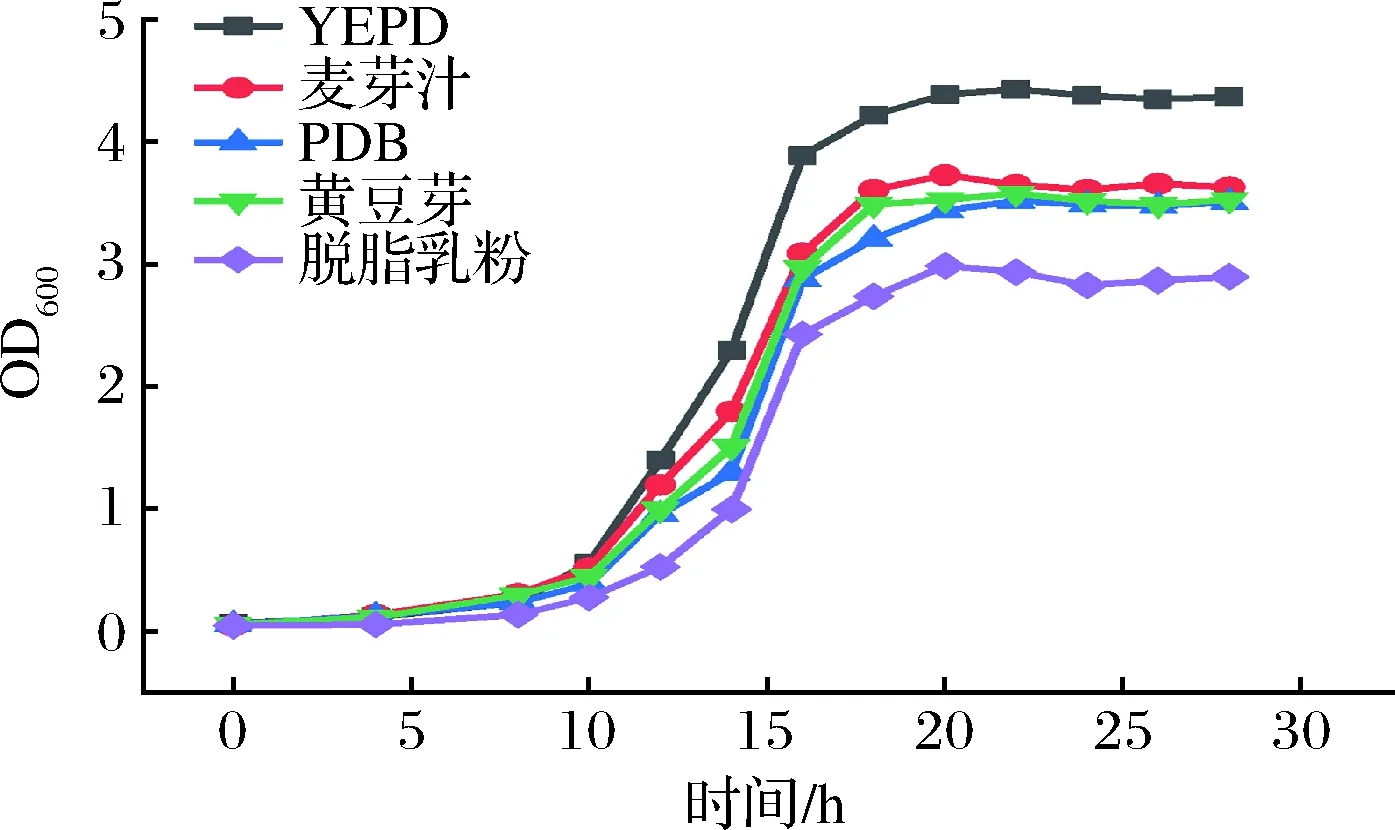
圖1 不同基礎(chǔ)培養(yǎng)基對重組酵母生長的影響Fig.1 Effects of different culture media on the growth of recombinant yeast strains
對數(shù)生長后期或穩(wěn)定期前期的菌體基本已經(jīng)是成熟細胞,具有較強的抗干燥和抗冷凍能力,有利于后續(xù)菌體干燥工藝下的細胞存活率,所以該時期為最佳的菌體收獲時間[20]。本實驗中將培養(yǎng)20 h定為重組乳酸克魯維酵母菌體細胞收集的最佳時間點。
2.2 培養(yǎng)基成分優(yōu)化試驗結(jié)果
2.2.1 單因素優(yōu)化試驗結(jié)果
2.2.1.1 最佳碳源篩選結(jié)果
不同菌種需要不同的生長條件,在培養(yǎng)過程中所需要的碳源種類也不同[21]。在以YEPD為基礎(chǔ)培養(yǎng)基,于30 ℃、200 r/min條件下培養(yǎng)20 h時,其生物量約為(1.15±0.15) g/L,活菌數(shù)約為(2.05±0.36)×108CFU/mL,本研究以YEPD在此條件下獲得的生物量和活菌數(shù)為后續(xù)條件優(yōu)化的對照數(shù)據(jù)。
通過向基礎(chǔ)培養(yǎng)基增添碳源物質(zhì)來篩選最佳的碳源及其濃度,可以有效增加菌種的生物量和活菌數(shù)。圖2顯示了不同碳源及其濃度對重組酵母生長的影響。
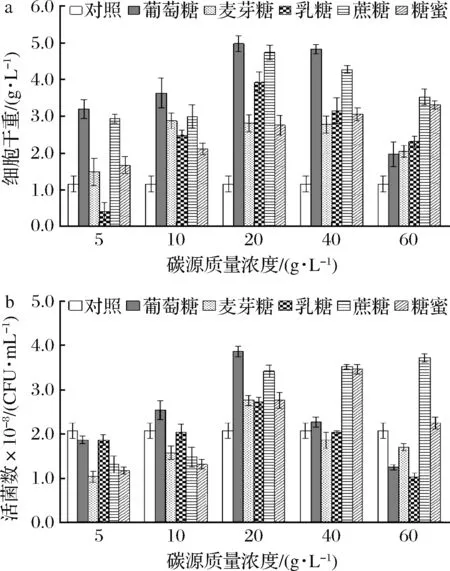
a-細胞干重;b-活菌數(shù)圖2 不同碳源及其含量對重組酵母生長影響Fig.2 Effects of different carbon sources and concentrations on the growth of recombinant yeast strain
從圖2可知,隨著葡萄糖、麥芽糖、乳糖3種碳源濃度的增加,生物量和活菌數(shù)呈現(xiàn)先增大后減小的趨勢,其中葡萄糖的質(zhì)量濃度在20.0 g/L時,生物量和活菌數(shù)最高,分別為4.98 g/L和3.86×108CFU/mL。隨著蔗糖濃度的不斷增加,活菌數(shù)呈現(xiàn)不斷上升趨勢,可能因為蔗糖比葡萄糖有更強的維持培養(yǎng)基低滲環(huán)境的效應(yīng),高濃度下更有利于菌體生長,但整體均小于20.0 g/L葡萄糖所達到的活菌數(shù)[16]。糖蜜是制糖工業(yè)副產(chǎn)品,其中含有蔗糖、葡萄糖、乳糖等多種糖類,是較為理想的低成本材料。但在本研究中效果不如葡萄糖和蔗糖。考慮到作用對比的實際效果,本研究選擇在低濃度時對菌株生長有明顯促進作用的20.0 g/L的葡萄糖作為碳源。
2.2.1.2 最佳氮源篩選結(jié)果
米糠和麩皮是農(nóng)作物加工中的副產(chǎn)品,含有豐富的脂肪、粗蛋白、粗纖維和維生素,可以為微生物發(fā)酵提供氮源[16]。本研究針對上述有機和無機氮源對重組酵母生長影響進行了研究,結(jié)果圖3所示。
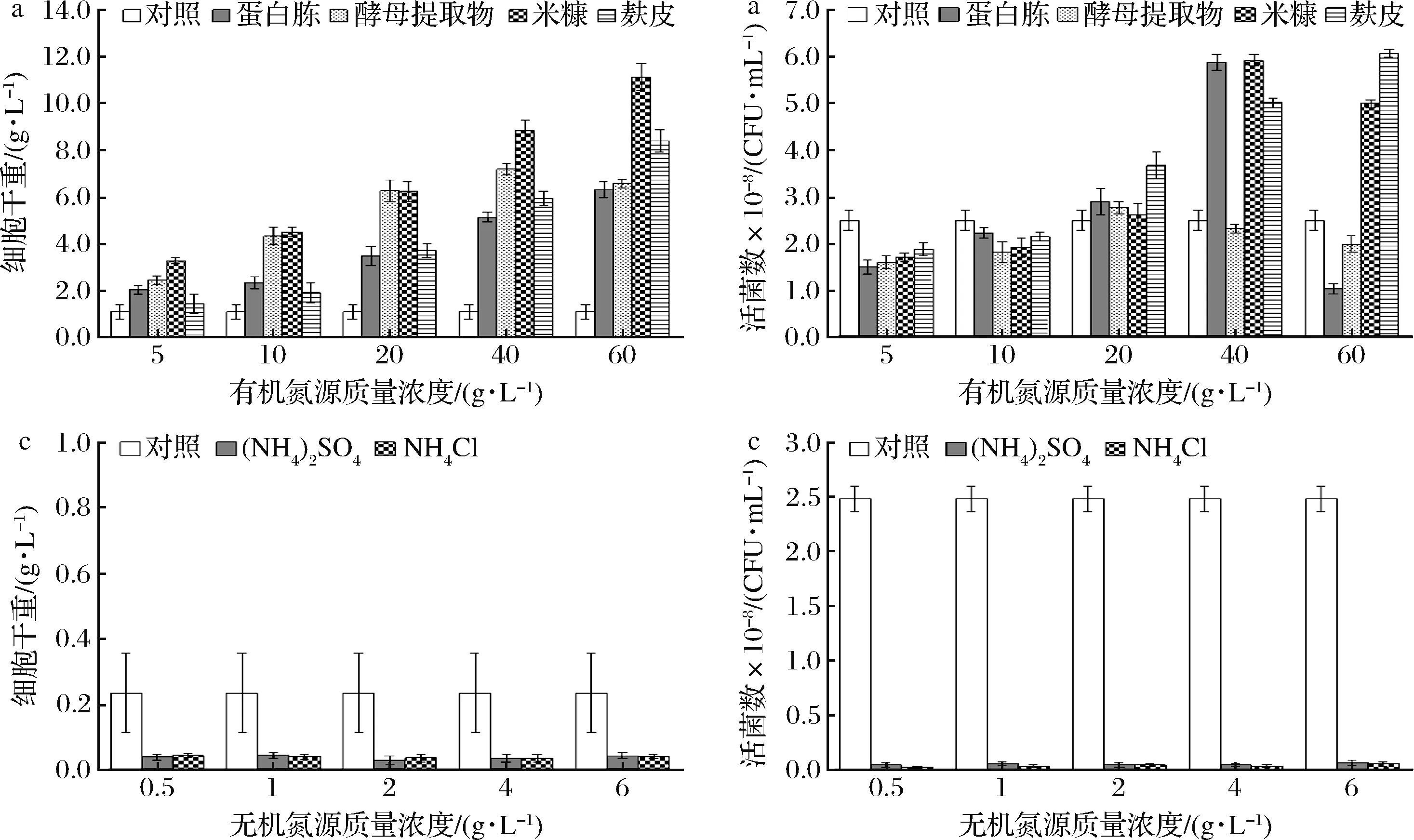
a- 不同有機氮源及其含量下的細胞干重;b- 不同有機氮源及其含量下的活菌數(shù); c- 不同無機氮源及其含量下的細胞干重;d- 不同無機氮源及其含量下的活菌數(shù)圖3 不同氮源及其含量對重組酵母生長影響Fig.3 Effects of different nitrogen sources and concentrations on the growth of recombinant yeast strain
從圖3-c和圖3-d可知,無機氮源基本無法使菌體正常生長。高恩燕[16]研究了無機氮源NH4Cl、(NH4)2SO4和NH4NO3對乳源馬克思克魯維酵母的生長影響也發(fā)現(xiàn),相對于空白組,無機氮源的添加不利于菌株的增殖,本實驗中乳酸克魯維酵母對無機氮源利用情況與該文獻結(jié)果相似。由圖3-a和圖3-b可知,當?shù)鞍纂恕⒚卓贰Ⅺ熎ぷ鳛槲ㄒ坏磿r,其生物量和活菌數(shù)都達到較高水平,其中米糠作為氮源時的生物量最高,達到13.32 g/L。麩皮作為氮源時的活菌數(shù)最高,達到6.03×108CFU/mL,而蛋白胨和酵母提取物作為氮源時的活菌數(shù)基本與麩皮差不多。但是,考慮到本試驗使用的麩皮和米糠顆粒粗大,本身含有的纖維可能占有一定的質(zhì)量,且粗糙顆粒的不均勻性不利于重組酵母制劑化制備,為避免米糠和麩皮粗顆粒對后期研究的影響,本實驗研究選取40.0 g/L蛋白胨和20.0 g/L的酵母提取物作為氮源進行后續(xù)研究。
2.2.1.3 最佳無機鹽篩選結(jié)果
微生物生長中的各類代謝活動需要各種無機鹽離子來參與調(diào)節(jié),如可以調(diào)控細胞通透性和滲透壓的K+、Na+、Ca2+等,可以調(diào)節(jié)細胞內(nèi)部相關(guān)酶活性的Mg2+、Fe3+等[22]。研究了不同無機鹽對重組酵母的影響。從圖4可知,在基礎(chǔ)培養(yǎng)基中添加KCl和CaCl2時,隨著濃度的增加,重組酵母生物量相比對照組稍有增加,但增加量不顯著;而KCl在較低的濃度下活菌數(shù)反而明顯降低,CaCl2濃度對活菌數(shù)影響呈一定的波動。總體而言,KCl、CaCl2對重組酵母生長沒有明顯促進作用。KH2PO4添加量對活菌數(shù)呈現(xiàn)先增加后降低的趨勢,在KH2PO4質(zhì)量濃度4.0 g/L時,生物量達到最大為6.56 g/L,活菌數(shù)則在質(zhì)量濃度6.0 g/L時達到最大值3.88×108CFU/mL。同時發(fā)現(xiàn),隨著MnSO4濃度的增加,重組酵母生物量和活菌數(shù)減少趨勢相當明顯,說明額外添加MnSO4會抑制該菌株的生長。而添加的MgSO4在較低濃度下表現(xiàn)出對該菌株生物量和活菌數(shù)的明顯促進效應(yīng)。綜合分析上述結(jié)果,考慮到培養(yǎng)基成本因素,選取4.0 g/L的KH2PO4和0.5 g/L的MgSO4為培養(yǎng)基最佳添加無機鹽,以便后續(xù)研究。
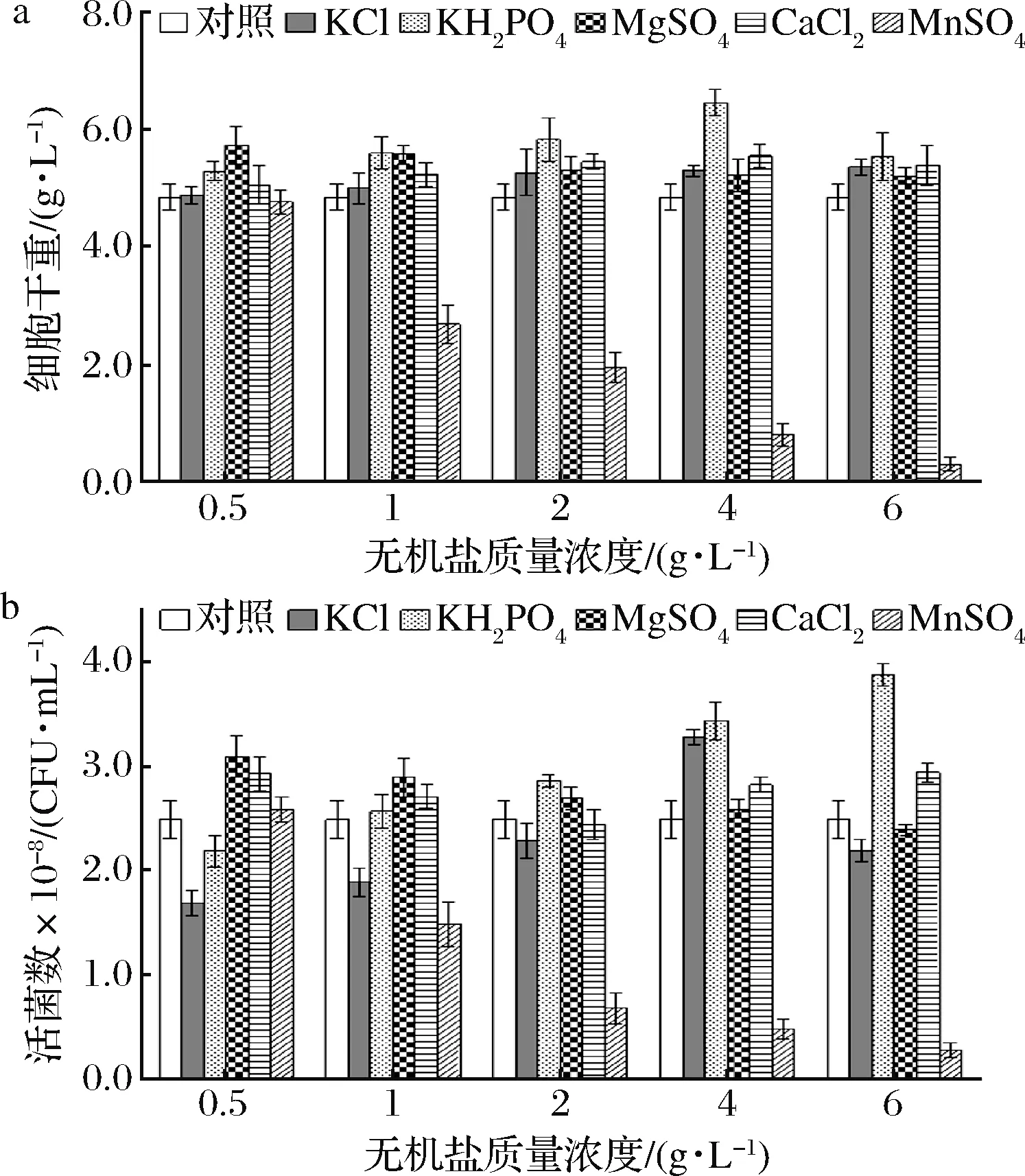
a-細胞干重;b-活菌數(shù)圖4 不同無機鹽及其含量對重組酵母生長影響Fig.4 Effects of different inorganic salts and concentrations on the growth of recombinant yeast strain
2.2.2 響應(yīng)面試驗優(yōu)化結(jié)果
根據(jù)上述單因素篩選結(jié)果,選擇葡萄糖、蛋白胨、酵母提取物、KH2PO4、MgSO4為考察目標進行響應(yīng)面試驗,對培養(yǎng)基進行綜合優(yōu)化。試驗結(jié)果如增強出版附件表5所示,回歸模型如回歸方程所示,方差分析如增強出版附件表6所示。對附表5中實驗數(shù)據(jù)進行回歸分析,可得回歸方程為:Y=6.14+0.344 3A-0.0521B-0.024 1C-0.025 6D-0.180 6E+0.043 5AB-0.269 8AC+0.089 3AD+0.177 0AE+0.112 0BC+0.359 0BD+0.182 0BE-0.789 0CD+0.177 0CE+0.248 5DE-0.277 1A2-0.346 3B2-0.203 8C2+0.058 3D2-0.157 0E2。式中Y為響應(yīng)值,即酵母生物量;A、B、C、D、E分別表示葡萄糖、蛋白胨、酵母提取物、KH2PO4、MgSO4的添加量。
從增強出版附表6方差分析可以看出,該模型非常顯著(F=69.28,P<0.000 1),失擬項(F=0.288 8,P=0.973 6>0.05),相關(guān)系數(shù)R2=0.983 0,校正系數(shù)R2=0.968 8,說明該試驗結(jié)果誤差小,模型與實際預(yù)測值擬合效果較好,可以使用該模型來分析響應(yīng)值的變化。模型中的參數(shù)A、E、AC、AE、BD、CD、CE、DE、A2、B2、C2、E2對重組酵母的生物量的提高有顯著影響,AB項作用效果不顯著。
多維因素相互作用的響應(yīng)面優(yōu)化試驗結(jié)果如圖5所示,按參考文獻[16]方法分析響應(yīng)面等高線變化速度和3D曲面圖的斜度,觀察并比較分析5個因素對響應(yīng)值影響大小:以A(葡萄糖)、B(蛋白胨)、C(酵母提取物)、D(KH2PO4)、E(MgSO4)的含量為影響因子,以生物量即細胞干重為響應(yīng)值進行響應(yīng)面試驗。
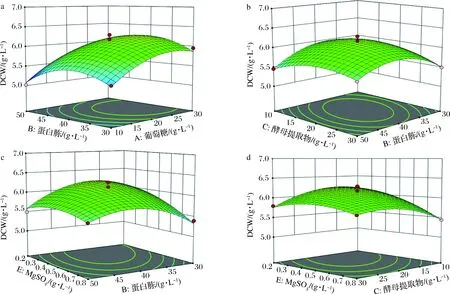
a-葡萄糖質(zhì)量濃度-蛋白胨質(zhì)量濃度;b-蛋白胨質(zhì)量濃度-酵母提取物質(zhì)量濃度 c-蛋白胨質(zhì)量濃度-MgSO4質(zhì)量濃度;d-酵母提取物質(zhì)量濃度-MgSO4質(zhì)量濃度圖5 多維因素相互作用的響應(yīng)面優(yōu)化結(jié)果Fig.5 Response surface optimization results with multi-dimensional factors interactions
試驗對應(yīng)的3D曲面圖及等高線圖部分提示:與A(葡萄糖)相比,B(蛋白胨)方向等高線變化速度快,3D曲面的斜度也更大。由此可知蛋白胨對細胞干重的影響大于葡萄糖。同理,蛋白胨對細胞干重的影響也大于酵母提取物、MgSO4。對方程進行求解,可得到重組酵母生物量最大時的培養(yǎng)基最佳組成為:葡萄糖20.41 g/L,蛋白胨30.46 g/L,酵母提取物24.73 g/L,KH2PO44.48 g/L,MgSO40.65 g/L。在該條件下進行培養(yǎng)試驗,得到的酵母菌體生物量最大值為(6.35±0.17) g/L,是以YEPD為基礎(chǔ)培養(yǎng)基條件下重組酵母生物量的5.5倍。因此通過響應(yīng)面優(yōu)化后得到的培養(yǎng)基成分組成優(yōu)勢明顯,可進行后續(xù)試驗研究。
2.3 培養(yǎng)參數(shù)優(yōu)化試驗結(jié)果
2.3.1 培養(yǎng)參數(shù)的單因素優(yōu)化試驗結(jié)果
采用上述優(yōu)化的培養(yǎng)基組分,探討了不同溫度、轉(zhuǎn)速和pH等參數(shù)對重組酵母生長的影響,以活菌數(shù)為考量指標,單因素優(yōu)化結(jié)果如圖6所示。從圖6-a可知,重組酵母的生物量和活菌數(shù)均隨著溫度的升高呈現(xiàn)先升后降趨勢。在28 ℃時生物量和活菌數(shù)達到最大,分別為6.52 g/L、3.35×108CFU/mL。從圖6-b可知,當轉(zhuǎn)速為200 r/min時,重組酵母的生物量和活菌數(shù)達到最高,分別為6.63 g/L、2.90×108CFU/mL。從圖6-c可知,重組酵母的最佳生長pH為5.0。當pH高于或者低于5.0時,對活菌數(shù)會造成較大的影響。
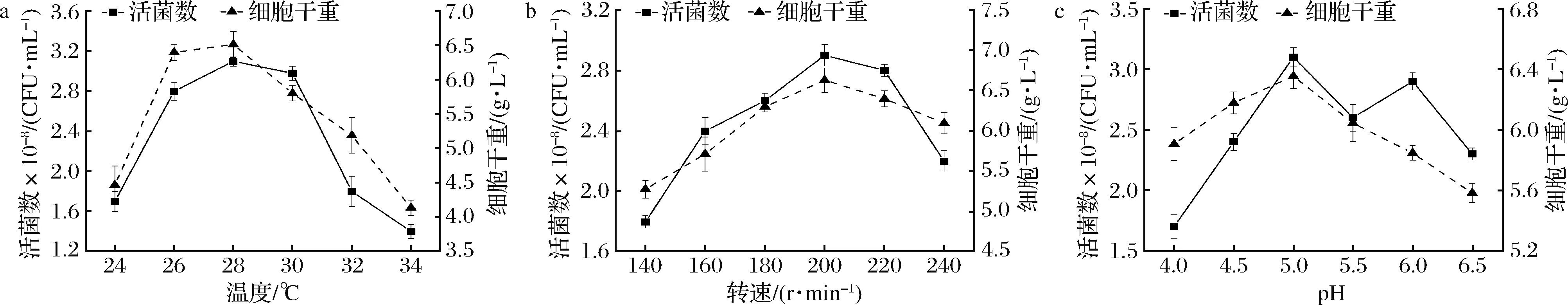
a-培養(yǎng)溫度;b-培養(yǎng)轉(zhuǎn)速;c-培養(yǎng)基pH圖6 不同溫度、轉(zhuǎn)速和pH對重組酵母生長的影響Fig.6 Effects of different temperatures, agitation speeds and pH conditions on the growth of recombinant yeast strain
2.3.2 培養(yǎng)參數(shù)的正交優(yōu)化試驗結(jié)果
對重組酵母的培養(yǎng)參數(shù)進行了正交試驗優(yōu)化,結(jié)果如表1所示。從表1的極差分析結(jié)果可以看出,溫度(A)、轉(zhuǎn)速(B)、pH(C)三種培養(yǎng)參數(shù)對重組酵母生長的生物量影響程度大小:RC>RB>RA,優(yōu)化后方案為C1B3A1。
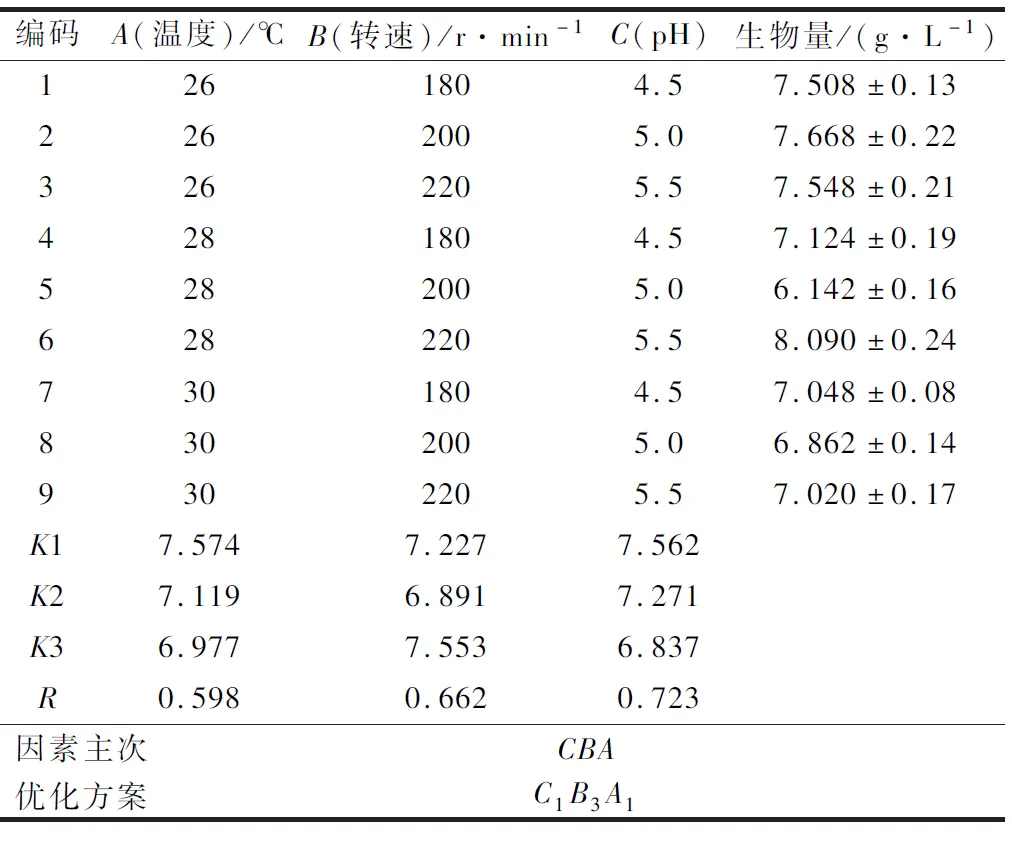
表1 培養(yǎng)條件優(yōu)化的正交試驗結(jié)果Table 1 Orthogonal tests results of culture parameters
綜合以上結(jié)果,培養(yǎng)參數(shù)的最佳組合為:溫度26 ℃、轉(zhuǎn)速220 r/min、初始pH 4.5。在此條件下重復(fù)3次試驗,獲得重組酵母生物量為(8.62±0.22) g/L,該結(jié)果是以YEPD為基礎(chǔ)培養(yǎng)基,于30 ℃、200 r/min條件下培養(yǎng)20 h時重組酵母生物量的7.5倍。
2.4 發(fā)酵罐擴大培養(yǎng)試驗結(jié)果
為使得優(yōu)化后的工藝條件能夠更好地應(yīng)用于工業(yè)化生產(chǎn),對該重組酵母進行了5 L發(fā)酵罐放大培養(yǎng)試驗,驗證上述優(yōu)化條件下的高密度培養(yǎng)結(jié)果。按照上述優(yōu)化的培養(yǎng)基最佳組成和最佳培養(yǎng)參數(shù)進行發(fā)酵罐培養(yǎng)試驗,收獲的生物量與培養(yǎng)基葡萄糖含量變化結(jié)果見圖7。發(fā)酵進行到18~20 h時,培養(yǎng)基葡萄糖含量基本耗盡,需要對其進行恒速補料。考慮到搖瓶培養(yǎng)方式下優(yōu)化培養(yǎng)參數(shù)時,發(fā)現(xiàn)pH對重組酵母的生長有較大影響,故在發(fā)酵罐試驗中再次對pH進行了梯度優(yōu)化試驗,結(jié)果表明使其恒定在pH 5.0條件下,此時重組酵母生長最好,培養(yǎng)35 h其生物量達到(34.05±3.34) g/L,是以YEPD為基礎(chǔ)培養(yǎng)基、于30 ℃、200 r/min條件下培養(yǎng)20 h時重組酵母生物量的29.6倍。
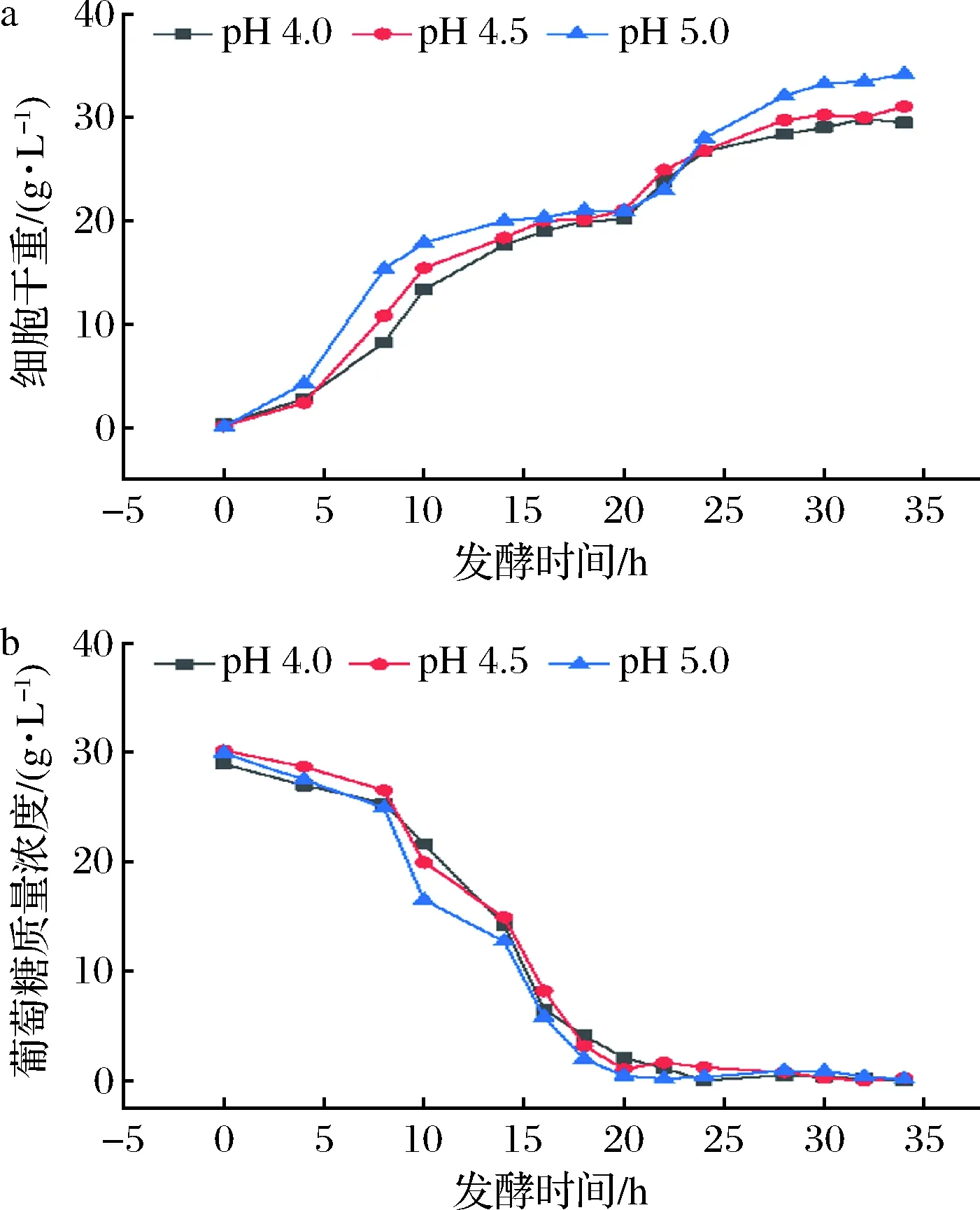
a-細胞干重;b-培養(yǎng)基葡萄糖含量圖7 不同pH下重組酵母5 L發(fā)酵罐擴大培養(yǎng)結(jié)果Fig.7 Expended cultivation of recombinant yeast strain in 5 L fermentor at different pH conditions
3 結(jié)論與討論
乳酸克魯維酵母GG799(pKLAC1-ZPF1)是一種可同時降解AFB1和ZEN的食品級重組酵母,對食品和飼料行業(yè)原料中真菌毒素的降解具有重要潛在應(yīng)用價值。本研究在單因素試驗優(yōu)化的基礎(chǔ)上,利用響應(yīng)面試驗和正交試驗優(yōu)化了該重組酵母的培養(yǎng)基成分和培養(yǎng)參數(shù)。確定了搖瓶培養(yǎng)優(yōu)化的培養(yǎng)基最佳成分為:葡萄糖20.41 g/L、蛋白胨30.46 g/L、酵母提取物24.73 g/L、KH2PO44.48 g/L、MgSO40.65 g/L;最佳培養(yǎng)參數(shù)為:26 ℃、220 r/min、初始pH 4.5。在上述優(yōu)化條件下進行發(fā)酵罐擴大培養(yǎng)并繼續(xù)優(yōu)化了培養(yǎng)pH,獲得的生物量是搖瓶培養(yǎng)對照條件下的29.6倍。本研究優(yōu)化并提高了食品級重組乳酸克魯維酵母的生物量,為GG799(pKLAC1-ZPF1)株將來工業(yè)化應(yīng)用提供了重要理論依據(jù)和參考數(shù)據(jù)。

