銀杏肽對(duì)急性酒精性肝損傷小鼠的保護(hù)作用
鄭義,李詩(shī)穎,糜心怡,陳琳,李闖,梁一凡
1(徐州工程學(xué)院 食品與生物工程學(xué)院,江蘇 徐州,221018) 2(江蘇省食品資源開發(fā)與質(zhì)量安全重點(diǎn)建設(shè)實(shí)驗(yàn)室,江蘇 徐州,221018)
食源性生物活性肽被認(rèn)為是新一代的生物活性調(diào)節(jié)劑[1],主要來(lái)源于動(dòng)物蛋白和植物蛋白。食源性生物活性肽不僅具有易消化吸收、安全性高的特點(diǎn),還具有抗氧化、抗疲勞、抗炎、抗菌、調(diào)節(jié)免疫、降血壓、降血脂和抗腫瘤等廣泛的生理功能,是極具開發(fā)利用潛力的功能因子[2-3]。活性肽的制備方法主要有化學(xué)合成法、微生物發(fā)酵法和蛋白酶解法等,其中最常使用的是蛋白酶解法,已應(yīng)用于數(shù)百種食源性生物活性肽的制備[4-5]。

酒精性肝損傷是臨床上最常見的肝病之一,從單純性肝脂肪變性可進(jìn)展為肝纖維化和肝硬化,酒精性肝硬化的死亡率占肝硬化死亡率的46.7%[17]。我國(guó)酒精性肝損傷的發(fā)病率逐年升高,由2000年的2.27%增加到2015年的8.74%,據(jù)估計(jì),發(fā)病率將不斷升高[18]。酒精性肝損傷的發(fā)病機(jī)制較為復(fù)雜,目前尚未完全闡明,但氧化應(yīng)激和炎性損傷被普遍認(rèn)為在該病的發(fā)生和進(jìn)展中具有關(guān)鍵作用[19-20]。攝入生物活性肽,拮抗酒精代謝誘導(dǎo)的氧化應(yīng)激和炎性損傷,被認(rèn)為是一種有效的輔助治療酒精性肝損傷的策略。動(dòng)物實(shí)驗(yàn)表明,玉米肽[21-22]、海洋膠原蛋白肽[23]和核桃低聚肽[24]等生物活性肽對(duì)酒精性肝損傷都有較好的保護(hù)作用。目前有關(guān)GBP對(duì)酒精性肝損傷保護(hù)作用的研究未見報(bào)道。
本研究建立急性酒精性肝損傷小鼠模型,基于氨基轉(zhuǎn)移酶、血脂、促炎細(xì)胞因子、抗氧化酶和氧化損傷產(chǎn)物水平等生理生化指標(biāo),評(píng)價(jià)GBP對(duì)急性酒精性肝損傷小鼠的保護(hù)作用,旨在為GBP的開發(fā)利用提供理論依據(jù)。
1 材料與方法
1.1 材料與儀器
銀杏采自江蘇省邳州市;雄性昆明小鼠(20±2)g購(gòu)自濟(jì)南朋悅實(shí)驗(yàn)動(dòng)物繁育有限公司,生產(chǎn)許可證號(hào)SCXY (魯) 20190003。
堿性蛋白酶(2.25×105U/g),丹麥諾維信公司;丙氨酸氨基轉(zhuǎn)移酶(alanine aminotransferase, ALT)、天冬氨酸氨基轉(zhuǎn)移酶(aspartate aminotransferase, AST)、甘油三酯(triglyceride, TG)、總膽固醇(total cholesterol, TC)、IL-1β、IL-6和TNF-α,肝臟過氧化氫酶(catalase, CAT)、谷胱甘肽過氧化物酶(glutathione peroxidase, GSH-Px)、總超氧化物歧化酶(total superoxide dismutase, T-SOD)、丙二醛(malondialdehyde, MDA)和蛋白質(zhì)羰基(protein carbonyl group, PCG)試劑盒,南京建成生物工程研究所;還原型谷胱甘肽片(國(guó)藥準(zhǔn)字H20050667),重慶藥友制藥有限責(zé)任公司;其他試劑均為國(guó)產(chǎn)分析純。
FA2104 N電子分析天平、723C可見分光光度計(jì),上海精密科學(xué)儀器有限公司;BILON92-IID超聲波細(xì)胞破碎儀,上海比朗儀器有限公司;LGJ-18A冷凍干燥機(jī),北京四環(huán)科學(xué)儀器廠;TGL-16G型臺(tái)式離心機(jī),上海安亭科學(xué)儀器廠;SHZ-D(Ш)循環(huán)水式真空泵,鄭州長(zhǎng)城科工貿(mào)有限公司。
1.2 實(shí)驗(yàn)方法
1.2.1 銀杏蛋白的制備
銀杏去殼后,60 ℃下烘干,粉碎過60目篩,石油醚脫脂,得到脫脂銀杏粉。采用超聲輔助堿提酸沉法制備銀杏蛋白。按液料比20∶1(mL∶g)將脫脂銀杏粉與去離子水混合,調(diào)節(jié)pH至10.0,超聲功率200 W,提取溫度50 ℃,提取時(shí)間40 min。提取結(jié)束后,以3 500 r/min離心20 min,收集上清液,調(diào)節(jié)pH至銀杏蛋白的等電點(diǎn)4.4,4 500 r/min離心20 min,將所得沉淀透析(截留相對(duì)分子質(zhì)量3.5 kDa)72 h,濃縮,冷凍干燥,得到銀杏蛋白,考馬斯亮藍(lán)法測(cè)得純度為84.63%。
1.2.2 銀杏肽的制備
按液料比15∶1(mL∶g)將銀杏蛋白與去離子水配成懸液,沸水浴10 min滅內(nèi)源性酶;調(diào)節(jié)pH至8.5,加入4 000 U/g堿性蛋白酶,50 ℃振蕩酶解,期間不斷補(bǔ)加NaOH溶液,使pH恒定,待水解度至25%時(shí)終止反應(yīng);酶解后調(diào)節(jié)pH至7.0,沸水浴5 min滅酶,8 000 r/min離心20 min,將上清液冷凍干燥后得到銀杏肽。水解度的測(cè)定采用甲醛滴定法[25]。
1.2.3 動(dòng)物分組與處理
該研究遵循的程序符合本院實(shí)驗(yàn)動(dòng)物倫理委員會(huì)所制定的倫理學(xué)標(biāo)準(zhǔn),得到該委員會(huì)批準(zhǔn)。60只雄性昆明小鼠經(jīng)適應(yīng)性飼養(yǎng)后,隨機(jī)分為6組:正常組、模型組、3組GBP組和陽(yáng)性對(duì)照組。低、中和高劑量GBP組分別灌胃GBP 50、100和200 mg/kg,連續(xù)21 d。陽(yáng)性對(duì)照組每天灌胃100 mg/kg還原型谷胱甘肽;正常組和模型組每天灌胃等量去離子水。第22天,除正常組外,其余組小鼠每隔12 h灌胃體積分?jǐn)?shù)50%酒精(12 mL/kg),連續(xù)3次[26-28]。末次灌胃12 h后,頸椎脫臼法處死小鼠,無(wú)菌摘取肝臟和脾臟,稱量小鼠體質(zhì)量和臟器質(zhì)量,根據(jù)臟器質(zhì)量與體質(zhì)量比,計(jì)算臟器系數(shù)。
1.2.4 血清生理生化指標(biāo)測(cè)定
小鼠眼眶后靜脈叢采血,37 ℃水浴1 h,3 500 r/min離心10 min,收集上清液即為血清,按照試劑盒說(shuō)明書測(cè)定ALT、AST、TG、TC、IL-1β、IL-6和TNF-α水平。
1.2.5 肝臟抗氧化酶與氧化損傷產(chǎn)物水平測(cè)定
取肝臟,置于玻璃組織勻漿器,加入一定體積的生理鹽水,制備質(zhì)量濃度100 g/L組織勻漿,3 500 r/min離心10 min,收集上清液,按照試劑盒說(shuō)明書測(cè)定CAT、GSH-Px、T-SOD、MDA和PCG水平。
1.2.6 數(shù)據(jù)處理與統(tǒng)計(jì)分析
采用SPSS 24.0軟件進(jìn)行數(shù)據(jù)統(tǒng)計(jì)與分析,結(jié)果以平均值±標(biāo)準(zhǔn)差表示,組間多重比較采用Duncan法。
2 結(jié)果與分析
2.1 對(duì)小鼠臟器系數(shù)的影響
肝臟系數(shù)和脾臟系數(shù)可反映肝脾腫大的程度,而肝脾腫大是酒精性肝損傷臨床上常見的癥狀[29]。由圖1可知,模型組小鼠血清肝臟系數(shù)和脾臟系數(shù)顯著高于正常組(P<0.05),提示酒精暴露造成了小鼠肝脾腫大。與模型組相比,GBP組小鼠肝臟系數(shù)和脾臟系數(shù)顯著下降(P<0.05),中劑量GBP組脾臟系數(shù)以及高劑量GBP組肝臟系數(shù)和脾臟系數(shù)恢復(fù)至正常組水平(P>0.05),表明GBP緩解了酒精暴露導(dǎo)致的小鼠肝脾腫大。
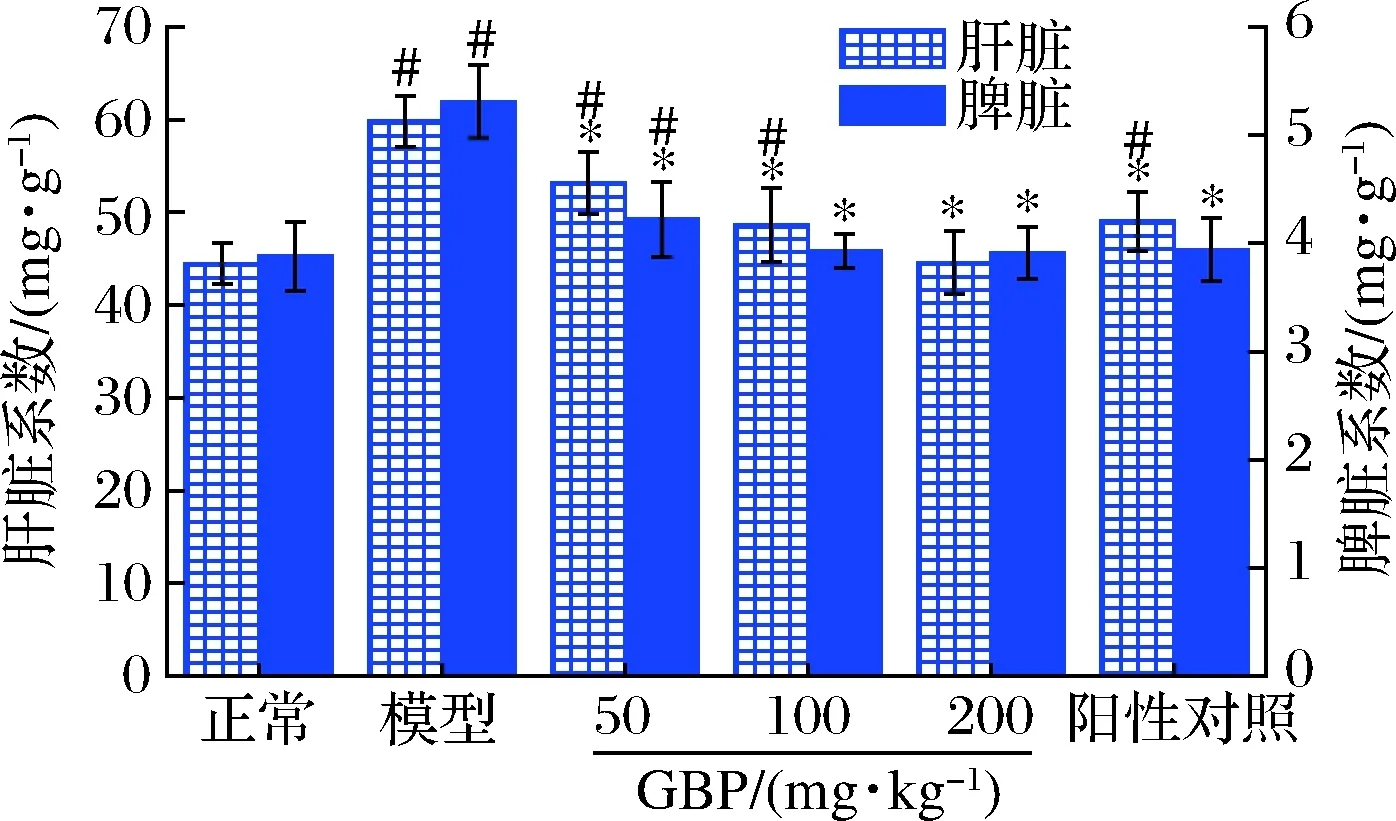
圖1 銀杏肽對(duì)酒精性肝損傷小鼠臟器系數(shù)的影響Fig.1 Effects of G.biloba peptides on organ index in acute alcoholic liver injury mice *P<0.05,表示與模型組比較;#P<0.05,表示與正常組比較; (n=10)(下同)
2.2 對(duì)小鼠血清氨基轉(zhuǎn)移酶水平的影響
酒精既有脂溶性又有水溶性,極易造成細(xì)胞膜損傷,可改變細(xì)胞膜的結(jié)構(gòu),使細(xì)胞膜介電常數(shù)、流動(dòng)性、通透性等物理性質(zhì)發(fā)生變化,造成細(xì)胞膜脂質(zhì)過氧化[30-31]。ALT和AST分別存在于生物體肝細(xì)胞的胞漿和線粒體中,生理狀態(tài)下血清中ALT和AST水平極低;當(dāng)肝細(xì)胞膜受損后,ALT和AST滲漏至血清,導(dǎo)致血清ALT和AST水平急劇升高,ALT和AST水平是監(jiān)測(cè)肝功能是否受損的敏感標(biāo)志物。
圖2為GBP對(duì)急性酒精性肝損傷小鼠血清ALT和AST水平的影響。模型組小鼠血清ALT和AST水平分別是正常組的3.8和4.7倍,2種氨基轉(zhuǎn)移酶水平顯著升高(P<0.05),表明酒精暴露造成了小鼠肝細(xì)胞受損,致使血清ALT和AST水平升高。
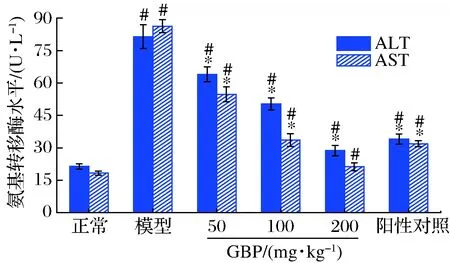
圖2 銀杏肽對(duì)酒精性肝損傷小鼠血清ALT和 AST水平的影響Fig.2 Effects of G.biloba peptides on serum ALT and AST levels in acute alcoholic liver injury mice
GBP組小鼠血清ALT和AST活性顯著低于模型組(P<0.05),且呈劑量依賴性,高劑量GBP組小鼠血清AST恢復(fù)至正常水平(P>0.05),提示GBP可緩解酒精暴露導(dǎo)致的小鼠肝細(xì)胞損傷。陽(yáng)性對(duì)照還原型谷胱甘肽也能顯著降低小鼠血清中這2種氨基轉(zhuǎn)移酶的水平(P<0.05)。
2.3 對(duì)小鼠血清血脂水平的影響
脂質(zhì)代謝紊亂是酒精性肝損傷的常見癥狀,酒精代謝過程中可誘導(dǎo)脂肪變性,導(dǎo)致脂肪沉積在肝細(xì)胞中,同時(shí)酒精可影響血脂轉(zhuǎn)運(yùn),造成血清TG和TC水平異常[32]。圖3為GBP對(duì)急性酒精性肝損傷小鼠血清TG和TC水平的影響。模型組小鼠血清TG和TC水平分別是正常組的2.2和2.5倍,顯著高于正常組(P<0.05),提示酒精暴露可導(dǎo)致脂質(zhì)代謝紊亂,這與前人的研究結(jié)果一致[33-34]。給藥GBP后,小鼠血清TG和TC水平顯著低于模型組,表明GBP干預(yù)緩解了急性酒精暴露誘導(dǎo)的脂質(zhì)代謝紊亂。
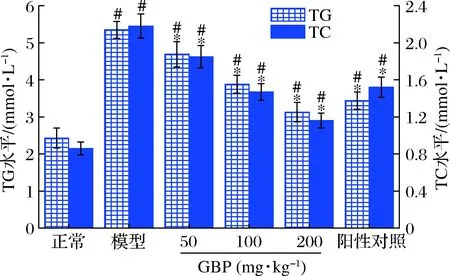
圖3 銀杏肽對(duì)酒精性肝損傷小鼠血清TG和TC水平的影響Fig.3 Effects of G.biloba peptides on serum TG and TC levels in acute alcoholic liver injury mice
2.4 對(duì)小鼠血清炎性細(xì)胞因子水平的影響
庫(kù)普弗細(xì)胞在酒精性肝損傷的進(jìn)展中扮演著重要的角色,酒精暴露會(huì)刺激庫(kù)普弗細(xì)胞通過MyD88介導(dǎo)的Toll樣受體4(toll like receptor 4, TLR4)通路產(chǎn)生IL-1β、IL-6和TNF-α等促炎細(xì)胞因子,而這些促炎細(xì)胞因子會(huì)導(dǎo)致脂肪變性,甚至造成肝細(xì)胞炎性損傷和凋亡,加劇急性酒精性肝損傷的進(jìn)展[35-36]。
圖4為GBP對(duì)急性酒精性肝損傷小鼠血清IL-1β、IL-6和TNF-α水平的影響。由圖4可知,模型組小鼠血清IL-1β、IL-6和TNF-α水平分別是正常組的1.9、2.3和1.9倍,顯著高于正常組(P<0.05),提示酒精暴露可誘導(dǎo)小鼠肝細(xì)胞發(fā)生炎性損傷。與模型組相比,GBP組小鼠血清中IL-1β、IL-6和TNF-α水平顯著降低(P<0.05),且呈劑量依賴性;高劑量GBP組小鼠血清TNF-α可恢復(fù)至正常水平(P>0.05),提示GBP通過抗炎途徑發(fā)揮其對(duì)急性酒精性肝損傷小鼠的保護(hù)作用。與模型組相比,還原型谷胱甘肽也能顯著降低小鼠血清中IL-1β、IL-6和TNF-α水平(P<0.05)。
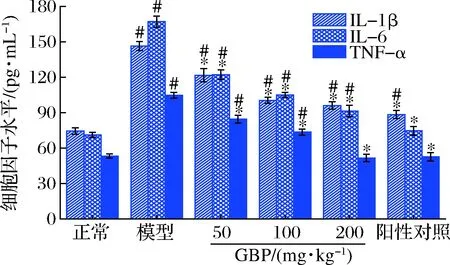
圖4 銀杏肽對(duì)酒精性肝損傷小鼠血清IL-1β、IL-6和 TNF-α水平的影響Fig.4 Effects of G.biloba peptides on serum IL-1β, IL-6 and TNF-α levels in acute alcoholic liver injury mice
2.5 對(duì)小鼠肝臟抗氧化酶活性的影響
肝臟是機(jī)體內(nèi)酒精生物轉(zhuǎn)化的主要場(chǎng)所,也是酒精毒性作用的主要靶器官。酒精代謝過程中會(huì)產(chǎn)生過量的活性氧(reactive oxygen species, ROS),造成機(jī)體氧化與抗氧化防御系統(tǒng)的失衡,從而導(dǎo)致氧化應(yīng)激,這被認(rèn)為是急性酒精性肝損傷發(fā)生與進(jìn)展的重要機(jī)制之一[37]。CAT、GSH-Px和T-SOD是機(jī)體抗氧化酶促防御系統(tǒng)的主要組分,過量的ROS可作用于CAT、GSH-Px和T-SOD等抗氧化酶,使其結(jié)構(gòu)和構(gòu)象發(fā)生改變,導(dǎo)致抗氧化酶活性降低[38]。
GBP對(duì)急性酒精性肝損傷小鼠肝臟CAT、GSH-Px和T-SOD活性的影響如圖5所示。模型組小鼠肝臟CAT、GSH-Px和T-SOD活性分別比正常組降低了46.4%、32.8%和28.5%,3種抗氧化酶活性均顯著低于正常組(P<0.05),提示酒精暴露致使小鼠肝臟處于氧化應(yīng)激狀態(tài)。給藥GBP后,小鼠肝臟CAT、GSH-Px和T-SOD活性顯著高于模型組(P<0.05),高劑量GBP組小鼠GSH-Px和T-SOD活性恢復(fù)至正常水平(P>0.05),表明GBP通過提高抗氧化酶活性,發(fā)揮對(duì)急性酒精性肝損傷小鼠的保護(hù)作用。
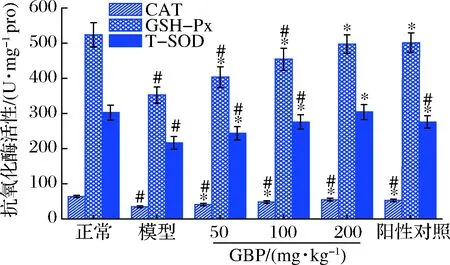
圖5 銀杏肽對(duì)酒精性肝損傷小鼠肝臟CAT、GSH-Px和 T-SOD活性的影響Fig.5 Effects of G.biloba peptides on liver CAT, GSH-Px and T-SOD activities in acute alcoholic liver injury mice
2.6 對(duì)小鼠肝臟氧化損傷產(chǎn)物水平的影響
酒精代謝過程中產(chǎn)生的過量ROS可作用于機(jī)體內(nèi)的蛋白質(zhì)和脂質(zhì)等生物分子,造成蛋白質(zhì)和脂質(zhì)的氧化損傷。MDA是脂質(zhì)過氧化的終產(chǎn)物,PCG是蛋白質(zhì)氧化損傷的產(chǎn)物,MDA和PCG水平是評(píng)估脂質(zhì)和蛋白質(zhì)氧化損傷的敏感標(biāo)志物[39-40]。GBP對(duì)急性酒精性肝損傷小鼠肝臟MDA和PCG水平的影響如圖6所示。模型組小鼠肝臟MDA和PCG水平顯著高于正常組(P<0.05),表明酒精攝入造成脂質(zhì)和蛋白質(zhì)氧化損傷。灌胃給藥GBP后,MDA和PCG水平以劑量依賴的方式顯著降低(P<0.05),提示GBP可緩解酒精暴露誘導(dǎo)的肝組織氧化損傷。
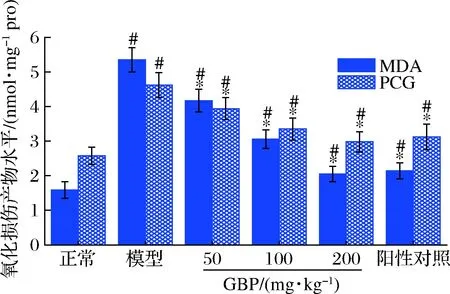
圖6 銀杏肽對(duì)酒精性肝損傷小鼠肝臟MDA和 PCG水平的影響Fig.6 Effects of G.biloba peptides on liver MDA and PCG levels in acute alcoholic liver injury mice
3 結(jié)論
GBP對(duì)急性酒精性肝損傷小鼠具有較好保護(hù)作用,能緩解酒精性肝損傷小鼠的肝脾腫大,降低小鼠血清ALT和AST活性,抑制血清TG和TC水平,下調(diào)血清IL-1β、IL-6和TNF-α水平,提高肝臟CAT、GSH-Px和T-SOD活性,降低肝臟MDA和PCG水平。結(jié)果顯示,GBP通過抗氧化和抗炎途徑發(fā)揮其對(duì)急性酒精性肝損傷小鼠的保護(hù)作用,作用機(jī)制與提高機(jī)體抗氧化酶活性和抑制促炎細(xì)胞因子表達(dá)有關(guān)。

