小陷胸湯對高血脂小鼠血管內皮的保護作用
曾江琴,孫勤國,徐鴻婕,丁曉明,牟艷杰,蔣躍文
(1.武漢市第三醫院中醫科,武漢 430060;2.湖北中醫藥大學,武漢 430061)
高血脂癥(hyperlipdemia,HLP)是一種因體內血脂水平過高引發的全身性脂質代謝紊亂疾病[1],常見于中老年人,隱匿性強,沒有明顯的臨床癥狀,但長期得不到改善會誘發冠心病、動脈粥樣硬化等一系列心腦血管疾病[2-3]。 有研究表明,HLP 極易損傷血管內皮細胞,造成血管內皮功能障礙,進而加重心腦血管疾病[4]。 中醫認為,HLP 的核心發病機制為痰瘀阻絡[5-6],以化痰祛瘀通絡方能向愈[7]。小陷胸湯由黃連、瓜蔞、半夏三味藥組成,黃連降火結熱,瓜蔞潤燥滌垢,半夏散結豁痰,合之以清熱化痰、寬胸散結[8-9]。 本研究采用高脂飼料喂養制作小鼠HLP 模型,初步探索小陷胸湯對HLP 小鼠血管內皮的保護作用,以期為HLP 的臨床防治提供一定理論基礎。
1 材料和方法
1.1 實驗動物
36 只 SPF 級 C57BL/6 小鼠,雄性,5 周齡,體重20~22 g,于SPF 級條件下飼養。 小鼠由三峽大學實驗動物中心[SCXK(鄂)2017-0012],動物實驗在武漢華聯科生物技術有限公司動物中心進行[SYXK(鄂)2018-0104],飼養溫度 22℃ ~26℃,相對濕度50%~60%,循環光照。 本研究動物實驗方案合理,符合實驗動物的“3R”原則,經武漢華聯科生物技術有限公司倫理審查委員會批準(HLK-20190106-01)。
1.2 主要儀器與試劑
小陷胸湯由黃連3 g,瓜蔞30 g,半夏12 g 三方組成,武漢市第三醫院中藥房提供。 使用傳統方法經浸泡、煎煮、過濾、濃縮等步驟制成煎劑,分別調制成每毫升含生藥 0.03 g、0.06 g、0.12 g 湯劑,低溫冷藏待用。
洛伐他丁(上海阿拉丁生化科技股份有限公司,中國,批號:Lot#c1925105);高脂飼料(北京華阜康生物科技股份有限公司,中國,批號:D12492);蘇木精、伊紅、中性樹脂、DAB 顯色試劑盒(北京索萊寶科技有限公司,中國,批號:G1140、E8090、G8590、DA1010-2);蛋白質 Marker(thermo,美國,批號:26634);RIPA(強)組織細胞快速裂解液、BCA 蛋白濃度測定試劑盒、兔抗血管內皮生長因子(vascular endothelial growth factor,VEGF)抗體、兔抗酪氨酸蛋白激酶Eph 受體B4(EPH receptor B4,EphB4)及其胞膜附著型配體 B2(Ephrin-B2,EphrinB2) 抗體(bioswamp,中國,批號:W1689、W1712、PAB43958、PAB33625、PAB41809);SYBR Green PCR 試劑盒(KAPA Biosystems,美國,批號:KM4101);逆轉錄試劑盒(TaKaRa,中國,批號:639505)。
正置顯微鏡、石蠟切片機(Leica,德國,型號:DM1000);生物組織包埋機(湖北泰維科技實業股份有限公司,中國,型號:TB-718D);自動組織脫水機(湖北康強醫療器械有限公司,型號:TKD-TSF);酶標儀(Ladsystems,美國,型號:MK3);電泳儀(BIO-RAD,美國,型號:mini protean 3 cell);PCR 儀(杭州柏恒科技有限公司,中國,型號:GE48527)。
1.3 實驗方法
1.3.1 HLP 小鼠模型的建立、分組和給藥
適應性喂養7 d 后,對照組6 只采用正常飼料喂養,剩余小鼠采用高脂飼料喂養8 周。 將高脂飼料喂養的小鼠隨機分為5 組:模型組(0.5 mL 生理鹽水)、低劑量組(0.03 g/mL 小陷胸湯)、中劑量組(0.06 g/mL 小陷胸湯)、高劑量組(0.12 g/mL 小陷胸湯)和陽性對照組(2.5 mg/kg 洛伐他丁),每組6只,給予相應藥物灌胃治療,每日1 次。 每天觀察大鼠的毛發狀態、攝食量、飲水量、活動量等變化,每周測一次體重。 8 周后,采用1%戊巴比妥鈉麻醉后取血,分離血清,處死小鼠,收集脾、肝(稱重)、主動脈血管組織,保存待測。
1.3.2 HE 染色觀察
將小鼠主動脈組織固定,脫水,包埋成蠟塊,切至3 μm,切片脫蠟,復水,水洗;蘇木精染色3~6 min,水洗;1%鹽酸乙醇1~3 s,水洗;促藍液返藍5~10 s,沖洗15~30 min;0.5%伊紅染色2~3 min,水洗;80%乙醇15~30 s,95%乙醇15~30 s;無水乙醇1~3 s;二甲苯透明,中性樹脂固封;顯微鏡下拍照觀察。
1.3.3 免疫組化染色觀察
主動脈血管組織制作切片,脫蠟至水,自來水沖洗10 min;0.01 mol/L 檸檬酸鈉高壓修復20 min,PBS 沖洗 3 min×3 次;3% H2O2濕盒孵育 10 min,PBS 沖洗3 min×3 次;10%山羊血清濕盒孵育30 min,PBS 沖洗3 min×3 次;滴加兔抗血管假性血友病因子(von Willebrand factor,vWF)抗體,4℃濕盒孵育過夜,PBS 沖洗 3 min×3 次;室溫下修復 40 min,PBS 沖洗 5 min×3 次;滴加 maxvision 二抗,濕盒孵育 1 h,PBS 沖洗 3 min×3 次;DAB 染色,自來水沖洗;蘇木素復染3 min,1%鹽酸乙醇分化,自來水沖洗,乙醇脫水后二甲苯透明3 min×2 次,封片;顯微鏡下拍照觀察,分別測量出血管組織中陽性區面積、陽性區積分光密度,計算陽性區域平均光密度值(average optical density,AOD)= 陽性區積分光密度/陽性區面積。
1.3.4 Western blot 檢測
提取主動脈組織蛋白并定量,取20 μg 蛋白置于80 V 下預電泳40 min,再在120 V 下電泳50 min;采用濕轉轉膜的方式在90 V 下轉膜50 min,5%脫脂奶粉封閉 2 h;滴加兔抗 EphB4 抗體(1 ∶1000)、 兔 抗 EphrinB2 抗體 (1 ∶1000)、 兔抗VEGF 抗體(1 ∶500)和膜 4℃孵育過夜;PBST 洗滌 5 min×3 次;加二抗室溫孵育1 h;PBST 洗滌5 min×3 次,滴加ECL 發光液顯影,讀取灰度值。
1.3.5 qRT-PCR 檢測
取主動脈組織樣本,按照試劑盒說明書步驟提取總RNA 并進行反轉錄擴增,以cDNA 為模板進行Real-time PCR,反應程序為95℃預變性3 min,95℃變性5 s,56℃退火10 s,72℃延伸25 s,39 個循環。見表1。
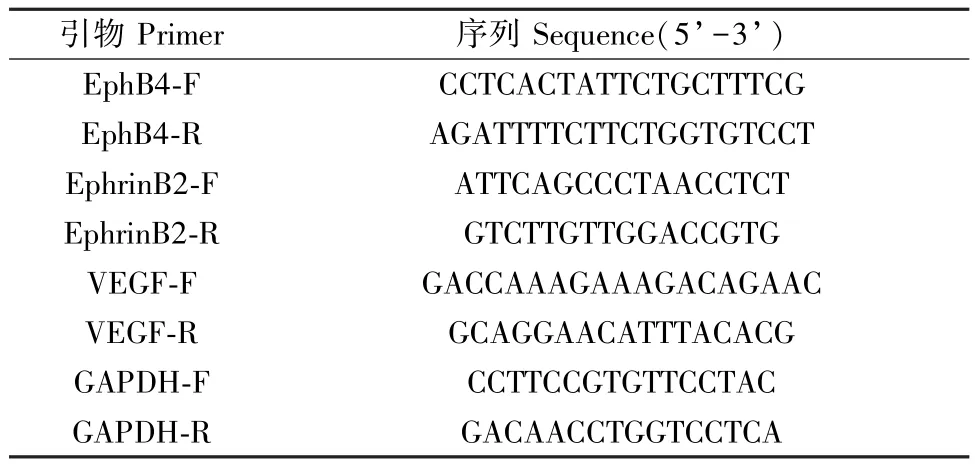
表1 PCR 引物序列Table 1 PCR primer sequences
1.4 統計學方法
采用SPSS 23.0 軟件進行數據的統計分析,計量數據以平均數±標準差()表示,單因素方差分析法分析多組間的差異,P<0.05 表示差異顯著,有統計學意義;采用Leica Application Suite 圖象系統采集主動脈血管組織圖片。
2 結果
2.1 小鼠一般狀態及體重變化
給藥期間,正常組小鼠攝食量、飲水量和活動量均正常,毛發光亮;模型組小鼠攝食量和活動量減少,毛發較差。 低、中、高劑量組和洛伐他丁組小鼠行為狀態有所好轉。
如表2 所示,與對照組比較,8 周末模型組小鼠體重顯著增加(P<0.05);與模型組比較,8 周末小陷胸湯各劑量組、洛伐他丁組均有顯著性降低(P<0.05)。
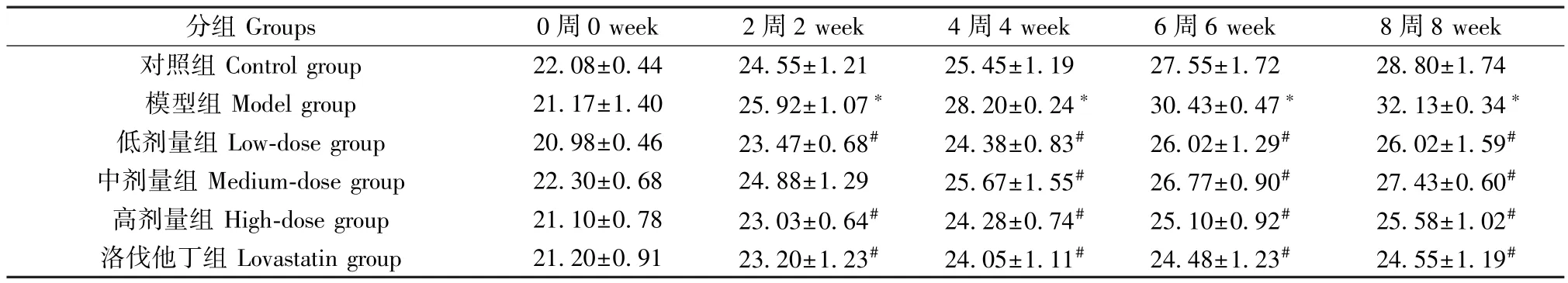
表2 小鼠體重的變化(g)Table 2 Changes of body weight in mice
2.2 小鼠主動脈血管組織病理形態學觀察
如圖1 所示,對照組小鼠主動脈組織外、中、內三層結構清晰完整,排列緊密有序;模型組主動脈內膜增厚,中層平滑肌細胞排列紊亂,彈力纖維出現明顯斷裂;低、中、高劑量組和洛伐他丁組內皮組織結構及狀態均有不同程度改善。
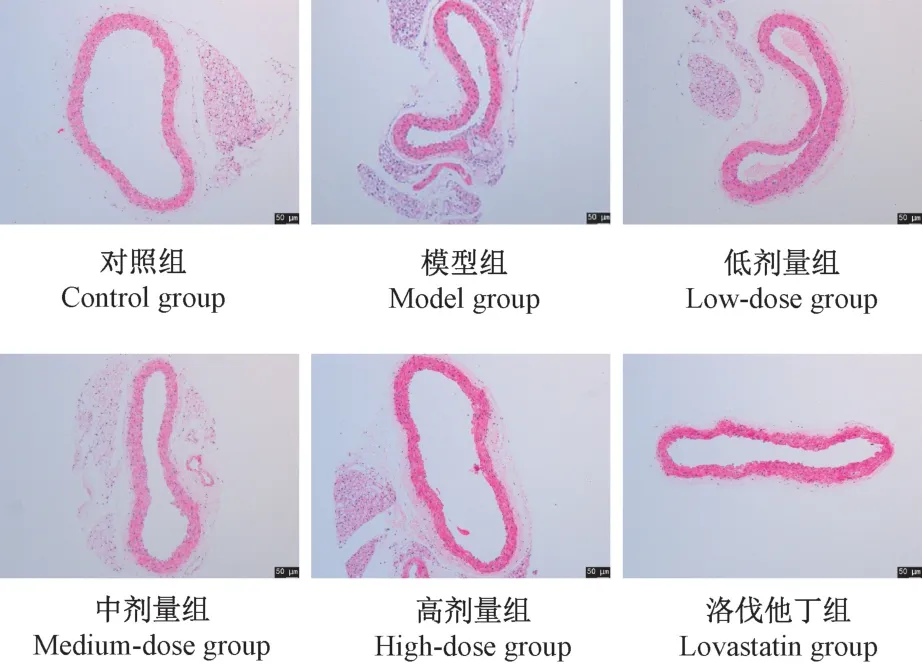
圖1 小鼠主動脈HE 染色Figure 1 HE staining of aorta in mice
2.3 小陷胸湯對HLP 小鼠主動脈組織vWF 含量的影響
如圖2 所示,與對照組比較,模型組小鼠主動脈vWF 表達顯著增加(P<0.05);與模型組比較,小陷胸湯中、高劑量組和洛伐他丁組vWF 表達顯著減少(P<0.05)。
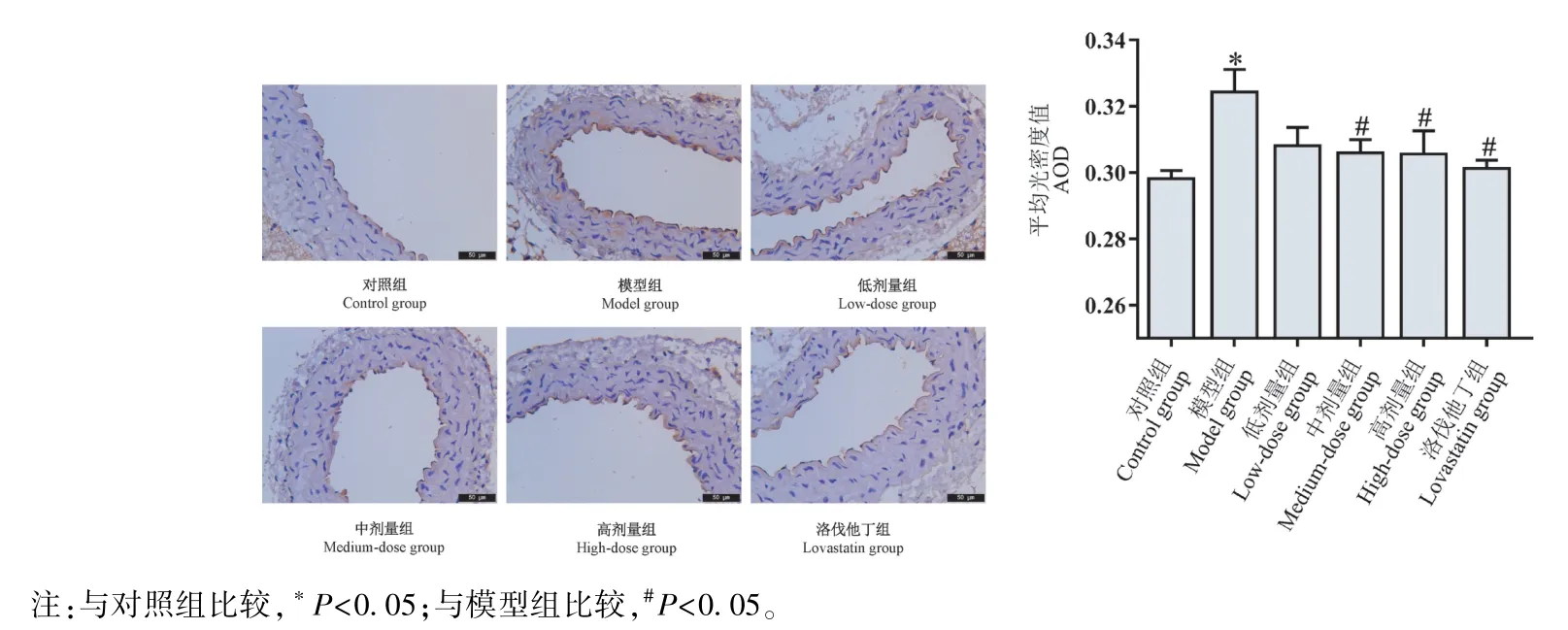
圖2 小鼠主動脈組織中vWF 的表達Note. Compared with the control group, *P<0.05. Compared with the model group, #P<0.05.Figure 2 Expression of vWF in aorta of mice
2.4 小陷胸湯對HLP 小鼠主動脈組織中EphB4、EphrinB2 和VEGF mRNA 和蛋白表達的影響
如圖3 和圖4 所示,與對照組比較,模型組小鼠EphB4、EphrinB2、VEGF 的 mRNA 和蛋白表達水平顯著升高(P<0.05);與模型組比較,低、中、高劑量組和洛伐他丁組小鼠 EphB4、 EphrinB2、 VEGF mRNA 和蛋白表達水平顯著降低(P<0.05);與低劑量組比較,中劑量和高劑量組小鼠主動脈組織中EphB4、EphrinB2、VEGF mRNA 和蛋白表達水平均顯著降低(P<0.05)。
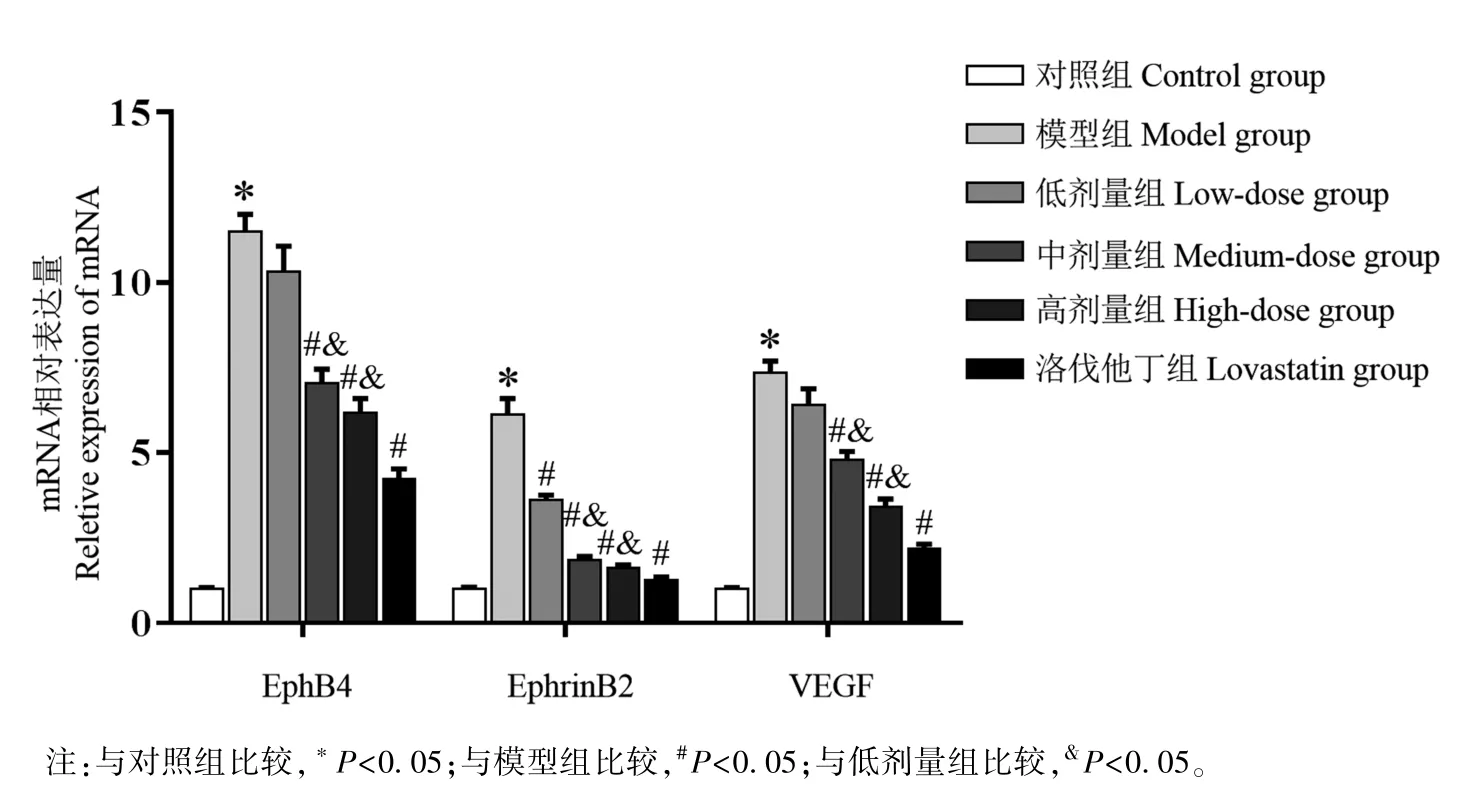
圖3 小鼠主動脈組織中EphB4、EphrinB2 和VEGF 的mRNA 水平Note. Compared with the control group, *P< 0.05. Compared with the model group, #P< 0.05.Compared with the low-dose group, &P<0.05.Figure 3 Levels of EphB4, EphrinB2 and VEGF mRNA in aorta of mice
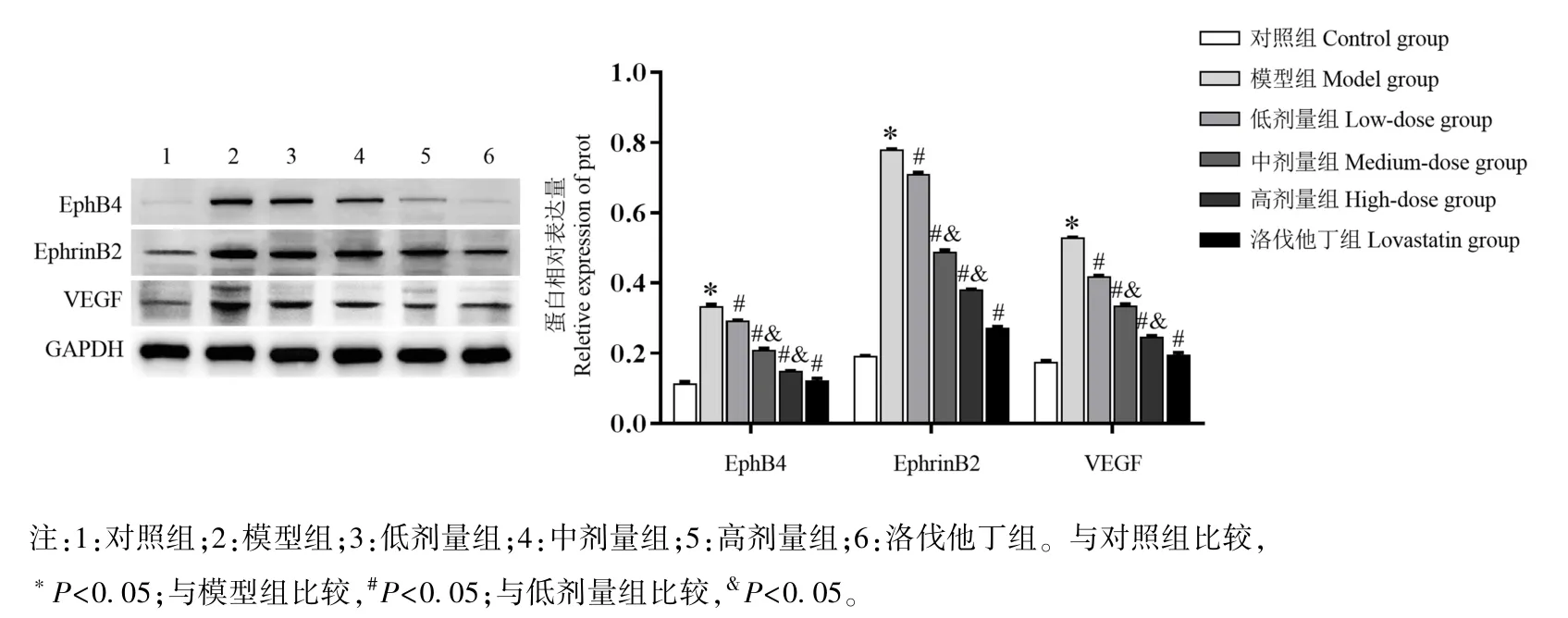
圖4 小鼠主動脈組織中EphB4、EphrinB2 和VEGF 蛋白的表達Note. 1, Control group. 2, Model group; 3, Low-dose group. 4, Medium-dose group. 5, High-dose group. 6, Lovastatin group. Compared with the control group, *P<0.05. Compared with the model group, #P<0.05. Compared with the lowdose group, &P<0.05.Figure 4 Expression of EphB4, EphrinB2 and VEGF protein in aorta of mice
3 討論
HLP 是導致動脈粥樣硬化的重要病理基礎,也是造成心腦血管病變的主要因素,嚴重危害著人類的身體健康。 血管內皮功能障礙與眾多心血管疾病關系密切[10]。 血管內皮細胞是血液和管壁組織之間的第一通透性屏障,在抗凝、抗血小板聚集和維持血液通道等方面發揮作用。 長期高血脂會促進內皮細胞產生自由基,氧化生物膜內的不飽和脂肪酸,導致內皮細胞損傷,引起內皮細胞功能障礙[11]。 因此,治療HLP 應重視對血管內皮細胞功能的改善。 小陷胸湯最早出自張仲景的《傷寒論》,取黃連、半夏、瓜蔞入藥,此方辛開苦降[12],具有清熱化痰、寬胸散結之功。 本研究以HLP 小鼠模型為研究對象,證明了各劑量的小陷胸湯可不同程度改善HLP 小鼠的飲食量和活動量,也顯著改善了小鼠主動脈內皮結構損傷、平滑肌細胞排列紊亂程度,提示小陷胸湯對HLP 小鼠血管內皮具有保護作用。
vWF 是一種由內皮細胞和單核細胞產生的多聚糖蛋白,正常生理狀態下儲存在胞質內的Weibelpalade 小體中,內皮細胞受到損傷時會釋放過度的vWF,激活血小板,引發血栓的形成[13],因此vWF被認為是內皮受損的特異性標志物[14]。 在本研究中,HLP 小鼠vWF 表達明顯增加,提示高血脂癥造成內皮細胞損傷,而經小陷胸湯治療可以下調vWF的表達,提示小陷胸湯能緩解內皮細胞的損傷。
EphB4/EphrinB2 雙向信號通路在血管新生中的意義重大,EphB4 在靜脈內皮細胞上特異性地表達,而 EphrinB2 特異性地表達在動脈內皮細胞上[15]。 蔡金等[16]通過清腦益髓調督法電針治療急性腦梗死發現,該法通過上調EphrinB2 表達,促進血管新生進而對腦梗死起到治療的作用。 Noren等[17]研究表明,在MOPC315 腫瘤模型中,新生血管內皮細胞表達的磷酸化EphrinB2 表達量較高,其與腫瘤細胞表達的EphB4 相互作用并促進血管的新生。 VEGF 是血管新生的主要調控因子,能夠促進血管內皮細胞的有絲分裂。 張振強等[18]研究表明HLP 病理條件會刺激大鼠腦組織VEGF 的表達以促進新生血管的形成。 研究表明,高血脂癥誘發機體內源性保護的機制之一是促進血管的生成[19],因此可通過促進血管生成因子的變化判斷高血脂癥導致的血管內皮損傷的程度。 在本研究結果中,HLP 小鼠 EphB4、EphrinB2 和 VEGF mRNA 水平增加,提示高血脂癥誘發了機體內源性保護,促進血管的生成,小陷胸湯治療后的HLP 小鼠中EphB4、EphrinB2 和VEGF mRNA 及蛋白表達水平下降,且中、高劑量組 EphB4、EphrinB2 和 VEGF mRNA 及蛋白表達水平顯著低于低劑量組,存在一定的劑量依賴性,提示新生血管減少,進一步提示小陷胸湯能改善高血脂癥引起的病理反應,抑制高血脂癥的發展。
綜上所述,通過高血脂癥導致的小鼠行為變化、主動脈血管組織病變程度及各因子表達水平可判斷小陷胸湯具有緩解高血脂癥誘導病理反應,改善血管內皮損傷的功效,后續可進一步分析其具體的機制。

