酵母PMT1和TED1基因在細胞壁應激反應中的作用
鄧雁文, 崔曉靜, 劉佳鑫, 黃鎮武, 孫恩浩, 方澤森, 王少丹, 周 遠, 呂曉彤, 阮 杰,, 王俊芳, 崔紅晶,*
(1.廣東醫科大學 第二臨床醫學院,廣東 東莞 523808; 2.廣東醫科大學 廣東省醫學分子診斷重點實驗室 衰老研究所,廣東 東莞 523808;3.廣東醫科大學 基礎醫學院, 廣東 東莞 523808;4.廣東醫科大學 醫學技術學院, 廣東 東莞 523808)
釀酒酵母細胞處于生長、形態發生或外環境挑戰細胞壁完整性的時候,細胞壁以高度調控和極化的方式被重塑,這一過程主要被細胞壁完整性信號通路(Cell wall integrity,CWI)所調控[1]。細胞表面感應因子(如Wsc1-3p、Mid2p 和Mtl1p等)感受到應激信號后,通過傳導給小G蛋白(Rho1p)進一步激活絲裂原活化蛋白激酶(The mitogen-activated protein kinase,MAPK)/Slt2p信號級聯反應,誘導CWI靶基因轉錄,改善細胞壁完整性[1]。在調控細胞壁重構的過程中,兩個轉錄后調控因子Mpt5p和Ssd1p,以不依賴MAPK/Slt2p方式參與調控細胞壁的生物合成,或者通過間接機制調控細胞壁重構[2-3],以適應細胞在生理或環境改變時的生長發育過程。釀酒酵母蛋白質O-甘露糖轉移酶(ProteinO-mannosyltransferase,PMT)家族糖基化修飾膜蛋白質和分泌蛋白質,參與調控細胞的多種生物學功能[4]。PMT家族成員中Pmt1p(PMT1基因編碼)與Pmt2p(PMT2基因編碼)以異聚體的形式存于酵母細胞內,在維持內質網蛋白質的動態平衡方面,以及細胞生長和發育等方面起到重要作用[4]。廣東省醫學分子診斷重點實驗室衰老研究所前期研究結果表明,與Pmt1p-Pmt2p異聚體相結合的內質網伴侶分子Ted1p(Traffcking of Emp24p/Erv25p-dependent cargo disrupted)也參與調控細胞壽命和內質網應激反應,且進一步缺失Pmt1p校正Ted1p的細胞壽命和內質網應激反應方面的表型特征[5-6]。但有關Pmt1p和Ted1p在細胞壁應激反應中的作用研究較少見報道。因此,本研究主要通過檢測酵母細胞分裂增殖活性,及細胞壁應激反應信號通路中相關效應蛋白的轉錄水平,研究缺失PMT1和(或)TED1基因在細胞壁應激反應中的抗性和細胞壁應激反應通路的活性,探討細胞壁應激反應能力與細胞壁應激反應信號通路活性之間的可能調控關系。
1 材料與方法
1.1 材料
1.1.1 菌株和質粒 單倍體釀酒酵母菌株BY4742(MATαhis3Δ1leu2Δ0lys2Δ0ura3Δ0)由美國華盛頓大學Matt Kaeberlein博士贈送,單基因缺失酵母菌株(pmt1Δ和ted1Δ)和雙基因缺失酵母菌株(pmt1Δted1Δ)為廣東醫科大學衰老研究所構建[6]。
1.1.2 試劑與儀器 酵母提取物和胰蛋白胨購自廣州威佳科技有限公司;剛果紅和熒光增白劑購自美國Sigma公司,按照說明書分別配制成100 μg/mL和10 μg/mL的工作液;酵母RNA提取試劑盒、反轉錄試劑盒和定量試劑盒均購自TaKaRa公司。實時熒光定量PCR儀(LightCycler96,美國應用生物系統ABI公司);全自動生長曲線分析儀(Bioscreen C,芬蘭Bioscreen公司);多功能酶標儀(Synergy z BioTek,美國伯騰儀器Bio-Tek有限公司)。
1.1.3 引物 引物由上海英駿生物技術有限公司合成(表1)。
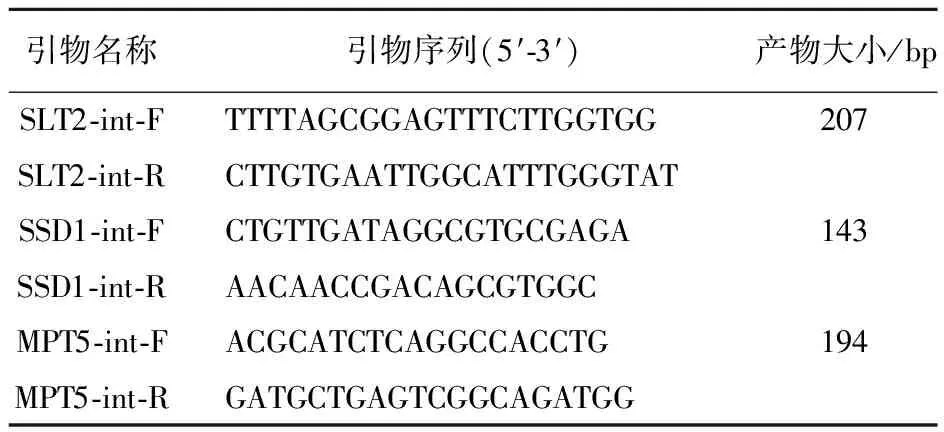
表1 實時熒光定量PCR引物
1.2 方法
1.2.1 點板實驗 取等量的酵母菌株新鮮培養物(A600值約為0.25),無菌水倍比稀釋(1∶10),取3.5 μL稀釋培養物滴入實驗組YPD培養平板(含10 μg/mL熒光增白劑或100 μg/mL剛果紅)[7]。倒置30 ℃培養,從第2天起每隔12 h觀察菌落形態并拍照。3次獨立重復實驗。
1.2.2 生長曲線 實驗方法參照文獻[8-9]進行。制備300 μL YPD酵母菌株新鮮培養物(含10 μg/mL熒光增白劑或100 μg/mL剛果紅),A600值約為0.04,30 ℃、180 r/min振蕩培養24 h;每間隔2 h全自動生長曲線分析儀測定培養物A600值。根據吸光度值,計算酵母菌株的細胞分裂增殖活性并繪制生長曲線圖。3次獨立重復實驗。1.2.3 定量RT-PCR 將酵母菌株培養至對數生長期,收集1 mL新鮮培養物(A600值約為2.5),提取細胞總RNA、制備cDNA以及實時定量PCR,方法均參照試劑盒說明書進行。定量PCR實驗數據以酵母PRP8基因為參比,根據2-ΔΔCT法計算細胞壁應激反應通路中效應蛋白的轉錄水平。
1.2.4 統計分析 采用SPSS 19.0統計軟件。兩組間的比較采用t檢驗;以P<0.05為差異有統計學意義,P<0.01為差異有顯著統計學意義。
2 結果與分析
2.1 酵母菌株在細胞壁應激反應條件下的克隆形成能力
為進一步研究酵母菌株對細胞壁應激反應誘導劑(熒光增白劑或剛果紅)的抵抗性,本研究觀察pmt1Δ菌株、ted1Δ菌株和pmt1Δted1Δ菌株在細胞壁應激反應條件下的細胞克隆形成能力。結果顯示:在YPD平板上,與野生型酵母細胞(BY4742)比較,pmt1Δ菌株和pmt1Δted1Δ菌株生長狀態無明顯變化,ted1Δ菌株生長較慢;在含熒光增白劑或剛果紅培養條件下,pmt1Δ菌株菌落形成較小,生長較慢,菌株對藥物較敏感;ted1Δ菌株細胞生長較快,有明顯抗性;但pmt1Δted1Δ菌株的生長受到明顯的抑制,表現出敏感性(圖1)。因此,缺失TED1基因增強酵母細胞對細胞壁應激反應的抵抗性,進一步缺失PMT1基因增強ted1Δ菌株對細胞壁應激反應的敏感性。
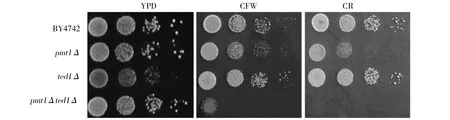
圖1 酵母菌株在細胞壁應激反應條件下的克隆形成能力
2.2 酵母菌株在細胞壁應激反應條件下的增殖活性
通過檢測細胞增殖情況,進一步研究pmt1Δted1Δ菌株對細胞壁應激反應誘導劑的抵抗性。結果顯示:在YPD液體培養條件下,與菌株BY4742平均約9 h達到對數生長期比較,pmt1Δ菌株和pmt1Δted1Δ菌株的生長狀態無明顯差異,而ted1Δ菌株的生長曲線低平,細胞生長活力較差,約10.5 h達到對數生長期;在含10 μg/mL熒光增白劑培養條件下,與BY4742酵母細胞平均約17 h達到對數生長期比較,pmt1Δ菌株的生長緩慢(平均約19 h達到對數生長期);ted1Δ菌株的生長狀態較好(約14 h達到對數生長期),pmt1Δted1Δ菌株生長曲線低平,細胞活力最差,約26 h達到對數生長期;在含100 μg/mL剛果紅培養條件下,各菌株的細胞增殖能力情況與熒光增白劑培養條件下的結果相似(圖2)。因此,細胞壁應激反應誘導劑影響菌株BY4742、pmt1Δ菌株、ted1Δ菌株和pmt1Δted1Δ菌株的細胞分裂增殖能力,與對照組比較,ted1Δ菌株的生長狀態較好,但pmt1Δted1Δ菌株的生長受明顯抑制。
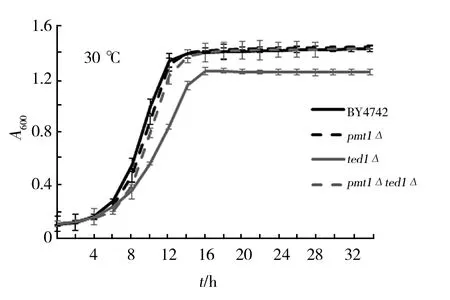
圖2 酵母細胞生長曲線
2.3 細胞壁應激反應通路中效應蛋白在酵母菌株中的轉錄表達水平
為研究pmt1Δ菌株、ted1Δ菌株和pmt1Δted1Δ菌株參與細胞壁應激反應通路的可能機制,本文采用定量qRT-PCR檢測參與細胞壁結構和完整性調控通路Slt2p、Ssd1p和Mpt5p等效應蛋白基因轉錄水平。結果顯示:與BY4742比較,pmt1Δ菌株和pmt1Δted1Δ菌株中SLT2、MPT5和SSD1基因表達明顯升高,ted1Δ菌株中的基因表達水平無明顯變化;與pmt1Δ菌株比較,pmt1Δted1Δ菌株中SLT2和MPT5基因表達明顯下調,SSD1基因表達無明顯變化(見圖3)。
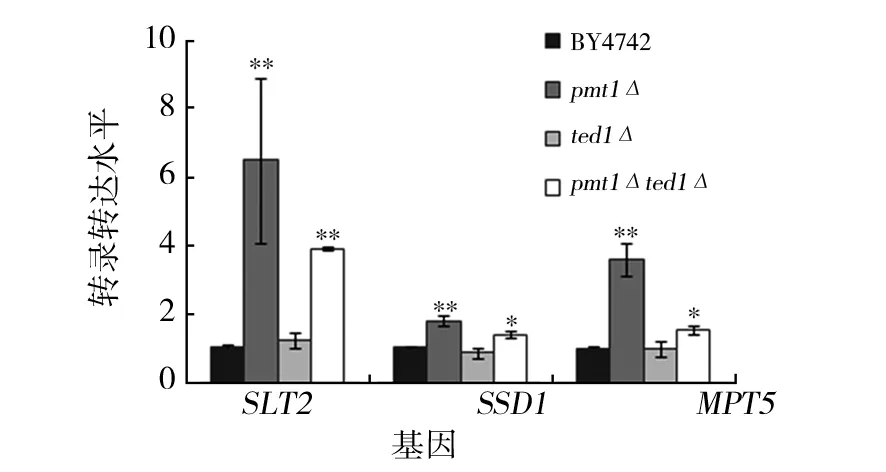
圖3 酵母菌株SLT2、SSD1和MPT5基因轉錄表達水平
因此,缺失PMT1上調野生型酵母細胞和ted1Δ菌株中細胞壁應激反應通路Slt2p、Ssd1p和Mpt5p等效應蛋白的轉錄水平。
3 討 論
酵母細胞壁對維持細胞形狀和完整性,以及促進細胞周期發生等生物學過程至關重要。當細胞內外物理化學環境發生改變時,誘導經典細胞壁完整性(CWI)信號通路中蛋白激酶C-絲裂原活化蛋白激酶(PKC-MAPK)的激活,效應蛋白Slt2p是這一信號通路中的重要成份,參與下游靶基因的轉錄調控[2],進一步增加轉錄因子Rlm1p的表達水平,調控β-葡聚糖和細胞壁相關成分轉錄,重構細胞壁,賦予細胞壁應激反應抵抗能力[1,10]。與經典CWI通路相平行的Mpt5p和Ssd1p兩條信號通路也參與調控細胞壁生物合成相關基因的轉錄或轉錄后加工,三條信號通路協同調控細胞壁結構和細胞的完整性[2-3]。
通過研究缺失PMT1和(或)TED1基因在酵母細胞壁應激反應中的作用,進而探討酵母細胞壁應激反應能力與細胞壁應激反應信號通路之間的調控關系。結果顯示,已知長壽命pmt1Δ菌株對細胞壁應激反應誘導劑敏感,生長較慢,形成較小克隆,這提示蛋白質O-甘露糖基化修飾功能在細胞壁硬度和細胞完整性方面有著重要作用[11]。本研究進一步發現缺失PMT1基因誘導細胞壁應激反應通路中效應蛋白SLT2、MPT5和SSD1基因表達上調,這與以往研究結果PMT抑制劑能誘導CWI信號通路的活性相一致[11]。但是上調的保護性CWI信號通路沒有賦予pmt1Δ菌株對細胞壁應激反應的抵抗性,推測可能原因與蛋白質甘露糖基化修飾功能缺陷影響PKC-MAPK信號通路的功能,進而影響細胞壁的完整性相關;另外,藥物刺激之后,細胞壁應激反應水平過高,超出pmt1Δ細胞可以承受的范圍,細胞壁重塑功能紊亂,對細胞造成生理毒性。pmt1Δ菌株在正常生理條件下的良好生長狀態也說明過高的細胞壁應激反應水平導致細胞損傷這一推測的可能性。
同時,本研究還發現細胞壁應激反應誘導劑對ted1Δ菌株和對照組酵母細胞的生長均有抑制作用,對后者的生長抑制更加顯著,說明缺失TED1基因增強酵母細胞對細胞壁應激反應的抵抗性,提示Ted1p參與細胞壁硬度和(或)細胞完整性的調控。進一步定量PCR結果顯示,ted1Δ菌株中細胞壁應激反應信號通路中效應蛋白Slt2p、Ssd1p和Mpt5p轉錄表達水平無明顯變化,推測細胞壁應激反應信號通路的活性可能更適合ted1Δ菌株在細胞壁應激反應條件下的生長;或者突變的鉀離子通道改變ted1Δ菌株細胞壁的通透性,影響藥物滲入,從而避免細胞損傷。已有研究報道Ted1p在調控酵母細胞壁穩定性、細胞生長和分裂等生理過程中具有重要的作用[4,13-14],推測其他信號通路可能也會間接地參與ted1Δ菌株在細胞應激條件下的細胞壁重構功能。但是,缺失TED1基因增強酵母細胞對細胞壁應激反應抵抗性的具體機制還需要進一步研究。
值得注意的是,細胞壁應激反應誘導劑顯著抑制pmt1Δted1Δ菌株的生長,提示缺失PMT1基因增強ted1Δ菌株對細胞壁應激反應的敏感性;且pmt1Δted1Δ菌株誘導細胞壁應激反應信號通路中效應蛋白Slt2p、Ssd1p和Mpt5p轉錄表達水平上調,結果提示pmt1Δted1Δ菌株參與細胞壁應激反應信號通路的調控,但誘導的PKC-MAPK、Mpt5p和Ssd1p三條保護性信號通路沒有賦予pmt1Δted1Δ菌株對細胞壁應激反應的抵抗性。推測缺失PMT1基因消弱ted1Δ菌株的細胞壁穩定性或細胞壁通透性,進而影響酵母細胞的生長、分裂和其他生物學反應[4,12-14]。可能原因與缺失Pmt1p和Ted1p影響蛋白質O-甘露糖基化修飾功能,進而干擾酵母細胞壁重構,影響細胞的分裂增殖能力相關,或者Slt2p、Ssd1p和Mpt5p等效應蛋白轉錄水平上調表達不足以修復酵母細胞受到的細胞壁應激損傷。總之,pmt1Δted1Δ菌株對細胞壁應激反應誘導劑敏感的具體機制有待進一步研究。
本研究發現已知長壽命pmt1Δ菌株和pmt1Δted1Δ菌株中細胞壁應激反應信號通路Slt2p、Ssd1p和Mpt5p等效應蛋白轉錄水平表達上調,已知短壽命ted1Δ菌株中效應蛋白的轉錄水平無明顯變化。研究結果提示,上調的保護性信號通路沒有賦予菌株對細胞壁應激反應的抵抗性,說明細胞分裂增殖能力與應激反應通路之間的關系較為復雜,這取決于細胞應激反應類型、脅迫程度和調節細胞分裂增殖能力通路等多因素的協同作用。因此,突變菌株對細胞壁應激反應抵抗性的具體作用機制有待進一步研究。
致謝:感謝美國華盛頓大學Matt Keaberlein博士和美國BUCK衰老研究所Brian K Kennedy博士贈送的菌株BY4742,及在酵母實驗技術方面給予的精心指導。

