沉默circPVT1對5-氟尿嘧啶耐藥胃癌細胞化療增敏作用及機制研究
左興盛,宋志玉,賈海盼,付中華,王振基,馬培志
(1.河南省人民醫院藥學部,鄭州大學人民醫院藥學部,鄭州450003;2.鄭州大學藥學院,鄭州450000)
胃癌作為最常見的惡性腫瘤之一,是全球癌癥死亡的第二大主要原因[1]。盡管目前在胃癌化療和靶向治療方面卓有成效,但胃癌的預后仍不容樂觀,原發或繼發性耐藥是胃癌化療失敗的主要原因[2]。5-氟尿嘧啶(5-fluorouracil,5-FU)作為臨床常用的化療藥物,因其對多種癌癥的抗腫瘤作用而聞名,包括胃癌。然而,臨床上胃癌患者對5-FU也產生了不同程度的耐藥,導致臨床療效不佳[3]。5-FU耐藥性產生的機制目前尚未明確。環狀RNA(circular RNA,circRNA)是一類缺少5′和3′末端,由共價鍵形成閉合環狀的非編碼RNA。circRNAs在真核生物內的含量豐富,已被證明能夠參與調控腫瘤的發生、轉移及耐藥性[4-5]。環狀RNA PVT1(circPVT1)來源于致癌基因PVT1基因的外顯子2,位于染色體8q24。研究表明,circPVT1與多種癌癥的發生、發展密切相關[6-7]。Chen等[8]發現,circPVT1在胃癌患者腫瘤組織中的表達上調,可作為胃癌的一種新型增殖因子和預后標志物。近來研究顯示,circPVT1參與腫瘤細胞對化療藥物的敏感性[9]。然而,circPVT1是否參與調節胃癌細胞對5-FU的化學敏感性尚不清楚。因此,本研究通過構建5-FU耐藥的胃癌細胞,探討circPVT1對胃癌5-FU耐藥細胞株的增殖和凋亡的影響及其可能的分子機制,為尋找耐藥逆轉劑的研究提供一定參考意義。
1 材料與方法
1.1 一般資料 收集2017—2018年在河南省人民醫院進行外科手術切除且經病理確認為胃癌患者29例,年齡28~64歲(中位年齡為51歲;平均年齡為48.6歲)。所有患者術前接受以5-FU為基礎的化學治療,根據患者對化療藥物5-FU的敏感性,將其分為5-FU敏感組(n=22)和5-FU耐藥組(n=7)。患者在接受術前化療前未接受過任何放療或免疫治療且均在接受治療前簽署知情同意書。胃癌組織切除后立即使用液氮處理,后置于-80℃冰箱中保存。本研究已取得醫院倫理委員會批準。
1.2 主要材料 胃癌細胞BGC823購自上海中科院細胞庫,si-NC、si-circPVT1-1和si-circPVT1-2購自上海吉瑪制藥技術有限公司,Bcl-2、Bax、caspase-3抗體購自美國Novus公司,TUNEL細胞凋亡檢測試劑盒-POD(20T)購自武漢博士德生物工程有限公司,CCK-8試劑盒購自日本Dojindo公司,Annexin V-FITC細胞凋亡檢測試劑盒購自上海碧云天生物技術有限公司。
1.3 BGC823細胞的培養與BGC823/5的構建BGC823細胞置于含10%胎牛血清的RPMI-1640培養基中在37°C、5%CO2培養箱中培養。采用濃度梯度法建立5-FU耐藥胃癌細胞株BGC823/5-FU。取對數生長期的BGC823細胞置于含有0.1μmol/L 5-FU的RPMI-1640培養基中培養3 d,隨后轉移至不含5-FU的培養基中培養至70%融合。取對數生長期的細胞分瓶傳代,并給予2倍濃度的5-FU繼續培養。以這種方式逐漸增加5-FU的劑量,直至BGC823細胞可以在含有1.0μmol/L 5-FU的RPMI-1640培養基中穩定生長。經過長達12個月的培養,獲得可以在含有1.0μmol/L 5-FU的RPMI-1640培養基中良好生長的BGC823/5-FU細胞。
1.4 細胞轉染 按照Lipofectmine2000使用說明書,分別將si-NC、si-circPVT1-1和si-circPVT1-2轉染至BGC823/5-FU細胞中,將BGC823/5-FU細胞置于含有16μmol/L 5-FU的培養基中培養24、48、72 h。將細胞分為4組,分別為Control組、5-FU組、5-FU+si-NC組、5-FU+si-circPVT1組。收集細胞用于后續實驗。
1.5 RT-PCR檢測目的基因的表達 使用TRIzon提取試劑提取總RNA,使用One Step TB GreenTMPrimeScriptTMRT-PCR Kit(Perfect Real Tim)試劑盒進行RT-PCR檢測。以GAPDH為內參,采用2-ΔΔCt法計算mRNA的表達量,引物序列:circPVT1上游5′-GGTTCCACCAGCGTTATTC-3′,下游5′-CAACTTCCTTTGGGTCTCC-3′;Bcl-2上游5′-CTACAGTGATGTCTCCATCC-3′,下游5′-AAAGCCTCAATGCCTGTCTC-3′;Bax上游5′-TGAACCCTAAGGCCAACCGTG-3′,下游5′-GCTCATAGCTCTTCTCCAGGG-3′;caspase-3上游5′-GAACTGGACTGTGGCATTGA-3′,下游5′-TGTCGGCATACTGTTTCAGC-3′;GAPDH上游5′-AATGGGCAGCCGTTAGGAAA-3′,下游5′-TGAAGGGGTCATTGATGGCA-3′。反應體系10μL,反應條件:95℃變性5 s,60℃退火30 s,擴增40個循環。
1.6 CCK-8檢測細胞增殖 稀釋BGC823/5-FU細胞設置6個細胞濃度梯度(0.625×103/孔、1.25×103/孔、2.5×103/孔、5.0×103/孔、1.0×104/孔、2.0×104/孔),每組4個復孔;接種于96孔板中,并加入CCK-8試劑10μL,繼續培養3 h后,在450 nm處測OD值并制作標準曲線。根據標準曲線確定BGC823/5-FU細胞的接種數量以及加入CCK-8試劑后所需的孵育時間。將BGC823/5-FU細胞置于含有不同濃度(0、1、2、4、8、16和32μmol/L)5-FU的培養基中培養48 h,按照CCK-8試劑盒操作說明檢測各組的細胞活性。
1.7 克隆形成實驗測定細胞增殖能力 取對數生長期的細胞0.25%胰蛋白酶消化,制作混懸液后梯度倍數稀釋,并分別接種于含有10 mL培養液的培養皿中,37℃下培養。多聚甲醛固定后結晶紫染色,計算克隆形成率=(克隆數/接種細胞數)×100%。
1.8 TUNEL檢測細胞凋亡 收集BGC823/5-FU細胞,PBS溶液漂洗1次,使用多聚賴氨酸處理玻片,多聚甲醛固定細胞后,向玻片上加入準備好的標記緩沖液,37℃條件下標記2 h,封閉液及地高辛抗體稀釋以后DAB染色,顯色20 min后,蘇木素復染后脫水,透明,封片,在熒光顯微鏡下觀察染色的細胞,拍照并計數。
1.9 Western印跡檢測目的蛋白的表達 使用哺乳動物蛋白抽提試劑盒(CW0889M)提取BGC823/5-FU細胞的總蛋白質,使用BCA蛋白定量試劑盒(CW0014)檢測從BGC823/5-FU細胞中提取的總蛋白質的濃度。SDS-PAGE分離總蛋白后,將蛋白轉移至硝酸纖維素膜上。將膜用5%脫脂牛奶封閉2.5 h后,加入相應的一抗于4℃下孵育過夜。次日,經TVST洗滌后,將膜與二抗于37℃下孵育60 min。采用增強化學發光試劑ECL顯影液于暗室中進行顯影。以β-actin作為內參分析目標蛋白的表達水平。
1.10 Annexin V-FITC細胞凋亡檢測試劑盒檢測細胞凋亡 收集BGC823/5-FU細胞,用0.25%胰蛋白酶消化,制成細胞懸浮液,離心后加入195μL Annexin V-FITC結合液重懸細胞,加入5μLAnnexin V-FITC,再加入10μL碘化丙啶染色液,室溫條件下避光孵育20 min,使用流式細胞儀分析凋亡細胞。
1.11 裸鼠移植瘤模型 雌性BALB/c裸鼠12只(5周齡,18~20 g)購自北京維通利華實驗動物技術有限公司。實驗動物在鄭州大學實驗動物中心飼養,實驗動物的處置符合倫理學標準。將裸鼠適應性喂養1周后,隨機分為3組,每組4只:5-FU組、5-FU+si-NC組、5-FU+si-circPVT1組。根據對應的分組,分別將轉染si-NC或si-circPVT1的BGC823/5-FU細胞于裸鼠右側背部皮下移植。每只小鼠通過尾靜脈注射5-FU(10 mg/kg)進行治療,每周注射1次,共進行4次注射[10]。觀察注射5-FU后測量裸鼠瘤體的長(a)和短(b)直徑,并根據公式:V(mm3)=ab2/2計算移植瘤體積。給藥4周后處死裸鼠,剝離移植瘤組織并稱重。
1.12 統計學處理 利用SPSS20.0統計分析軟件進行統計分析。符合正態分布的計量資料數據以±s表示。采用單因素方差分析比較分析組間差異,P<0.05為差異具有統計學意義。
2 結果
2.1 circPVT1在胃癌組織和細胞系中的表達 RTPCR結果顯示,circPVT1在5-FU耐藥患者胃癌組織中的表達水平明顯高于5-FU敏感患者,差異具有統計學意義(P<0.01,圖1A)。此外,circPVT1表達水平在BGC823/5-FU細胞中顯著高于BGC823細胞(P<0.001,圖1B)。
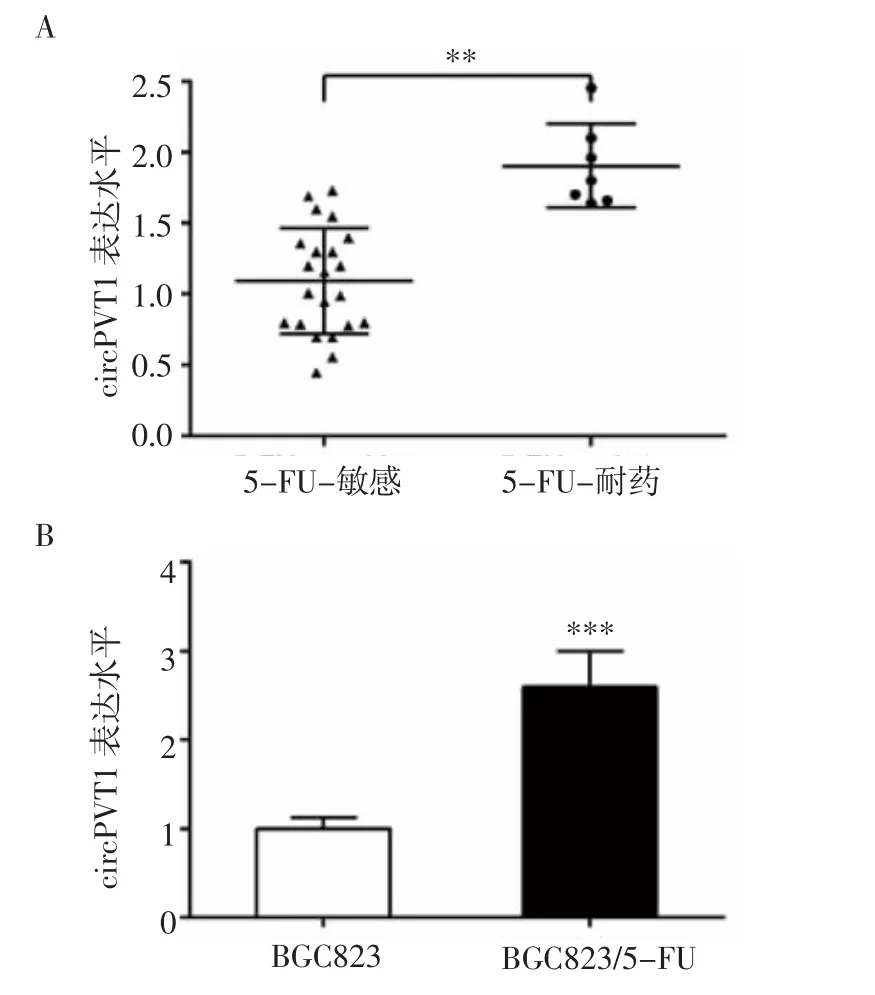
圖1 circPVT1在胃癌組織和癌細胞中的表達水平Fig 1 Expression of circPVT1in gastric cancer tissuesand cancer cells
2.2 沉默circPVT1促進5-FU對BGC823/5-FU細胞的增殖抑制作用 si-circPVT1-1和si-circPVT1-2轉染BGC823/5-FU細胞48 h后,RT-PCR檢測發現,BGC823/5-FU細胞中circPVT1的表達水平顯著降低(P<0.001),且si-circPVT1-1組中circPVT1的表達水平低于si-circPVT1-2組(P<0.001),因此,在后續實驗中使用si-circPVT1-1沉默circPVT1的表達(圖2A)。使用CCK-8試劑盒檢測細胞活性,標準曲線如圖2B所示。將BGC823/5-FU細胞置于含有不同濃度(0、1、2、4、8、16和32μmol/L)5-FU的培養基中培養48 h,利用CCK-8試劑盒分析各組的細胞活性。結果顯示,BGC823/5-FU細胞活性隨5-FU濃度的升高而降低(P<0.001,圖2C)。而沉默circPVT1后,CCK-8實驗結果發現,5-FU+si-circPVT1組BGC823/5-FU細胞的活性明顯低于5-FU+si-NC組(P<0.05,圖2D)。克隆形成實驗結果發現,5-FU處理可以抑制細胞的克隆形成能力。與5-FU+si-NC組相比,5-FU+si-circPVT1組BGC823/5-FU細胞的克隆形成能力明顯降低(P<0.05,圖2E)。
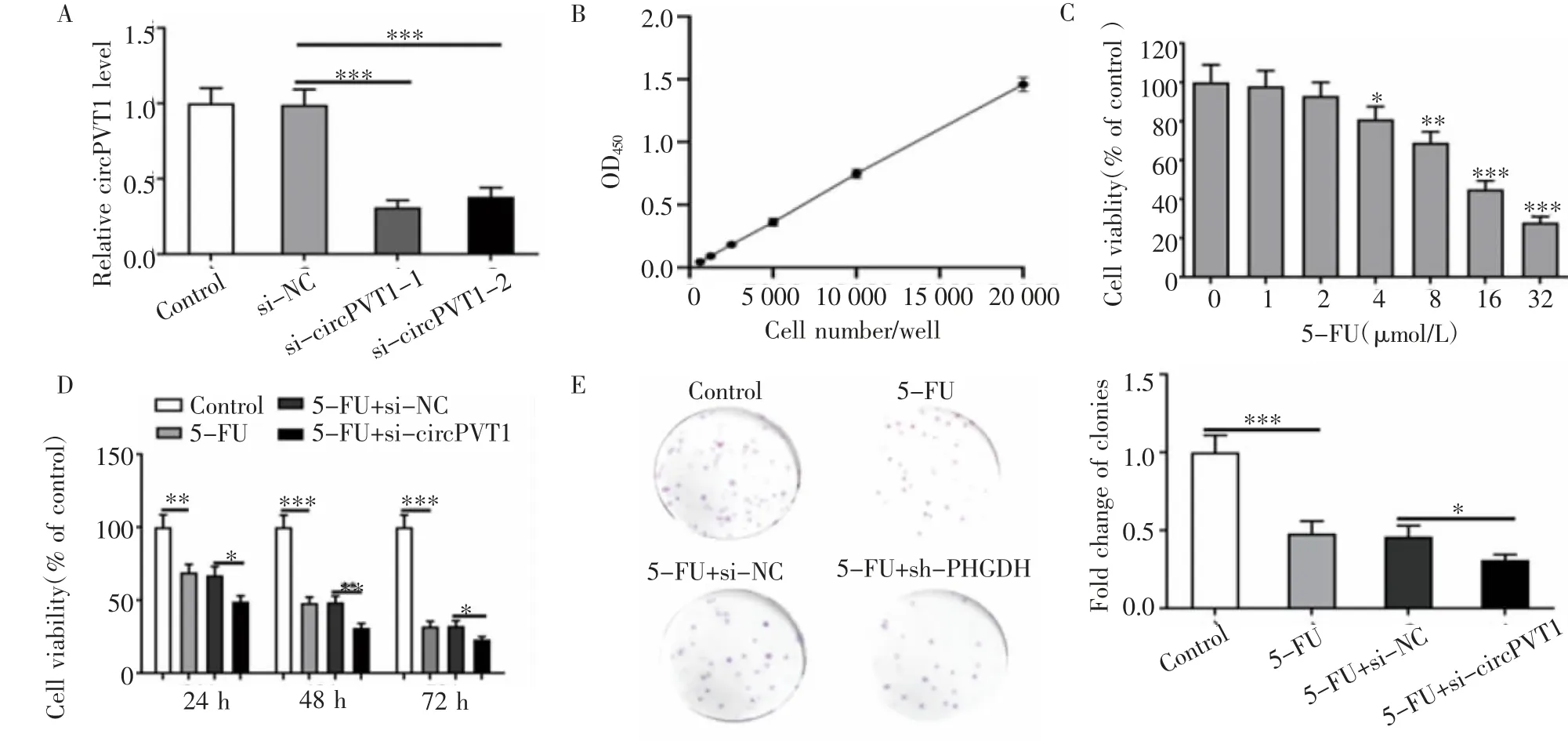
圖2 沉默circPVT1促進5-FU對BGC823/5-FU細胞的增殖抑制作用Fig 2 Silencing circPVT1 promotestheinhibition roleof 5-FUon theproliferation of BGC823/5-FUcells
2.3 沉默circPVT1增強5-FU對BGC823/5-FU細胞的凋亡促進作用 TUNEL實驗結果表明,與對照組相比,5-FU組BGC823/5-FU細胞的凋亡數目明顯上升(P<0.001)。5-FU+si-circPVT1組BGC823/5-FU細胞的凋亡數目明顯高于5-FU+si-NC組(P<0.01,圖3A)。5-FU組BGC823/5-FU細胞的凋亡率明顯高于對照組(P<0.001)。與5-FU+si-NC組相比,5-FU+si-circPVT1組BGC823/5-FU細胞的凋亡率明顯升高(P<0.01,圖3B)。
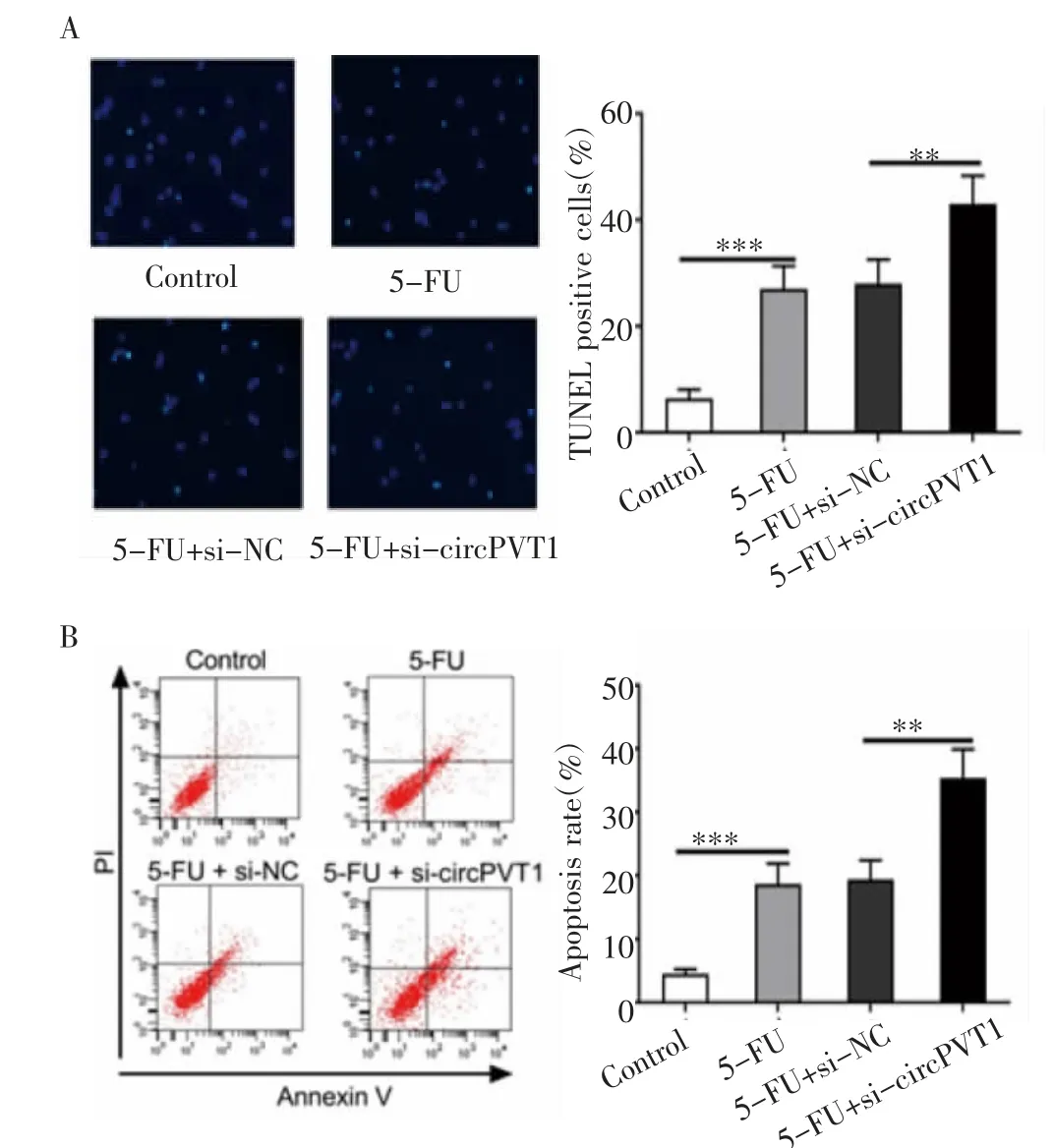
圖3 沉默circPVT1增強5-FU對BGC823/5-FU細胞的凋亡促進作用Fig 3 Silencing circPVT1 enhances the promotion effect of 5-FU on theapoptosisof BGC823/5-FU cells
2.4 沉默circPVT1對Bcl-2、Bax和 caspase-3 mRNA表達水平的影響 RT-PCR結果表明5-FU處理可以下調Bcl-2的表達,上調Bax和caspase-3的表達。與5-FU+si-NC組相比,5-FU+si-circPVT1組BGC823/5-FU細胞中Bcl-2的mRNA表達水平明顯降低(P<0.01,圖4A),Bax和caspase-3的mRNA表達水平明顯升高(P<0.01,圖4B、4C)。
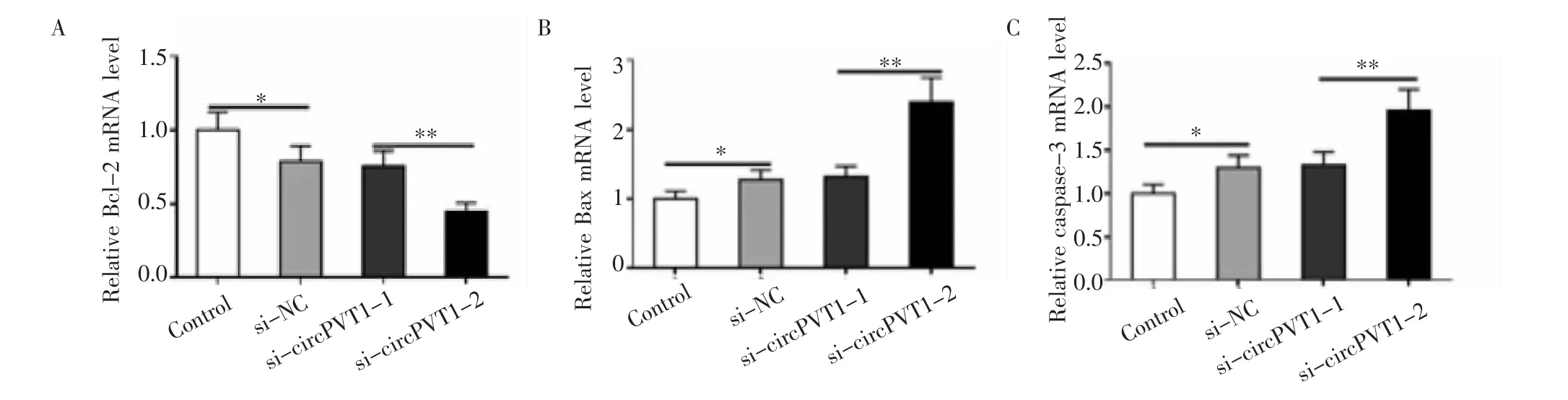
圖4 沉默circPVT1對Bcl-2、Bax和caspase-3 mRNA表達水平的影響Fig 4 Theeffect of silencing circPVT1 on theexpression levelsof Bcl-2,Bax,and caspase-3 mRNAs
2.5 沉默circPVT1對Bcl-2、Bax和caspase-3蛋白表達水平的影響 Western印跡結果表明,5-FU處理可以下調Bcl-2的表達,上調Bax和caspase-3的表達。與5-FU+si-NC組相比,5-FU+si-circPVT1組BGC823/5-FU細胞中Bcl-2的蛋白表達水平明顯降低,Bax和caspase-3的蛋白表達水平明顯升高(P<0.01,圖5)。
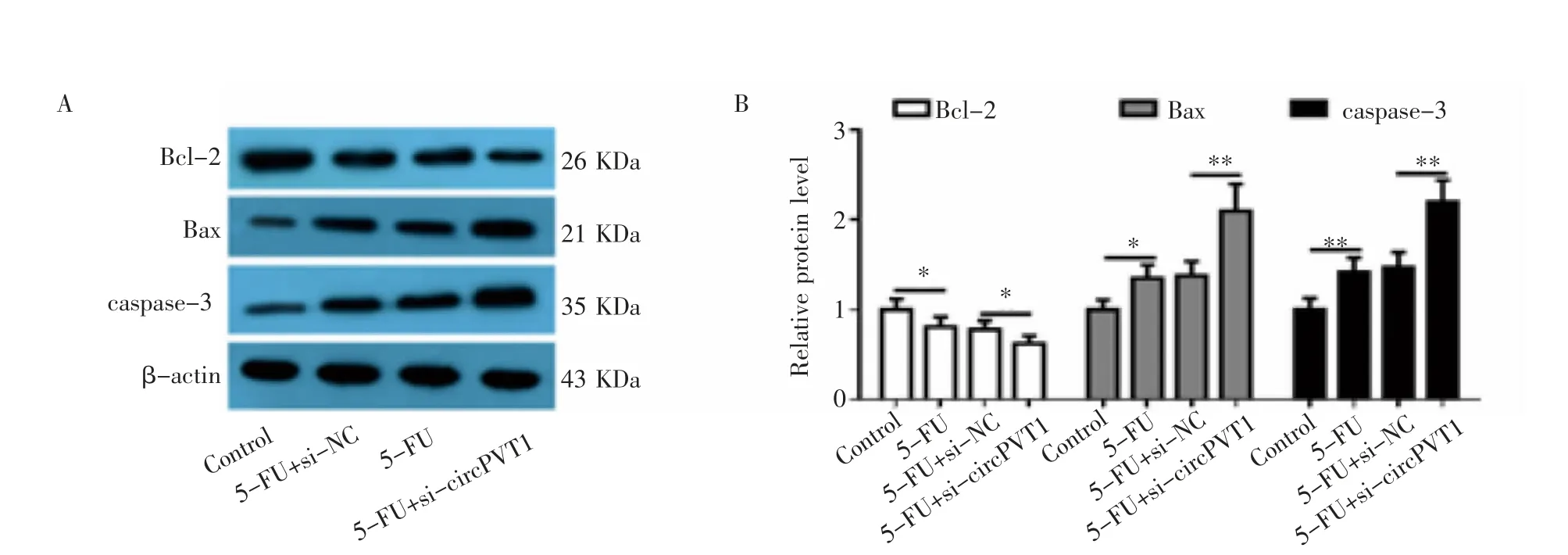
圖5 沉默circPVT1對Bcl-2、Bax和caspase-3蛋白表達水平的影響Fig 5 Theeffect of silencing circPVT1 on theexpression levelsof Bcl-2,Bax,and caspase-3 proteins
2.6 沉默circPVT1抑制裸鼠BGC823/5-FU移植瘤生長裸鼠移植瘤實驗 結果顯示,5-FU+sicircPVT1組移植瘤體積(圖6A)和質量(圖6B)均小于5-FU+si-NC組,差異均具有統計學意義(均P<0.05)。

圖6 沉默circPVT1抑制裸鼠BGC823/5-FU移植瘤的生長Fig 6 Silencing circPVT1 inhibitsgrowth of BGC823/5-FU xenograftsin nudemice
3 討論
胃癌是最常見的消化道惡性腫瘤之一,以5-FU為基礎的化療是胃癌患者手術后輔助化療以及中晚期胃癌患者的標準治療方案[11]。然而,由于對5-FU產生原發性或獲得性耐藥性,部分胃癌患者在化療后仍會發生腫瘤復發和轉移,導致預后不良。探尋與5-FU化療敏感性相關的分子機制對改善胃癌患者的預后具有重要意義。本研究發現沉默circPVT1可以增強胃癌細胞對5-FU的化療敏感性,其機制可能是通過調控Bcl-2、Bax和caspase-3的表達以促進細胞凋亡。
circRNA是一類參與轉錄和轉錄后基因表達調節的非編碼RNA。多項研究表明,circRNA的異常表達在包括胃癌在內的多種腫瘤的發生、發展中起重要作用[12-13]。目前研究認為,circRNA有望成為腫瘤診斷的生物標志物和治療的新靶點[14-15]。此外,circRNA在腫瘤耐藥中的作用也受到廣泛關注[16]。Zhou等[7]發現,hsa_circ_0004015可以通過調控miR-1183/PDPD1軸來影響埃克替尼耐藥非小細胞肺癌細胞對化療藥物的敏感程度。徐飛等[17]研究也證實,抑制circ_MIHFD2的表達可增強細胞對培美曲塞的敏感性。circPVT1也稱之為circ6,是新近被證實與腫瘤發生、發展和耐藥性相關的基因[9,18]。Chen等[8]通過分析胃癌組織和癌旁正常組織發現5 500個circRNAs在胃癌組織中差異表達,其中circPVT1在胃癌組織中的表達顯著升高,并提出circPVT1可以獨立作為預測胃癌患者預后的生物標志物。此外,他們還發現circPVT1序列上包含多個miR-125b的結合位點,可以作為miR-125b的“海綿”,促進MGC-803和AGS細胞的增殖。此外,有研究發現circPVT1在腫瘤細胞化療耐藥性的產生和發展過程中起關鍵作用[9,19]。沉默circPVT1可以增強骨肉瘤細胞對阿霉素和順鉑的敏感性[9]。Chen等[20]發現,circPVT1敲低能夠增強順鉑對非小細胞肺癌耐藥細胞A549/DDR活力的抑制作用和凋亡的誘導作用。然而,circPVT1對5-FU耐藥胃癌細胞的影響尚不清楚。本研究發現,circPVT1在5-FU耐藥患者胃癌組織中的表達水平明顯高于circPVT1在5-FU敏感患者胃癌組織中的表達水平。與此一致,在胃癌5-FU耐藥細胞株BGC823/5-FU中,circPVT1的表達明顯增加。這些結果提示circPVT1表達的上調可能與胃癌患者對5-FU的耐藥性有關。為進一步觀察circPVT1在胃癌細胞對5-FU耐藥中的可能作用,本研究將靶向circPVT1的siRNA轉染至胃癌耐藥細胞株BGC823/5-FU中,并通過CCK-8和克隆形成實驗分析circPVT1沉默對耐藥細胞增殖的影響。結果發現,circPVT1沉默可以增強5-FU對BGC823/5-FU細胞增殖的抑制作用。此外,TUNEL和流式細胞術實驗顯示,circPVT1沉默能夠增強5-FU對BGC823/5-FU細胞凋亡的促進作用。提示circPVT1沉默能夠增加BGC823/5-FU細胞對5-FU的敏感性,達到更好的抗腫瘤效應。另外,本研究通過構建BGC823/5-FU細胞裸鼠移植瘤模型,在體內也證實沉默circPVT1可以增強BGC823/5-FU細胞對5-FU的敏感性。因此,circPVT1有望成為克服胃癌細胞5-FU耐藥的治療靶點。
鑒于大部分化療藥物主要通過誘導腫瘤細胞凋亡而發揮抗癌效應,細胞凋亡通路被認為是與耐藥性相關的重要機制[21]。因此,為進一步分析circPVT1對5-FU耐藥性影響的相關機制,本研究分析了凋亡相關因子的表達變化。結果發現,5-FU處理導致胃癌耐藥細胞中Bcl-2的表達下調,以及Bax和caspase-3的表達上調,而沉默circPVT1可以在一定程度上增強5-FU對細胞凋亡相關因子Bcl-2、Bax和caspase-3表達的影響。因此推測,沉默circPVT1可能通過調控凋亡信號通路以增強胃癌細胞對5-FU的耐藥性。
綜上所述,沉默circPVT1能夠在體內和體外增強胃癌細胞對5-FU的敏感性,這可能與其對細胞凋亡相關蛋白的調控作用有關。然而,circPVT1在胃癌細胞對5-FU耐藥中的調控作用還有待進一步研究。

