淺談有機化學中的電子效應理論及其在教學中的重要性
趙冬艷
(天津農學院 天津 300384)
有機化學是高等院校涉農專業的重要基礎課,筆者在長期的教學實踐中,深刻體會到電子效應理論是學生掌握有機化合物的結構和性質的基礎,是學好有機化學這門課程必須掌握的基本理論。因此,在有機化學教學過程中,必須把電子效應理論作為重點和難點,講明白、講透徹,讓學生理解并應用,只有這樣,才能交給學生一把打開有機化學知識大門的鑰匙,使學生知其然更知其所以然。
1 電子效應的含義及類型
1.1 電子效應的含義
使共價鍵中電子密度分布狀況改變的作用稱為電子效應。
電子密度在共價鍵中的分布情況,不僅取決于鍵合原子的電負性,而且還受與共價鍵相連的原子或基團的極性以及外部環境的影響。如:丙烯分子中,—CH3的存在,使得碳碳雙鍵中兩個碳原子上電子密度并不均勻;硝基苯分子中,—NO2影響了苯環中碳原子上的電子密度。因此,—CH3和—NO2分別對碳碳雙鍵和苯環產生了電子效應。
1.2 電子效應的類型
根據原子或基團使共價鍵電子密度改變的原因不同,將電子效應分為兩類,即誘導效應(I)和共軛效應(C)。
2 誘導效應
2.1 誘導效應的定義
誘導效應是指在有機分子中,由于電負性不同的原子或基團的影響,使分子中成鍵電子云向某一方向偏移的效應。用符號I表示。
2.2 誘導效應的類型
誘導效應是由于靜電引力產生的。共價鍵若與某個吸電子基或斥電子基相連,則其極性就會受這個基團的影響而發生改變(即電子密度發生偏移),這時我們就說吸電子基或斥電子基對該共價鍵產生了誘導效應。由吸電子基引起的誘導效應稱為吸電子誘導效應(-I效應),由斥電子基引起的誘導效應稱為斥電子誘導效應(+I效應)。
吸電子基或斥電子基的判斷是與H進行比較,見圖1。
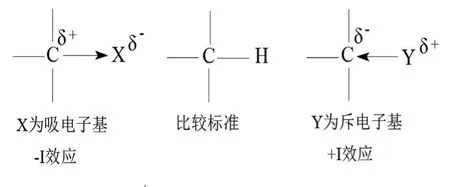
圖1:吸電子基或斥電子基的判斷及誘導效應
常見的吸電子基及強弱順序:

常見的斥電子基及強弱順序:

2.3 誘導效應的特點
誘導效應沿著共價鍵傳遞并減弱,一般其影響不超過三個共價鍵。
例如,1-氯丁烷分子中,由于Cl的-I效應,不僅使C1帶有部分正電荷,還使C2也帶有少量正電荷,也使C3帶有更少量的正電荷,隨著-I效應的減弱,C3—C4幾乎不受影響,見圖2。
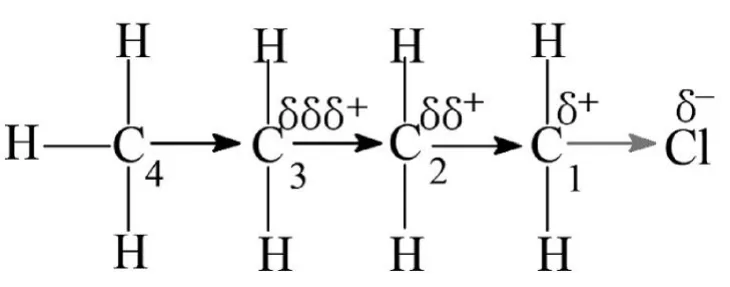
圖2:1-氯丁烷分子中Cl對C—C鍵的影響
3 共軛效應
3.1 電子離域現象和共軛體系
電子離域現象一般是指三個或三個以上的P軌道彼此從側面重疊形成大π鍵,使電子的活動范圍擴大的現象。如,1,3-丁二烯分子中,四個π電子不是兩兩分別固定于兩個碳碳雙鍵之中,而是擴展到四個碳原子之間。再如,氯乙烯分子中,氯原子p軌道上孤對電子也不是固定在氯原子中,而是分布于整個分子中。
電子離域現象的結果:(1)電子云密度趨于平均化;(2)鍵長趨于平均化;(3)內能降低,分子穩定。
凡是能發生電子離域的結構體系統稱為共軛體系。
3.2 共軛效應
3.2.1 共軛效應的定義
共軛效應是指共軛體系中原子的相互影響而引起的電子離域作用,用符號C表示。
3.2.2 共軛效應的特點
(1)共軛效應只存在于共軛體系中,并可沿碳鏈一直傳遞下去;(2)共軛體系中電子云密度疏密交替。
3.2.3 共軛效應的類型
(1)供電子共軛效應和和吸電子共軛效應。由于共軛體系內部的原子或基團對體系的影響不同,共軛效應可以分為供電子共軛效應(+C)和吸電子共軛效應(-C)。
如果與共軛體系相連的原子或基團有未共用電子對,那么,這些原子或基團對共軛體系產生+C效應。如—NR2、—NHR、—NH2、—OH、—OR、—X等都對共軛體系產生+C效應。
如果與共軛體系相連的基團中有重鍵且電負性較大,則對共軛體系產生-C效應。如—NO2、—CN、—SO3H、—CHO、—COR、—COOH等都對共軛體系產生-C效應。
(2)靜態共軛效應和動態共軛效應。由內部結構產生的共軛效應稱為靜態共軛效應,在化學反應時受外界電場(試劑)影響產生的共軛效應稱為動態共軛效應。見圖3。
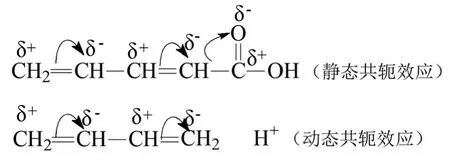
圖3:靜態共軛效應和動態共軛效應
3.3 共軛體系的類型
3.3.1 π-π共軛體系
(1)π-π共軛體系的定義。雙鍵、單鍵交替排列的共軛體系稱為 π-π共軛體系。
π-π共軛體系可以理解為是π軌道與π軌道交蓋重疊形成的共軛體系。1,3-丁二烯是最簡單的共軛二烯烴,自然界的許多有機化合物分子中存在π-π共軛體系,如維生素A、類胡蘿卜素、葉綠素等。
(2)π-π共軛體系形成的條件。 π-π共軛體系中所有原子必須共平面,且每個原子上有一個垂直于該平面的p軌道;π-π共軛體系中至少是兩個 軌道交蓋重疊。如,下列分子中都存在 π-π共軛體系,見圖4。

圖4:幾種有機分子中的-共軛體系
(3)π-π共軛體系的特點。 π-π共軛體系中,雙鍵、單鍵交替排列,電子向電負性大的原子偏移。電子離域的范圍越大,π-π共軛體系越穩定。
3.3.2 p-π共軛體系
(1)p-π共軛體系的定義。p-π共軛體系是p軌道與 軌道交蓋重疊形成的共軛體系。
(2)p-π共軛體系的類型。與雙鍵碳原子直接相連的原子具有p軌道,其p軌道與雙鍵π軌道平行并側面重疊形成p-π共軛體系。
氯原子的p軌道與碳碳雙鍵、苯環大 鍵可以形成p-π共軛,與如氯乙烯、氯苯都是p-π共軛體系,見圖5。同樣,氧原子的p軌道也可與苯環大π鍵形成p-π共軛,苯酚也是p-π共軛體系。苯胺是一種比較特殊的p-π共軛體系(N的sp3雜化軌道與苯環形成 p-π共軛)。這種p-π共軛體系的特點是產生+C效應。
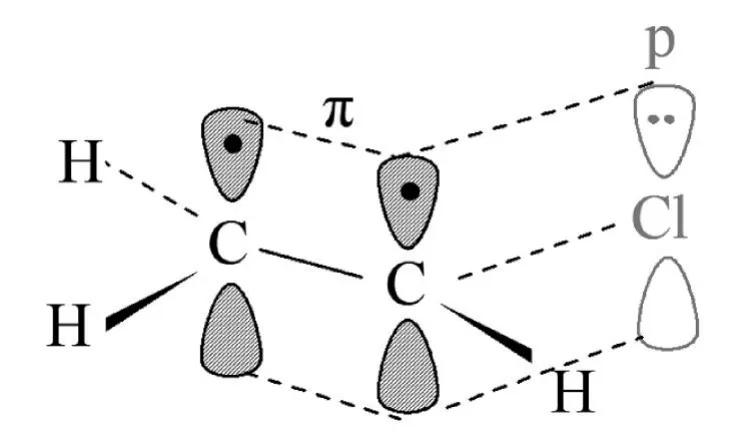
圖5:氯乙烯分子中的p-共軛體系
烯丙基自由基、烯丙基碳正(負)離子的p軌道也可以與π軌道形成p-π共軛,這種p-π共軛體系的特點是烯丙基自由基、烯丙基碳正(負)離子的穩定性增加,見圖6。
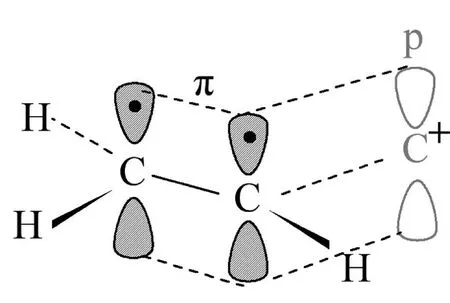
圖6:烯丙基碳正離子形成的p-π共軛體系
3.3.3 超共軛
(1)σ-π超共軛。與碳碳雙鍵直接相連的C—Hσ鍵上的電子云與π鍵電子云部分重疊形成的電子離域體系,稱為σ-π超共軛。
如,丙烯分子中,與碳碳雙鍵相連的甲基可以繞C—Cσ鍵旋轉,當旋轉到某一角度時,甲基中的C—Hσ鍵與碳碳雙鍵中的π鍵在同一平面內,C—Hσ鍵的鍵軸與π鍵p軌道近似平行,于是可以部分重疊,形成電子離域體系。由于C—Hσ鍵與π鍵的重疊的程度較小,因此,這種電子離域體系較弱,稱為超共軛,電子從C—Hσ鍵向π鍵流動,見圖7。
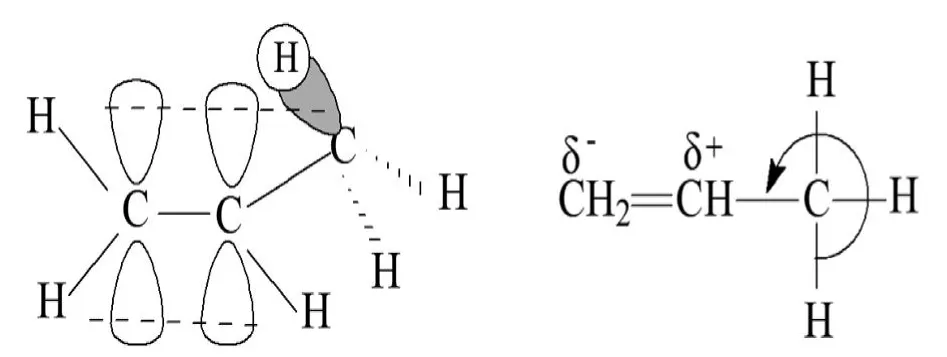
圖7:丙烯分子中的σ-超共軛
由于C2—C3鍵的旋轉,丙烯分子中的3個C—Hσ鍵都可以參與超共軛。在σ-π超共軛體系中,參與超共軛的C—Hσ鍵越多,體系越穩定。
(2)σ-p超共軛。σ-p超共軛是飽和碳原子上的C—Hσ鍵與碳正離子、自由基中心碳原子的p軌道側面交蓋形成的超共軛體系。
烷基自由基、烷基碳正(負)離子都可以形成σ-p超共軛體系,見圖8。
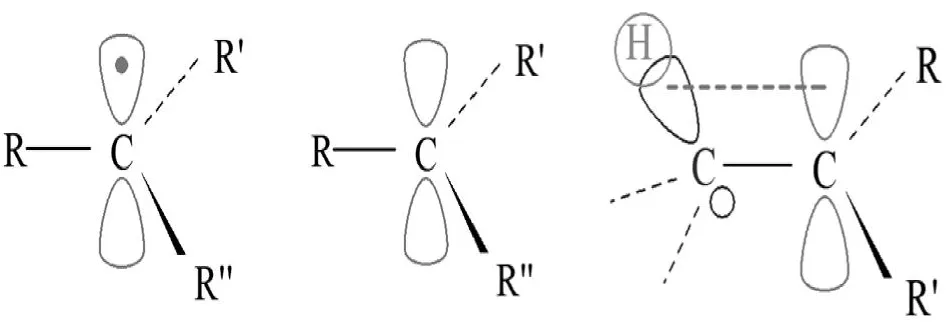
圖8:烷基自由基、碳正離子的結構及σ-p超共軛示意圖
參與超共軛的C—Hσ鍵越多,體系越穩定。
4 電子效應理論的應用
4.1 電子效應理論的重要性
電子效應理論是有機化學教學中的重點和難點。
電子效應理論的重要性是因為許多有機化合物的性質和有機化學反應的特點都受電子效應的影響,可以用電子效應理論去解釋。
學生掌握了電子效應理論,可以加深對有機化合物性質及化學反應機理的理解,而對于學生來說,電子效應理論又是比較抽象的,理解和掌握有一定的難度。這也是教師在教學中需要注意的。
4.2 兩種電子效應的區別與聯系
如前所述,誘導效應和共軛效應產生的原因不同,特點不同,同一個原子或基團,可以產生不同的電子效應。一個有機分子所受電子效應的影響,是這兩種電子效應共同作用的結果。
例如,丙烯醛分子中,—CHO對碳碳雙鍵產生-I效應,同時丙烯醛是π-π共軛體系,—CHO對碳碳雙鍵產生-C效應,這兩種電子效應的方向是一致的。氯乙烯分子中,Cl對碳碳雙鍵產生-I效應,由于氯乙烯是p-π共軛體系,Cl對C碳碳雙鍵又產生+C效應,這兩種電子效應的方向不一致,而且-I>+C。
4.3 電子效應理論應用實例
4.3.1 解釋自由基、碳正離子的穩定性
自由基、碳正離子分別是共價鍵均裂、異裂的產物,是在化學反應中形成的瞬間存在的反應中間體,其越穩定,化學反應越容易進行。
烷基自由基、碳正離子的穩定次序是:叔自由基>仲自由基>伯自由基>甲基自由基、叔碳正離子>仲碳正離子>伯碳正離子>甲基碳正離子。見圖9。

圖9:自由基、碳正離子的穩定次序
從圖9可以看出,除甲基自由基(碳正離子)外,烷基自由基和碳正離子都是σ-p超共軛體系,叔自由基(碳正離子)中參與σ-p超共軛的C—Hσ鍵多于仲自由基(碳正離子),因此,叔自由基(碳正離子)的穩定性大于仲自由基(碳正離子)。同理,仲自由基(碳正離子)>伯自由基(碳正離子)>甲基自由基(碳正離子)。
烯丙基自由基(碳正離子)的穩定性大于烷基自由基(碳正離子),因為前者是p-π共軛體系,電子離域范圍更大,體系更穩定。
4.3.2 解釋烷烴鹵代反應中氫原子的活性
烷烴鹵代反應中,烷烴中氫原子的反應活性不同,叔氫>仲氫>伯氫。如丙烷的溴代反應,反應的主要產物是2-溴丙烷,即溴原子主要是取代仲氫。
烷烴鹵代反應的機理是自由基反應,鏈引發階段產生溴自由基后,溴自由基既可以奪取丙烷分子中的伯氫,也可以奪取仲氫,生成溴化氫和烷基自由基。因為異丙基自由基(仲自由基)比丙基自由基(伯自由基)穩定,所以主要生成異丙基自由基,然后異丙基自由基從溴分子中奪取一個溴原子,生成產物2-溴丙烷。
4.3.3 解釋烯烴加成反應中的馬氏規則
(1)用超共軛效應解釋馬氏規則。以丙烯與HBr加成為例。丙烯與HBr加成分兩步進行。
第一步,親電試劑(H+)既可以進攻C1,也可以進攻C2,分別生成兩種碳正離子,見圖10。
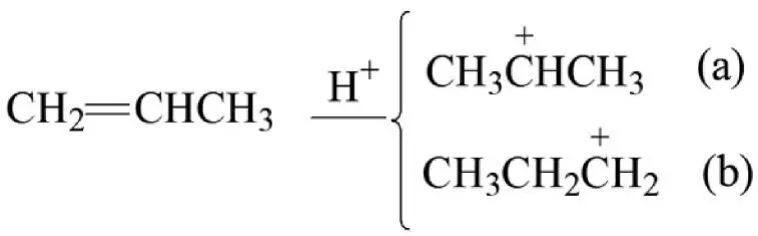
圖10:H+進攻 C1、C2生成的兩種碳正離子
從圖10可見,碳正離子(a)和(b)都是σ-p超共軛體系,(a)是仲碳正離子,(b)是伯碳正離子,(a)比(b)穩定,所以,H+主要進攻 C1生成(a)。第二步,Br-與(a)結合生成產物2-溴丙烷。
用σ-p超共軛判斷碳正離子的穩定性,可以比較容易地判斷烯烴加成反應的主要產物。如,判斷1-氯丙烯與HBr加成的主要產物。1-氯丙烯與HBr加成的主要產物不能直接用馬氏規則判斷,但可以用碳正離子的穩定性來判斷,見圖11。

圖11:1-氯丙烯與HBr加成的主要產物
(2)用誘導效應和p-π共軛效應解釋馬氏規則。以氯乙烯與HBr加成為例。氯乙烯是氯代烯烴,其與HBr的加成符合馬氏規則。氯乙烯分子中,Cl對碳碳雙鍵產生-I效應和p-π共軛效應(+C),-I>+C,使碳碳雙鍵上電子密度降低,而共軛體系電子密度疏密交替的結果,使得C2的電子密度大于C1的電子密度,所以,H+主要進攻C2,生成比較穩定的碳正離子,隨后生成產物1-氯-1-溴乙烷。見圖12。

圖12:氯乙烯分子中的電子效應及與HBr加成的主要產物
4.3.4 解釋共軛二烯烴加成反應的特點
共軛二烯烴有兩種加成方式,即1,2-加成和1,4-加成。以1,3-丁二烯與HBr加成為例。
第一步,H+既可以進攻C1,也可以進攻C2,分別生成兩種碳正離子,見圖13。

圖13:H+進攻1,3-丁二烯C1、C2生成的碳正離子
從圖13可以看出,H+進攻C1生成的碳正離子(a)是p-π共軛體系,而進攻C2生成的碳正離子(b)不是p-π共軛體系,因此(a)比(b)穩定,第一步主要生成(a)。碳正離子(a)中,正電荷得以分散,見圖14。

圖14:碳正離子(a)中的p-共軛體系及正電荷分散示意圖
第二步,Br-既可進攻C2也可進攻C4,形成兩種加成產物,見圖15。

圖15:1,3-丁二烯與HBr加成的兩種產物
4.3.5 解釋芳烴親電取代反應的定位規律
當取代苯(苯環上有取代基,如甲苯、氯苯、硝基苯等。)發生親電取代時,原有的取代基影響新取代基進入苯環的位置及親電取代的難易程度,這就是取代基的定位效應,原有的取代基稱為定位基。
有兩類定位基,即鄰、對位定位基和間位定位基。鄰、對位定位基使新取代基主要進入其鄰和對位(鄰對位產物之和大于60%),并使苯環活化(除X外)。間位定位基使新取代基主要進入其間位,并使苯環鈍化。究其原因,是因為定位基對苯環產生了電子效應(誘導效應和共軛效應),結果使苯環上電子密度分布不均勻,親電試劑首先進攻電子密度大的部位。
鄰、對位定位基的特點是與苯環相連的原子上只有單鍵,除碳原子以外都有未共用電子對,向苯環推電子(+C效應)。另一方面,除烷基對苯環產生+I效應外,其它鄰、對位定位基都對苯環產生-I效應。鹵原子對苯環產生的-I效應比+C效應強,因此使苯環上電子密度降低,但電子密度疏密交替的結果,鄰、對位的電子密度大于間位。烷基對苯環產生+I效應和+C效應的結果,使苯環的電子密度增加,鄰、對位的電子密度大于間位。—OH、—NH2、—OR、—NR2、—OCOR等對苯環產生的+C效應大于-I效應,結果使苯環電子密度增加,而且鄰、對位電子密度大于間位。
間位定位基大多數是強吸電子基團或與苯環相連的原子上有重鍵的基團,通過-I效應和-C效應使苯環上電子密度降低,而且使間位電子密度大于鄰、對位。如—NO2、—CHO、—COOH、—COR等都是間位定位基。
4.3.6 電子效應理論的其它應用
有機化合物的性質和化學反應機理都可以從電子效應理論得到解釋,如鹵代烴親核取代的反應活性、不同結構鹵代烯烴的反應活性,醇和酚酸性的比較,醛、酮親核加成反應的活性,羧酸的酸性比較,等等。
5 電子效應理論教學方法的探討
綜上所述,電子效應理論是有機化學教學的重點,也是學生學習的難點。怎樣講明白并讓學生掌握,是值得探討的問題。筆者在長期的教學實踐中,采用如下方法取得了比較滿意的效果。
(1)預設伏筆,適時揭曉。如在講授烷烴鹵代反應時,先通過實例,給出氫原子活性次序的結論,然后告訴學生,之所以結論是這樣的,是因為反應活性與中間體自由基的穩定性有關,自由基越穩定,反應越容易進行。自由基的穩定順序是怎樣的呢?后面的課程會講到。在講完超共軛效應后,自由基的穩定性就一目了然了。
(2)使用比喻,形象直觀。電子效應理論之所以不好理解,是因為其抽象性。在講課過程中,如果適當使用比喻的方法,可以增加直觀性,加深理解。如在講電子離域現象時,用個人活動范圍的大小來類比電子的分布,以說明電子離域范圍越大,分子內能越小,體系越穩定。在講π-π共軛體系時,給學生講“軛”字的本意是古代車子上放在牛馬脖子上的曲木,“共軛”就是兩頭牛脖子上的曲木,可以使兩頭牛并排行走,一個π軌道相當于一頭牛,π-π共軛就是至少兩個 軌道并列。在講解鄰、對位定位基的定位效應時,使用了拔河的比喻。如—OH對苯環產生了-I效應和+C效應(p-π共軛),這兩種電子效應的方向相反,就像是拔河比賽,結果+C>-I,使苯環上電子密度增加,親電取代容易進行。實踐證明,這種比喻的方法通俗易懂,能化抽象為具體,加深印象。
(3)加強引導,勤于應用。在教學中,引導學生自覺運用電子效應理論解決遇到的問題,在應用中理解和掌握。如,在講鹵代烴單分子親核取代反應(SN1反應)時,先告訴學生結論,各種鹵代烴的反應活性為烯丙基型、芐基型鹵代烴>叔鹵代烷>仲鹵代烷>伯鹵代烷>乙烯基型、芳基型鹵代烴,然后引導學生分析原因。SN1反應是分兩步進行的,第一步是決定反應速度的一步,這一步是C—X斷裂,產生碳正離子,碳正離子的穩定性決定了反應速度。這樣,學生就可以想到碳正離子的穩定性次序,應用到共軛體系的知識。
加強電子效應理論的教學,對于學生掌握有機化學的基礎知識是非常必要的,也是教學中必須加以重視的,是教和學都無法回避的。

