從海帶中提取碘的工業生產過程問題解析
胡協強 錢劍敏


摘要:碘是重要的化工原料之一,也是中學化學中常見的非金屬元素。圍繞工業提取碘的方法,在蘇教版2014年化學必修1第二專題中首次出現物質的工業提取流程。文章就流程中教師、學生可能會遇到的一些問題與疑惑,通過查閱資料,作出了相應的解析。
關鍵詞:碘;工業生產;問題解析
文章編號:1008-0546(2021)04-0031-02 中圖分類號:G632.41 文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2021.04.009
一、引言
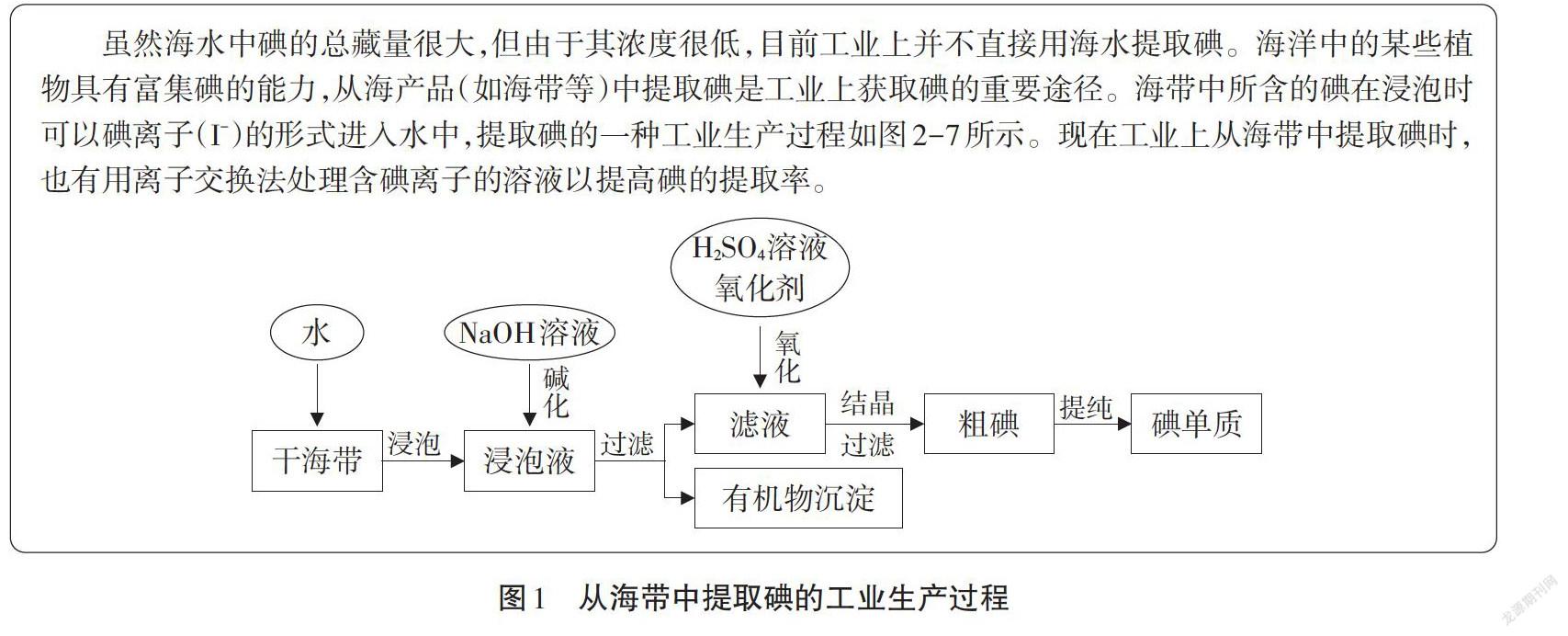
碘是基礎工業原料和重要戰略物資,廣泛應用于食品醫藥、化工、農業、國防軍事等領域。從海產品中提取碘是我國工業上獲取碘的重要途徑。蘇教版2014年化學必修1第二專題中介紹了碘的提取原理及流程,主要內容如圖1所示。
通過學習,學生可以進一步鞏固氧化還原知識和物質分離提純的方法,而且可以讓學生第一次了解接觸工業流程圖的基本框架模型如圖2所示。
但在多年的教學過程中,筆者每到此處,總感覺教材處理的很精練,教學參考書上也沒有相關知識的介紹,因此給教師帶來了一些疑惑和問題。而這些疑惑和問題又經常不加重視,比較草率地給學生照本宣科一下。回顧起來總不是滋味,教學大綱雖然只要求“了解從海產品中提取碘單質的基本原理和方法”,但教師傳道授業解惑,還是需要了解得更加詳細一點。因此筆者歸納了一些問題并通過查閱資料,對該原理及流程加深了認識。
二、問題解析
1.原料的選擇和處理
碘在自然界中主要呈分散狀態存在,一般不形成礦物堆積,沒有具有商業價值的獨立碘礦床。海洋雖是自然界中最大的“碘庫”,其總量約在8.6×1012t,但含量僅為13-75ug/L。而像海藻之類的海產品具有富集碘的功能,碘含量一般在0.3%以上,最高可達0.7%~0.9%。因此海藻、海帶是生產碘的重要原料。
碘在海帶中以無機碘(KI)和有機碘兩種形式存在。將海帶剪碎,放人清水中浸泡半小時以上,過濾,濾液中出現無機碘(KI)。若將浸泡過的海帶進一步用粉碎機絞碎,濾液中碘離子的含量將更高。
2.氧化劑的選擇
當前工業上用氯氣、氯酸鉀、過氧化氫、亞硝酸鹽等作為提取碘的氧化劑。氯氣由于易得且廉價,是最常用的氧化劑,但氧化操作需要特別仔細,否則易造成過氧化。這一點在化學1(必修)教學參考書中有介紹“氯氣通入淀粉碘化鉀溶液會看到溶液變藍,繼續通氯氣溶液藍色褪去”,反應分別為2KI+Cl2=2KCl+I2、I2+5Cl2+6H2O=2HIO3+10HCl。氯酸鉀、過氧化氫等在酸性條件下同樣不僅可以將碘離子氧化成碘單質,還可以繼續將碘單質氧化成碘酸根離子(IO3-)。亞硝酸鹽可將碘離子氧化成碘單質:2NO2-+2I-+4H+=2NO+I2+2H2O,但不能繼續氧化碘單質,是較為合適的氧化劑,缺點是價格較高。
在流程中僅用“氧化劑”表示,可能是考慮到生產企業按照自己的實際情況,選擇最合適的氧化劑。
3.反應液的酸堿性
流程中在浸泡液中加入NaOH溶液進行堿化,通過查閱資料得知,在浸泡液中會出現一種有機質(褐藻糖膠),該物質的存在不僅會影響碘的純度,還由于其具有抗氧化性會消耗更多的氧化劑,但在氫氧化鈉溶液中易形成褐藻酸鈉絮狀沉淀即流程中的有機物沉淀。
在氧化碘離子時,通常采用硫酸酸化,主要是基于以下兩點考慮:①在堿溶液中碘單質不易存在,可發生歧化反應3I2+3NaOH=5NaI+NaIO3+3H2O。②氧化劑在酸性條件下具有更強的氧化性,更易將碘離子氧化成碘單質。有實驗發現在PH<2的酸性介質中,亞硝酸鹽具有最佳的反應效果。另外在PH為4~4.5的條件下,加入極少量的亞硝酸鹽并鼓入空氣,能促進碘離子氧化成碘單質,這種方法可大大降低亞硝酸鹽的用量,更節約成本。還有研究表明,磷肥廠綜合治理回收碘的過程中,PH為2~3時,使用NaCIO,回收效果最好。
4.提純和分離的方法
在流程中具體提到了過濾和結晶兩種分離的方法,從粗碘到碘單質的提純方法沒有具體化。筆者查閱相關資料得知:在用活性炭吸附法提取碘后,吸碘后的活性炭用氫氧化鈉或碳酸鈉洗脫,碘轉入洗脫液中,再加入鹽酸酸化,析出粗碘。也有利用碘易升華的特性,在高溫下使碘升華結晶。
平時上課的時候,大多數教師認為用萃取分液、蒸餾的方法可提取碘,但有資料表明,由于碘易升華,在77℃時升華現象非常明顯,而四氯化碳的沸點為76.8℃,因此常溫下不能用蒸餾法來分離四氯化碳(常用萃取劑)和碘。有教師設計了圖3所示流程模擬工業上分離提純碘單質,筆者認為比較可取。
三、結語
通過對流程圖的仔細解讀,可以讓學生加深對流程圖中關鍵詞的認識,進一步了解流程中具體的操作意義和操作目的及操作結果。提高學生深刻理解化學、技術、社會和環境之間的相互聯系,培養了學生的科學素養。實踐是檢驗真理的唯一標準,我們教師對教學中的疑惑和問題不斷探究,也有利于我們教師眼界和知識的拓展,不固步自封,不自以為是。
參考文獻
[1]張金水.淺談碘的提取[J].北學教學,2014(10):87-90
[2]張紅俊加何培養與提升學生化學學科核心素養——“溴碘的提取”案例評析[J].中學化學教學參考,2017(9):63-64
[3]黃堯,吳帶赦.碘的提取、回收方法及其研究進展[J].現代化工,2014(36):37-39
[4]王景剛,馮麗娟.碘提取方法的研究進展[J].無機鹽工業,2008(11):11-14
[5]丁小勤.海帶中碘的提取實驗改進[J].實驗與創新思維,2009(8):43

