海水青鳉攝食微塑料的熒光和C-14同位素法示蹤定量研究
田莉莉, 文少白, 馬旖旎, 季 榮
1.南京大學環境學院, 江蘇 南京 210023
2.江蘇省農業科學院農業資源與環境研究所, 江蘇 南京 210014
3.海南醫學院熱帶醫學與檢驗醫學院, 海南 海口 571199
微塑料(小于5 mm)作為環境中一種無處不在的污染物引起國內外廣泛關注,2015年的聯合國環境大會上,已經將海洋微塑料污染列為與全球氣候變化、臭氧耗竭等并列的重大環境問題[1-3]. 近年來,微塑料在多種環境介質中被檢出[4],如表層海水[5]、近海河口海岸[6]、沉積物[7-8]和海洋生物[9-10]等. 微塑料可能通過物理毒害、化學毒性或載體作用等多種方式危害生態系統健康[11]. 海洋微塑料的生物效應研究發現,高濃度的PVC(聚氯乙烯,polyvinyl chloride)微塑料會影響海洋浮游藻類的光合作用[12],PS(聚苯乙烯,polystyrene)微塑料會影響多種浮游動物和太平洋牡蠣的攝食效率[13-14]. 微塑料還會影響蚤狀鉤蝦的生長[15],造成藍貽貝細胞和組織產生一定的損傷[16],影響牡蠣的能量分配和繁殖[17],影響斑馬魚肝臟的脂質和能量代謝[18]等. 微塑料對海洋生物產生毒性的原因與其進入生物體以及在體內如何分布有一定相關性,因此全面地了解海洋生物對微塑料的攝入和排出過程對其毒性評估具有重要意義.
一般大尺寸塑料在水環境中的存在狀態與其密度和形狀直接相關,但是當塑料顆粒達到微米尺度時,由于自身性質和環境因素的影響,微塑料的存在狀態會發生不同變化,如團聚、降解、遷移、沉降等行為. 環境中微塑料發生降解的關鍵因素是太陽光中紫外線的照射[19],微塑料表面接觸到光的面積和能量會對其光降解產生一定影響[20]. 微塑料在環境中自身團聚或與環境中其他顆粒物發生異質團聚的行為造成微塑料發生沉降[21],微塑料被微生物附著后表面形成生物膜,導致自身浮力發生改變,使漂浮在水面或者懸浮在水中的微塑料向更深水層縱向遷移[22],微塑料被海洋生物攝食后可能在體內停留或隨著糞便排出體外[10,13,23],微塑料的環境行為受到其賦存狀態的影響,但目前海洋生物攝入和排出的過程對微塑料在環境中賦存狀態的影響尚不清楚.
已有研究報道了海洋魚體中微塑料的檢出[24-25],但目前海洋魚類對微塑料的攝入和排出的定量研究仍比較缺乏. 熒光標記法是實驗室研究微塑料最常用的方法,熒光顯微鏡可以直接觀察微塑料在生物體內的分布,如Pitt等[26]研究了斑馬魚對微塑料的攝食及其在斑馬魚體內的分布;Lee等[27]研究了斑馬魚胚胎對微塑料的富集;Cong等[28]通過熒光顯微鏡下計數研究了海水青鳉(marine medaka,Oryziasmelastigma)對微塑料的富集,并對顆粒濃度進行了分析. 當微塑料粒徑較小時,在顯微鏡下無法實現計數,以顆粒濃度定量就不再適用. 熒光分光光度計可以實現質量濃度的檢測,將生物組織消解處理后通過熒光信號的強度對生物體內的微塑料進行定量[29],然而熒光標記的檢測限較高,當生物基質中存在熒光信號時研究結果會受到一定的影響. 因此,當微塑料含量較低或粒徑較小時需要檢測靈敏且易于排除背景干擾的方法. C-14同位素示蹤技術具有靈敏度高、定量準確、檢測方便等優點,在獲得C-14標記微塑料的基礎上可以用來定量研究微塑料在生物體內的富集與分布[30].
為了研究海洋中微塑料與海洋生物的相互影響,定量海洋生物對微塑料的攝入和排出,該研究以熒光法和C-14同位素法為基礎,研究海洋生物對微塑料的攝食過程. 海水青鳉是一種具有個體小、世代周期短、產卵率高等特點的海洋模式生物,被廣泛應用于海洋魚類的毒性效應研究中[31]. 因此以海水青鳉為受試生物,選取熒光標記的PS微塑料和C-14標記的PS微塑料,使用不同方式定量研究微塑料在海水青鳉不同成長階段的攝入情況,觀察并定量研究微塑料在海水青鳉不同部位的分布特征,同時研究海水青鳉攝食行為對微塑料狀態的影響,以期全面地了解海洋中微塑料與生物的相互作用,為海洋微塑料的環境風險評價提供理論支撐.
1 材料與方法
1.1 試驗材料
氯化鈉(NaCl)、十二烷基磺酸鈉(SDS)和乙二胺四乙酸二鈉(EDTA-2Na)均購自南京化學試劑股份有限公司;Tris-HCl(1 mol/L,南京建成生物工程研究所);蛋白酶K(>30 U/mg,上海麥克林生化有限公司);天然海鹽購自天津中鹽技術研究所;閃爍液購自英國Meridian生物科技有限公司;熒光PS微塑料(粒徑0.5 μm)購自美國Thermo Fisher公司;C-14標記的PS微塑料(粒徑為0.3~0.5 μm,放射性比活度為 2 300 Bq/mg)為筆者所在課題組實驗室合成[20].
1.2海水青鳉培養
海水青鳉種源來自國家海洋監測中心,在筆者所在課題組實驗室馴化培養3年以上,試驗所用海水青鳉為繁殖三代后獲得,仔魚為1月齡,體長為(0.88±0.18) cm,成魚為3月齡,體長為(1.9±0.2) cm. 試驗前海水青鳉喂養于循環養殖系統(Z-A-S4,上海海圣生物實驗設備有限公司),所用海水為天然海鹽和純水配制而成的人工海水,海水鹽度為30‰,pH為8.2~8.4,培養溫度為26~28 ℃,光照周期為光照14 h、黑暗10 h. 培養期間,仔魚每日早晚各喂魚食一次,成魚每日早晚各喂食孵化24 h鹵蟲幼體一次,中午均喂魚食一次. 喂食結束后,及時清理殘留魚食及糞便以免污染水質.
1.3 海水青鳉攝入微塑料的定量研究
1.3.1熒光標記法
試驗開始前將海水青鳉從養殖系統轉移至燒杯,不喂食情況下清腸48 h. 添加熒光PS微塑料到400 mL人工海水中,為了更好地進行攝食機制探究,該試驗將PS微塑料濃度設置為50 mg/L,超聲分散均勻. 分別設置攝食組和分布組,每組燒杯中加入4條海水青鳉成魚,試驗在光照培養箱(GZX-300BS-Ⅲ,上海新苗實驗設備有限公司)中進行,溫度設定為27 ℃,光照周期為光照14 h、黑暗10 h. 攝食組于培養24 h后取樣,成魚整體稱重后消解,測定攝入總量;分布組于培養24 h后取一半成魚解剖測定,另一半成魚放入干凈海水中進行排出試驗,在排出72 h后取樣測定,解剖分離魚鰓、腸道和魚體三部分,先通過熒光倒置顯微鏡(Eclipse Ti-S,尼康儀器上海有限公司)觀察各部分熒光信號,觀察結束后再分別消解測定不同部分熒光信號強度,并根據標準曲線計算PS微塑料含量.
1.3.2C-14同位素法
由于仔魚帶有熒光背景,會對信號檢測造成干擾,因此試驗又采用C-14標記PS微塑料開展. 選取大小一致的仔魚,清腸48 h后待用. 設置低濃度組(5 mg/L)和高濃度組(50 mg/L),均添加C-14標記PS微塑料(分別為1.2、12 mg)于240 mL海水中,超聲分散30 min. 每個處理組中均加入仔魚12條,分別在24、48和72 h取樣測定. 試驗是在光照培養箱中進行,溫度27 ℃,光照周期為光照14 h、黑暗10 h. 取樣時用一次性吸管隨機將仔魚吸出,轉移至干凈海水中,清洗體表可能的殘留,清洗3次后,將仔魚放入閃爍管中稱重,消解并測定其放射性量.
1.3.3生物體消解方法
試驗采用蛋白酶消解法,參照Jiang等[32]研究方法并進行一定改進,試驗證明酶解過程對生物體內熒光微塑料的信號無影響. 配置混合消解液的步驟:計算配制1 L消解液所需各物質的量,稱取相應固體物質加入到1 L容量瓶,再加入1 mol/L Tris-HCl 250 mL,并加水定容至1 L,超聲20 min使物質充分溶解,即得混合消解液,其具體成分如表1所示.

表1 混合消解液成分表
成魚解剖后的不同組織分裝入離心管,魚鰓和腸道加入1 mL混合消解液,剩余魚體部分加入5 mL混合消解液,仔魚直接放入離心管,加入1 mL混合消解液,然后將離心管放在50 ℃恒溫水浴鍋中加熱15 min,再加入蛋白酶K(0.5~3)mg,升溫至60 ℃,繼續消解24 h. 消解結束后,取200 μL組織消解液加入到96孔板中,以不含生物組織的消解液作為空白,熒光酶標儀(Synergy H4, 美國Biotek有限公司)測定不同樣品中的熒光信號強度.
1.4 微塑料的賦存形態
為了觀察微塑料被生物攝食后在環境中賦存形態的改變,選取熒光PS微塑料喂食海水青鳉成魚,并記錄攝食過程. PS微塑料試驗濃度為50 mg/L,超聲20 min至PS微塑料在水中完全分散,加入4條成魚,培養過程中不喂食. 培養24 h,培養期間觀察并拍照記錄,培養結束后,取魚的糞便通過熒光倒置顯微鏡觀察,另取少量糞便低溫烘干,固定于導電膠后噴金45 s,通過掃描電子顯微鏡(Quanta 250 FEG,美國FEI有限公司)觀察PS微塑料的形貌變化,工作電壓設定為10 kV,燈絲電流為171 μA.
1.5 檢測方法
C-14放射性量檢測:使用液體閃爍計數儀LSC(LS6500,美國Beckman有限公司)測定樣品中放射性含量. 液體樣品1 mL與3 mL閃爍液充分混合后測定;生物樣品需經過消解后,將消解液與閃爍液以體積比為1∶3的比例混合均勻后測定.
熒光含量檢測:首先配制濃度為 1 000 mg/L的熒光PS微塑料儲備液,超聲分散30 min,梯度稀釋到濃度分別為2、5、10、20、100 mg/L,取200 μL加入到96孔板中,每個濃度5個平行,以純水作為空白,使用熒光酶標儀測定不同濃度熒光微塑料的熒光信號強度,所得熒光強度扣除背景信號后,根據PS濃度和熒光信號強度繪制標準曲線. 樣品中熒光微塑料的信號扣除背景信號后,根據標準曲線即可計算得到生物體內不同組織中微塑料的含量.
1.6 數據處理
數據以平均值±標準偏差(SD)形式表示,不同數據之間顯著性差異分析通過SPSS 18.0軟件進行One-way ANOVA分析,P<0.05即視為具有顯著性差異,且采用GraphPad Prism 5軟件繪圖.
2 結果與討論
2.1 海水青鳉攝入微塑料的定量研究
根據熒光PS微塑料的熒光信號強度與標準溶液濃度繪制標準曲線(見圖1),R2為0.999,線性較好. 測定消解液的熒光信號后根據標準曲線定量消解液中的微塑料含量,結果如圖2所示. 由圖2可見,當PS微塑料濃度為50 mg/L時,海水青鳉成魚在24 h 內攝食PS微塑料含量為(246.8±38.1)mg/g(以魚濕質量計),顯著(P<0.05)高于同樣暴露時間的仔魚攝食量〔(4.32±0.77)mg/g,以魚濕質量計〕. 這表明海水青鳉成魚具有更高的微塑料攝食能力.

圖1 PS微塑料濃度與熒光強度的標準曲線

注: 不同字母表示數據之間具有顯著性差異(P<0.05).
從海水青鳉仔魚攝食動力學結果(見圖3)可以看出,在不同濃度處理組中仔魚都攝食了一定量C-14標記PS微塑料,均是24 h攝入量較高,其中5 mg/L處理組PS微塑料最高含量為(1.49±1.18)mg/g(以魚濕質量計). 隨著培養時間的增加,PS微塑料含量先降后升,說明青鳉仔魚對PS微塑料的攝食是一個動態過程. 這與Cong等[28]研究結論一致,其通過熒光顯微鏡的觀察發現青鳉仔魚24 h攝食PS微塑料(10 μm)含量最高,但并未對攝入量進行定量. 由于目前常用的微塑料定量方法是在熒光顯微鏡下觀察計數微塑料的顆粒數,但對于粒徑較小的微塑料,在樣品處理過程中可能會造成信號泄露或顯微鏡下計數困難[32],因此小粒徑微塑料的定量數據目前報道較少. 該研究采用較為溫和的酶消解方式處理生物樣品,避免了因熒光信號泄漏對試驗結果的影響,通過制備得到C-14標記PS微塑料,利用C-14信號實現小粒徑微塑料在低濃度下的質量濃度檢測,以該實驗室制備所得C-14標記PS微塑料的最大比活度(8.0×104Bq/mg)來計算,最低檢測限可達2.5 μg/L,若能夠使用更高放射性比活度的C-14標記微塑料,可進一步降低檢測限. 由此說明C-14同位素法是檢測低濃度小粒徑微塑料的有效方法.
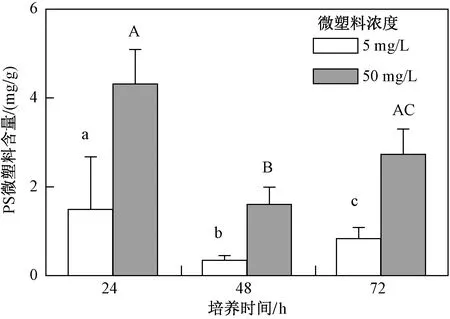
注: 不同小寫字母或大寫字母表示數據之間具有顯著性差異(P<0.05).
2.2 熒光標記法示蹤微塑料在海水青鳉體內的分布特征
Al-Sid-Cheikh等[30]采用C-14標記的納米級PS微塑料在扇貝(Pectenmaximus)體內的攝入、分布和排出情況,結果表明試驗所用的PS微塑料(24和250 nm)可以被扇貝快速攝入,粒徑越小攝入越多,而排出14 d后,粒徑較小的PS微塑料(24 nm)已經檢測不到,但是粒徑較大的PS微塑料(250 nm)排出28 d后仍有檢出,說明粒徑會影響微塑料的攝入和排出. 因此,小粒徑微塑料在海洋魚類中的攝入和排出仍值得關注.
海水青鳉成魚攝食PS微塑料24 h后,解剖分離魚鰓、腸道和魚體部分,熒光顯微鏡觀察結果(見圖4)顯示,海水青鳉攝食的PS微塑料魚鰓中有少量檢出〔見圖4(a)〕,腸道內有大量檢出〔見圖4(b)〕,魚體表皮〔見圖4(c)〕未觀察到明顯熒光信號,這說明魚體表皮對PS微塑料吸附作用可能較小. 這與已有研究[18,23,28]中發現消化道是魚富集微塑料的主要部位一致. Cong等[28]研究中將海水青鳉暴露于10 μm PS微塑料,發現腸道中富集PS微塑料最多,但并未在其他部分檢測到PS微塑料的存在. 該研究在魚鰓中也檢測到了PS微塑料,這可能與該研究中所用PS微塑料的粒徑(0.5 μm)較小有關,PS微塑料可能隨著魚的呼吸進入魚鰓,并被魚鰓截留. Lu等[18]研究中同樣發現,5 μm PS微塑料可以進入斑馬魚的魚鰓. 排出72 h后,通過熒光顯微鏡觀察腸道、魚鰓和魚體部分,結果發現,魚鰓〔見圖4(d)〕中PS微塑料已經完全排出,腸道〔見圖4(e)〕中微塑料仍有部分停留在腸道末端,這可能是由于排出階段未喂食,造成微塑料在腸道內的滯留. Cong等[28]研究中也有類似發現,在不喂食情況下,微塑料排出緩慢,喂食會加速微塑料的排出.
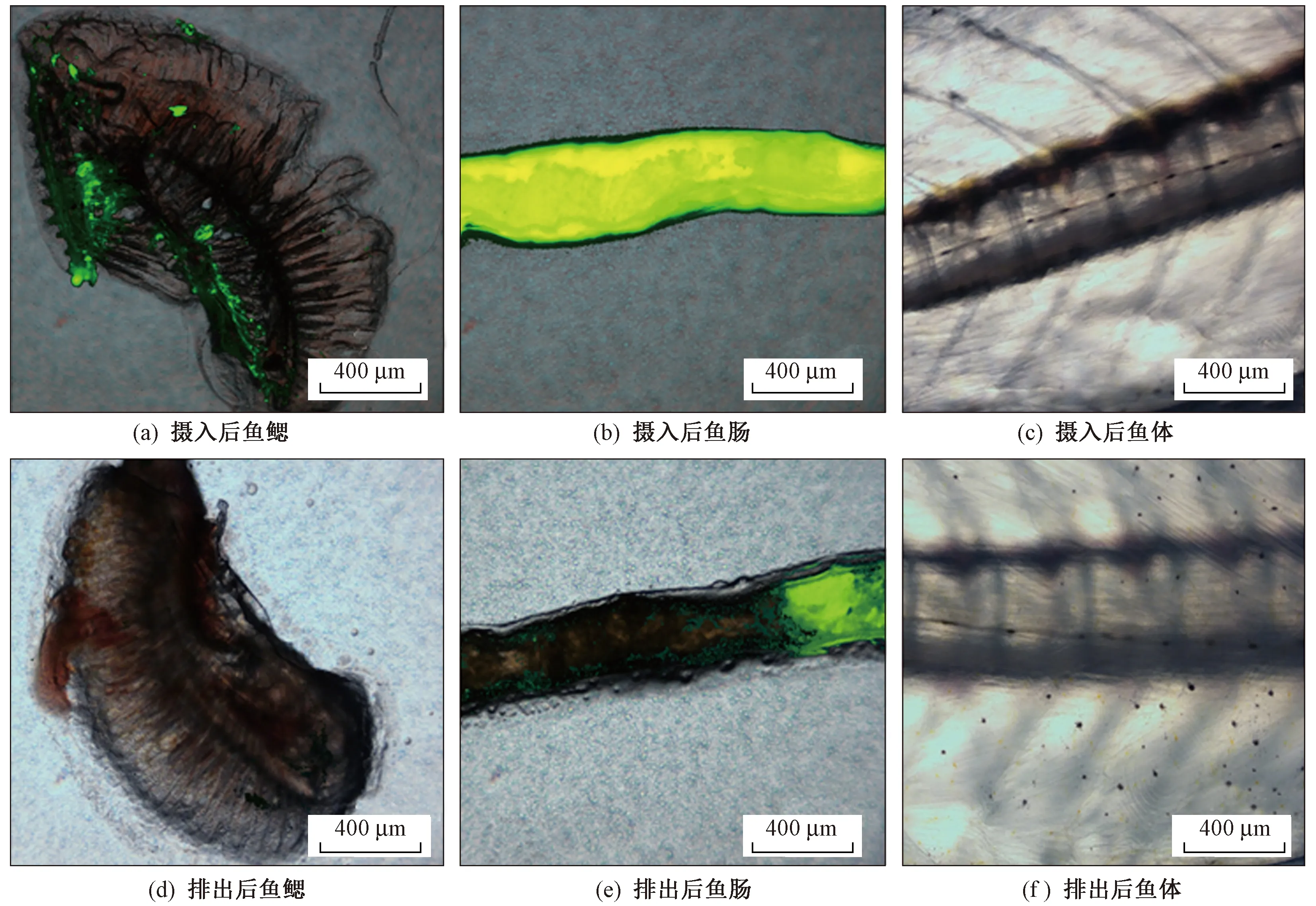
圖4 熒光顯微鏡下觀察海水青鳉攝入和排出后PS微塑料在魚鰓、腸道和魚體中的分布情況
將顯微鏡觀察后的海水青鳉不同組織進行消解并定量檢測,根據2.1節中的標準曲線進行定量,結果(見圖5)發現,攝食24 h后,PS微塑料在海水青鳉腸道內含量為(246.6±38.1)mg/g(以魚濕質量計),占總攝入量的99.9%,而魚鰓(占0.07%)和體表(占0.03%)含量較少. 經過72 h排出后,腸道內剩余PS微塑料的含量為(1.29±0.52)mg/g. 表明PS微塑料主要通過攝食活動進入魚體,并在腸道內大量富集,隨后PS微塑料隨糞便緩慢排出,但被海水青鳉成魚排出之后的PS微塑料是否會重新懸浮到水中或重新進入生物體有待開展更深入的研究.
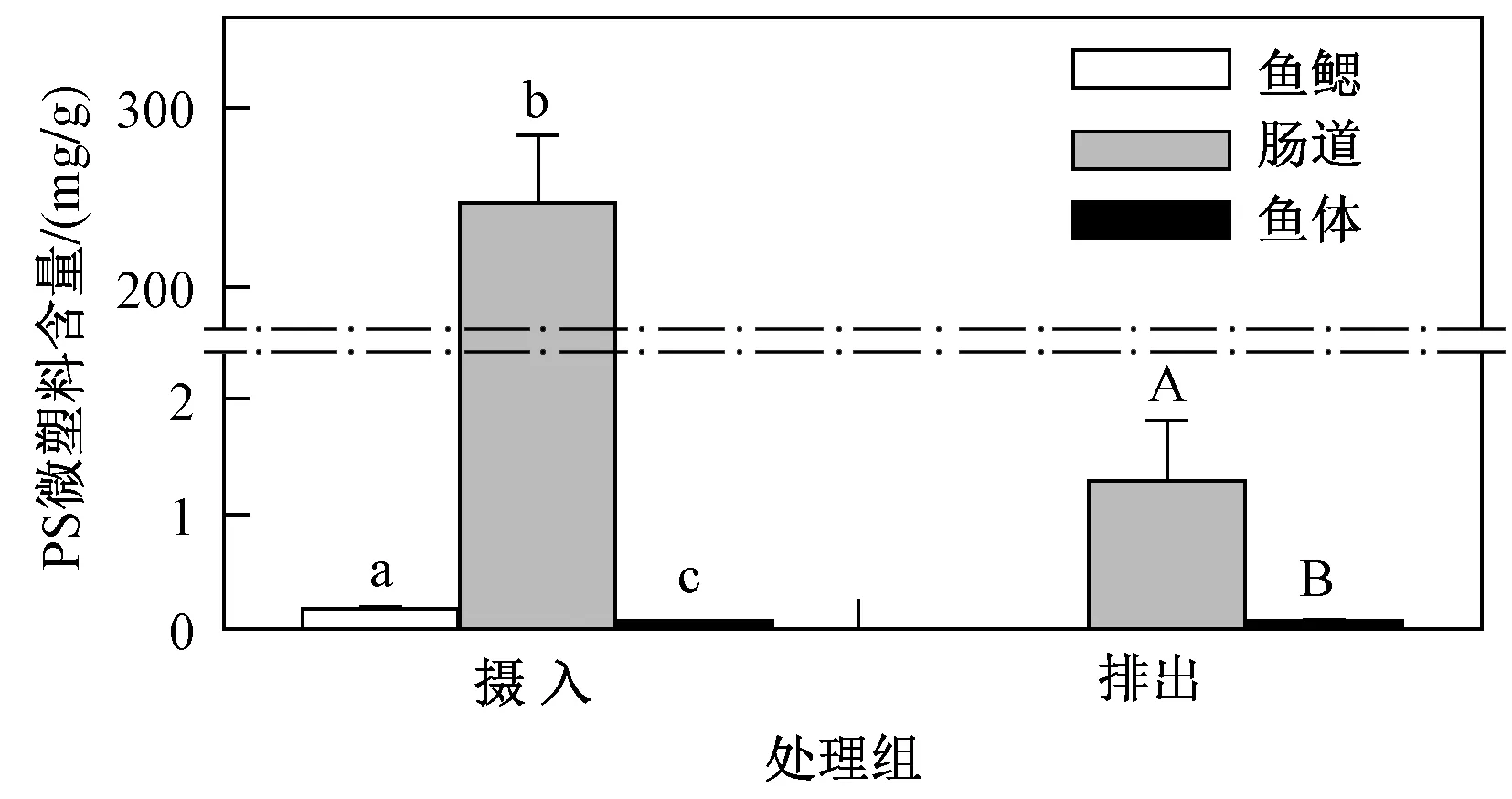
注: 不同小寫字母或大寫字母表示數據之間具有顯著性差異(P<0.05).
2.3 海水青鳉攝食對微塑料賦存形態的影響
生物攝食活動對微塑料環境行為的影響目前研究較少,該研究結果(見圖6)發現,初始加入時PS微塑料顆粒在海水中呈分散狀態〔見圖6(a)〕,但經過海水青鳉攝食,大部分PS微塑料變成糞便沉到水底〔見圖6(b)〕,說明生物攝食會改變PS微塑料在海水環境中的存在狀態. 選取一粒糞便通過熒光顯微鏡觀察,結果〔見圖6(c)〕發現糞便中有較強熒光信號,通過掃描電鏡放大觀察糞便內部,結果〔見圖6(d)〕顯示,PS微塑料以顆粒形式匯聚在糞便中,形貌無顯著變化,表明海水青鳉攝食可以改變PS微塑料的存在狀態但對其形貌無顯著影響. 由于密度的差異,微塑料在環境中存在狀態不同,密度較輕的微塑料一般會漂浮在水面或懸浮于水中,而經過生物攝食后會使漂浮的微塑料團聚而變重,發生沉降. Katija等[33]研究也發現巨型海鞘能夠通過攝食微塑料將其轉化為糞便包裹物,加速了微塑料從海水表層向深層的轉移,因此海洋微塑料的監測應該考慮對不同水層深度的采樣,以免造成微塑料含量的低估. 有研究發現PE(聚乙烯,polyethylene)微塑料經過南極蝦消化系統后可以破碎產生納米塑料[34],說明生物攝食行為可能增加環境中產生納米塑料的風險. 海水青鳉不斷攝食其周圍環境中懸浮態微塑料,將其轉化為糞便排出體外,但不會再次攝食以糞便形式存在的微塑料,因此海水青鳉的攝食是一種將懸浮分散的微塑料不斷轉化為團聚沉降的過程,這可能會影響微塑料的生物可利用性,但是否增加腐食性生物或底棲生物的暴露風險值得進一步探究.

圖6 微塑料在海水青鳉成魚攝食前后的狀態以及糞便的熒光信號表征和掃描電鏡形貌表征
3 結論
a) 該研究針對生物體內小粒徑微塑料定量示蹤的技術難題,提出熒光法和C-14同位素法,并對比了兩種方法在檢測限、靈敏度和定性定量等方面的差異. 對比發現熒光法可以直觀觀察微塑料,在研究生物體內的分布及高濃度暴露時的熒光定量方面較為適用,而C-14同位素法因具有更低的檢測限和高的靈敏度,在復雜介質中進行低濃度暴露時的定量檢測更具優勢.
b) 利用兩種示蹤技術研究海水青鳉成魚和仔魚對微塑料的攝食動力學和體內分布發現:成魚和仔魚攝入微塑料的量隨著培養時間而變化,均在24 h攝入較多微塑料,且成魚比仔魚具有更高的攝食能力;微塑料在海水青鳉的腸道分布極多,遠大于魚鰓與體表,表明攝食是微塑料進入海水青鳉的主要途徑,且在不喂食情況下排出72 h后,腸道內仍殘留相當一部分微塑料無法排出.
c) 值得注意的是,雖然魚類攝食微塑料后很難真正進入內循環系統,但其攝入、消化、排出過程在很大程度上改變了微塑料尤其是小粒徑微塑料的環境賦存形態. 海水青鳉通過對水中懸浮狀態微塑料的攝入,將海水中的微塑料由初始懸浮分散態變成糞便團聚體沉入水底,攝食行為對微塑料形貌雖無顯著影響,但可能會對微塑料的環境過程和生態效應產生未知影響.

