鹽生草根際耐鹽性木霉菌分離鑒定及其耐鹽性評價
謝佳麗,李 寶,劉 佳,張樹武,徐秉良
(甘肅農業大學植物保護學院 / 甘肅省農作物病蟲害生物防治工程實驗室,甘肅 蘭州 730070)
近年來,由于人們對自然資源的過度開發以及對環境資源的巨大破壞導致土壤質量嚴重下降,鹽漬化問題已成為影響地球上有限土地資源的重要問題所在[1]。據報道,全世界超過20% 栽培地和50%灌溉地已受到鹽漬化的威脅[2]。同時,土壤鹽漬化已成為制約農業發展的關鍵要素,限制農作物的生產,造成嚴重的產量和經濟損失[3-4]。謝文軍等[5]研究表明,當土壤中含鹽量超過3.5 g·kg?1時會大幅降低小麥(Triticum aestivum)的產量。Ghoulam 等[6]研究表明,鹽堿地中Na+和Cl?對植物的毒害作用極大,可破壞氧化還原平衡,產生大量毒性物質,最終對植物細胞造成毒害。高鹽堿可使土壤腐殖質嚴重淋失,土壤通氣透水性下降,很容易造成植物萎蔫、中毒和爛根死亡等現象,影響作物的產量和品質[7]。楊志瑩等[8]研究表明鹽脅迫可導致玫瑰(Rosa rugosa)細胞膜遭到破壞和影響其正常生理功能,進而抑制玫瑰的生長和降低其生物量。因此,對于鹽堿地的改良和防治已成為農業和社會經濟可持續發展的重要內容[9]。但目前土壤鹽堿化改良依然利用傳統的化學手段、農業措施和水利工程等措施[10-12],而化學修復會帶來環境污染,農業措施和水利工程則存在見效慢和成本高等缺點。因此,利用耐鹽微生物解決土壤鹽漬化問題是當前國內外研究的重點和熱點之一。
木霉菌(Trichodermaspp.) 屬于無性態,絲孢綱絲孢目木霉菌屬[13]的一類分布較為廣泛、適應能力極強的土壤習居性真菌,其對多種植物病原菌具有較好的拮抗作用,以及對相應病害具有較好的防治作用,在生物防治領域受到廣泛青睞[14-15]。研究表明在鹽脅迫條件下,植物可以通過合成有機小分子來降低細胞水勢,從外界環境中吸收水分[16],清除活性氧自由基,使其免受鹽脅迫的危害[17]。另外,張樹武等[18]研究發現長枝木霉(T. longibrachiatum)T6 菌株具有較強的耐鹽活性,其可在鹽脅迫條件下促進小麥幼苗的生長,但是有關鹽生草(Halogetonarachnoideus)根際土壤中耐鹽木霉菌的分離鑒定及其耐鹽性評價等方面尚未見報道。
為此,通過對鹽生草根際鹽堿土中木霉菌的分離,并結合形態學和分子生物學鑒定,以及對其耐鹽性的評價,旨在篩選出耐鹽性較強的木霉菌株,誘導植物產生抗性并降低鹽害對植物的影響,有效緩解土壤鹽漬化的影響[19]。研究結果將為木霉菌應用于土壤鹽堿化治理提供一定的理論依據。
1 材料與方法
1.1 試驗材料
1.1.1 根際鹽堿土采集
供試鹽生草根際鹽堿土采自甘肅省武威市民勤縣。當地氣候條件干旱炎熱,多為氯化物鹽土,1 m 土層含鹽量可達0.4%~1.39%,土壤pH 為6.5,植物種類稀少且植被稀疏,主要以梭梭草(Cyperus rotundus)為主。采集土樣時去除鹽生草根際土壤表面干土,收集0 - 20 cm 土層土壤,帶回實驗室后室溫風干,然后過0.23 mm 篩,獲得的土樣用于后續試驗。
1.1.2 供試化學藥品
NaCl 分析純AR (無色晶體)購自國藥集團化學試劑有限公司。
1.2 試驗方法
1.2.1 根際鹽堿土土壤稀釋液配制
稱取待測鹽堿土樣10 g 于150 mL 錐形瓶中,加入10 個玻璃珠和90 mL 無菌水后放到25 ℃搖床中,設置轉速為130~160 r·min?1,然后將其振蕩1.5~2.5 h,使土壤中的菌物均勻地散落在液體中,然后靜置20~30 min,所得土壤稀釋液為10 倍稀釋液,并利用無菌水依次稀釋為不同稀釋倍數的土壤懸浮液(100 和1 000 倍液)。
1.2.2 根際鹽堿土稀釋液中木霉菌的分離
采用平板分離法進行鹽生草根際鹽堿土中木霉菌的分離。將配制好的不同濃度土壤稀釋液依次吸取200 μL 均勻涂布到馬鈴薯葡萄糖瓊脂(potato dextrose agar, PDA)培養基上,于超凈工作臺上風干150~200 s 后置于25 ℃ (16 h·d?1)光照條件的恒溫培養箱內培養,每個處理重復6 次。培養3 d后分別記錄每個培養基中木霉菌的菌落數量并觀察其菌落形態。
1.2.3 根際鹽堿土稀釋液中木霉菌的純化培養
培養3 d 后,挑選菌落形態類似于木霉菌的菌株接種至PDA 培養基上,對木霉菌進行純化,每個菌株接種6 皿。待木霉菌產孢后重復上述步驟,直到菌株純化,并每隔24 h 記錄1 次菌落形態特征,持續觀察7 d 后轉接至凍存管中進行保存備用。
1.2.4 根際鹽堿土中木霉菌的分離及篩選
利用含鹽培養基模擬鹽堿土條件,配制800 mmol·L?1NaCl 的PDA 培養基來篩選耐鹽性較強的木霉菌,以不含鹽的空白PDA 培養基為對照。待培養基冷卻凝固后,中央接種純化的木霉菌株菌餅(d = 5 mm),并置于25 ℃ (16 h·d?1)光照條件的恒溫培養箱內培養。待培養3 d 后,采用“十字交叉法”測量菌落直徑,試驗過程中所有處理和對照均重復3 次。
1.2.5 根際分離木霉菌鑒定
采用形態學和分子生物學相結合的方法鑒定耐鹽性較強的木霉菌株。
1) 形態學鑒定:參考Samuels[20]木霉菌分類方法進行形態學鑒定。具體方法為,將篩選獲得的耐鹽性較強的木霉菌株接種于PDA 平板上,于25 ℃下連續培養3 d,待剛剛產生綠色孢子時,觀察其菌落的形態、顏色,并于顯微鏡下觀察和記錄菌絲、分生孢子梗、分生孢子大小及形態特征。
2) 分子生物學鑒定:參考李琳等[21]CTAB (cetyltrimethylammonium ammonium bromide)法提取耐鹽性較強的木霉菌株DNA。將提取的DNA 進行瓊脂糖凝膠電泳檢測,并通過Nano PhotometerTM Pearl 紫外分光光度計對所提取的DNA 濃度進行測定,分裝后置于-80 ℃超低溫冰箱中保存備用。利用引物ITS-F/ITS-R 擴增ITS 片段,使用引物TEF-F/TEF-R 擴增TEF 片段。所有引物由上海生物技術有限公司合成(表1)。

表1 引物名稱及序列Table 1 Primer names and sequences
3) ITS 和 TEF 片段擴增反應。ITS 序列:PCR 反應 體 系 為2 × Taq PCR MasterMixⅡ 12.5 μL、DNA 3 μL、RNase-Free ddH2O 7.5 μL、上下游引物各1 μL(ITS1-F 和ITS4-R),反應總體系25 μL。PCR 擴增條件為95 ℃預變性5 min、95 ℃變性30 s、55 ℃退火30 s、72 ℃延伸1 min,共30 個循環,最后72 ℃延伸7 min,擴增產物經1%瓊脂糖凝膠電泳檢測。
TEF 序 列:PCR 反 應 體 系 為2 × Taq PCR MasterMixⅡ 10 μL、DNA 1 μL、RNase-Free ddH2O 7 μL、上下游引物各1 μL (TEF-F 和TEF-R),反應總體系20 μL。PCR 擴增條件為97 ℃預變性3 min、96 ℃變性30 s、55 ℃退火1 min、72 ℃延伸1 min,循環重復35 次,最后在72 ℃下延伸10 min,擴增得到的產物再經過1%瓊脂糖凝膠電泳進行檢測。
4) 序列分析及系統進化樹構建:將測序后獲得的T-ITS 和T-TEF 序列分別提交到NCBI 網站上,并利用Blast 1.83 X 軟件進行序列比對。然后根據NCBI 數據庫中木霉菌株的ITS 和TEF 序列信息,利用MEGA5 軟件進行多重序列比較,并采用鄰接法構建系統進化樹(Bootstrap = 500)進行菌株分子生物學鑒定。
1.2.6 木霉菌耐鹽性評價
利用含鹽培養基模擬鹽堿土條件,參考趙忠娟等[22]報道的關于木霉菌耐鹽活性的鑒定方法,制作含鹽量分別為100、200、400、600 和800 mmol·L?1的PDA 培養基進行木霉菌耐鹽性評價,對照為不含鹽的空白PDA 培養基。待培養基冷卻凝固后,中央接種耐鹽性較強的木霉菌株菌餅(d = 5 mm),置于25 ℃ (16 h·d?1)光照條件的恒溫培養箱內培養。采用“十字交叉法”測量菌落直徑并觀察其形態,并于培養第3 天時使用血球計數板測定其產孢量。試驗過程中所有處理和對照均重復3 次。
2 結果與分析
2.1 根際鹽堿土中木霉菌的分離及篩選
經分離純化共獲得4 株木霉菌株,分別命名為T-A、T-B、T-C 和T-D,且在鹽濃度為800 mmol·L?1時,菌株T-B 的耐鹽性最強。T-A、T-B、T-C 和T-D相對生長速率分別為18.72、22.72、17.44 和22.44 mm·d?1。
2.2 木霉T-B 菌株形態學鑒定
木霉T-B 菌株在PDA 培養基上培養4 d 時生長較快,基本覆蓋整個培養皿并產生大量孢子,菌落正面形態呈現放射狀向四周生長,邊緣大量分布著白色的菌絲,中央區域可以產生大量分生孢子;菌落背面在培養初期為白色,在后期為淡黃色(圖1A和圖1B)。分生孢子梗的分枝情況大多為輪生,很少有單生,分枝幾乎接近直角。瓶梗主要為單生,呈燒瓶形,中部略微膨大,頂部和基部出現了稍微溢縮的現象(圖1C),分生孢子呈無色,為橢圓形或卵圓形(圖1D)。結合上述所有形態特征,依據《木霉分類與鑒定》[23]對其進行鑒定,初步將木霉T-B菌株確定為長枝木霉菌。
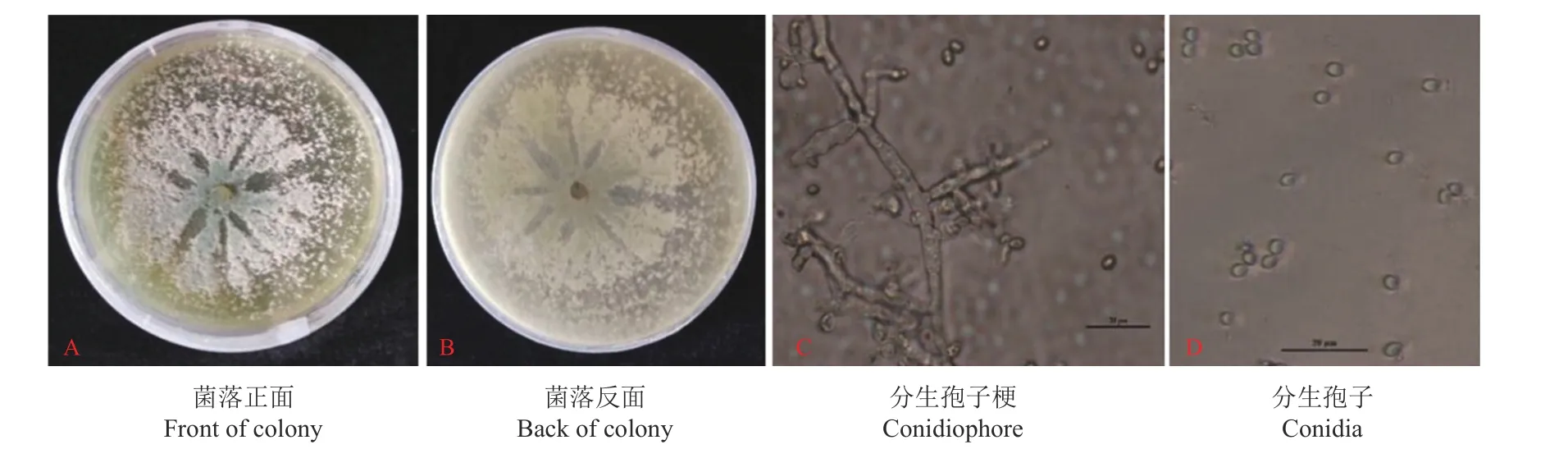
圖1 木霉菌株T-B 的形態特征Figure 1 Morphological characteristics of Trichoderma strain T-B
2.3 木霉T-B 菌株分子生物學鑒定
利用通用引物ITS-1 和ITS-4 以及特異性引物TEF-R 和TEF-F 分別對分離得到的木霉菌進行ITS 和TEF 基因序列的擴增,擴增得到的條帶分別約為600 和300 bp (圖2),并將PCR 擴增獲得的T-ITS 和T-TEF 產物經測序后得到的序列分別提交到NCBI 網站,利用Blast1.83 X 軟件進行序列比對,利用MEGA5 軟件進行多重序列比較,并采用鄰接法構建系統進化樹(Bootstrap = 500)進行菌株分子生物學鑒定,并結合形態學特征初步將木霉T-B 菌株鑒定為長枝木霉(圖3A 和圖3B),其與長枝木霉的相似度為99.18%。
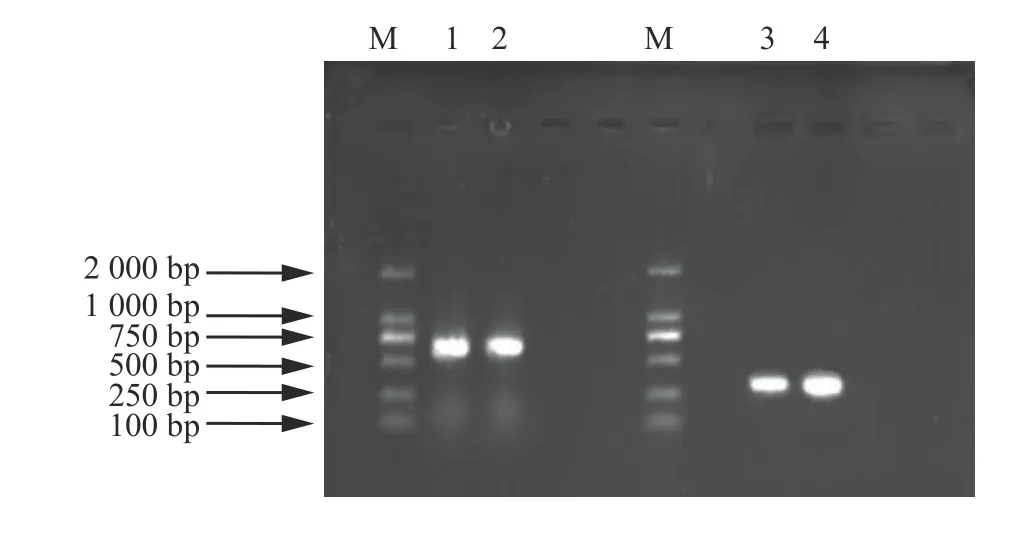
圖2 ITS 和TEF 擴增序列的凝膠電泳圖Figure 2 Gel electrophoresis diagram of ITS and TEF amplified sequences

圖3 木霉T-B 菌株ITS 和TEF 系統發育樹Figure 3 ITS and TEF phylogenetic tree of Trichoderma T-B strain
2.4 長枝木霉耐鹽性評價
不同濃度NaCl 處理對長枝木霉菌的生長和產孢量具有不同程度的影響。隨著NaCl 溶液濃度升高,長枝木霉菌的生長速率呈降低趨勢,且隨著培養時間增加,不同濃度NaCl 溶液對其生長的影響效果呈降低趨勢。與對照相比(圖4ⅠA和圖4ⅡG),當NaCl 溶 液 濃 度 為100 mmol·L?1時(圖4ⅠB 和圖4ⅡH),在培養時間段內(3~7 d)長枝木霉菌的菌落直徑與對照無顯著差異(P> 0.05) (表2)。當NaCl溶液濃度為200 mmol·L?1時,在培養時間段內(3~4 d) (圖4ⅠC 和圖4ⅡI),長枝木霉菌的菌落直徑與對照無顯著差異(P> 0.05) (表2)。當NaCl 溶液濃度為400 mmol·L?1時(圖4ⅠD 和圖4ⅡJ),在培養3~5 d時長枝木霉菌的菌落直徑與對照差異顯著(P< 0.05),較對照菌落直徑有所降低,但是在培養6~7 d 時,其菌落直徑與對照相比無顯著差異(P> 0.05),表現出較強的耐鹽性(表2)。當NaCl 溶液濃度為600 和800 mmol·L?1時(圖4ⅠE、ⅠF、ⅡK 和ⅡL),在培養時間段內(3~7 d)長枝木霉菌的菌落直徑與對照相比有所降低,且存在顯著差異(P< 0.05) (表2)。同時,與對照相比,當NaCl 溶液濃度為100 mmol·L?1時,在培養7 d 時長枝木霉菌的產孢量顯著高于對照(P< 0.05),較對照增加9.17% (表2)。然而,當NaCl溶液濃度大于100 mmol·L?1時,在培養7 d 時長枝木霉菌的產孢量顯著低于對照(P< 0.05) (表2)。
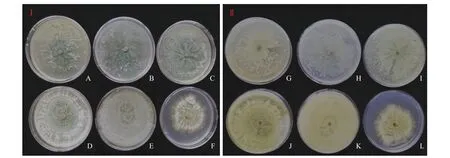
圖4 不同濃度NaCl 溶液對長枝木霉菌落生長的影響Figure 4 Effect of NaCl solution at different concentrations on the growth of Trichoderma longibrachiatum
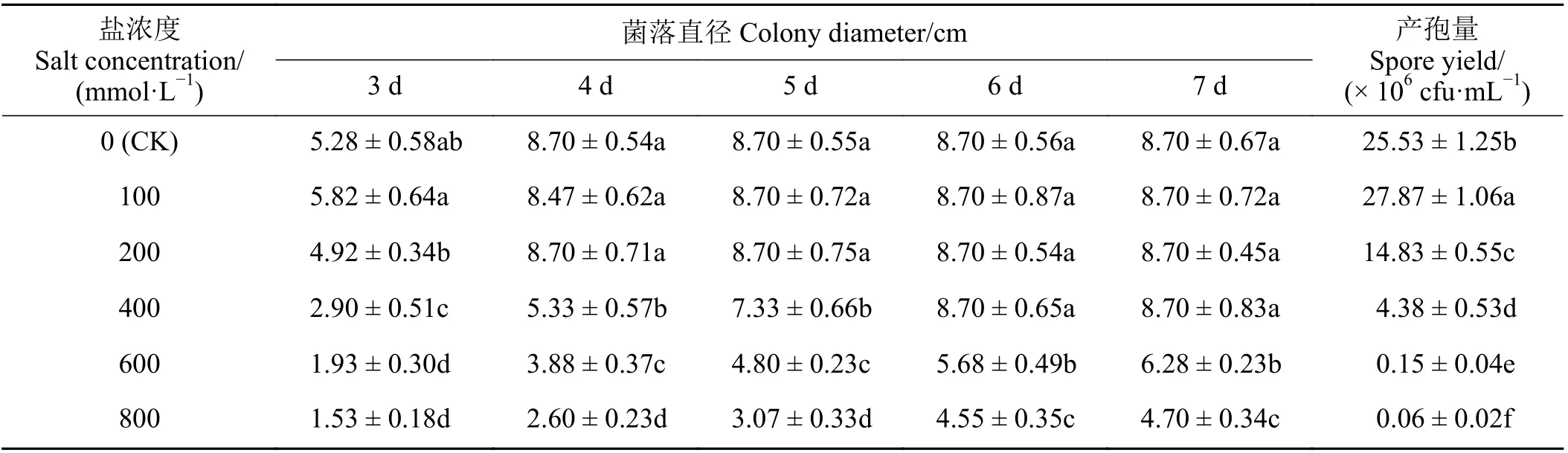
表2 不同濃度NaCl 溶液對木霉T-B 菌株生長的影響Table 2 Effect of NaCl solution at different concentrations on the growth of Trichoderma T-B strain
3 討論與結論
木霉菌是一類非常重要的多功能有益微生物,不僅具有抗菌殺線的作用,而且具有改良土壤環境和促進植物生長的作用[24]。Zhang 等[25]研究表明長枝木霉T6 菌株具備較強的耐鹽能力,并且其在鹽脅迫下對小麥的生長具有較好的促生作用。趙忠娟等[22]研究表明哈茨木霉(Tricoderma harzianum)和深綠木霉(T. viride)在高鹽脅迫下菌絲生長量可達到50%。本研究結果表明,從鹽生草根際土壤中分離獲得一株具有較好耐鹽活性的長枝木霉T-B 菌株,于培養第3 天時,在鹽濃度為100 mmol·L?1時其生長良好,不僅菌絲生長速度較快,而且能產生大量孢子;當NaCl 溶液濃度為800 mmol·L?1時,篩選出的耐鹽木霉菌株T-B 菌絲生長量在50%以上,具有較強的耐鹽性,為后續研究高耐鹽性木霉菌株對鹽漬化土壤的修復能力奠定了基礎。
Cuppers 等[26]研究表明,低鹽有助于促進孢子的產生,在低鹽時表現出較強的耐鹽性,但高鹽對木霉菌的抑制作用較強。本研究結果發現,當NaCl溶液濃度為100 mmol·L?1時,在培養時間段(3~7 d)內長枝木霉菌的生長速率與對照相比無顯著差異,并且其產孢量顯著高于對照,表明低鹽狀態下木霉菌的生長不僅不會受到限制,反而會促進其產孢,但是隨著NaCl 溶液濃度的升高,NaCl 溶液對長枝木霉菌的生長具有不同程度的抑制作用,其產孢量隨著鹽濃度增加呈現明顯的降低趨勢,表明高鹽狀態下木霉菌菌絲生長以及產孢均受到限制,與前期的研究結果一致。
因此,本研究分離鑒定獲得一株具有較強耐鹽性的長枝木霉菌株,并發現其在低鹽濃度處理下具有較好的耐鹽活性,但是有關其耐鹽作用機制及其對作物的解鹽促生作用還有待進一步研究。

