藏紅花素對氯化鋰-匹羅卡品致癇大鼠的腦保護作用及機制研究*
江冉冉,王莉平,李曉東,閆 樺
(1.冀中能源峰峰集團有限公司總醫院,河北 邯鄲 056200;2.邯鄲市中心醫院,河北 邯鄲 056001)
癲癇(epilepsy,EP)是一種因大腦神經元同步異常放電而引發的腦功能障礙綜合征,我國EP發病率均7‰,是僅次于腦卒中的第二大神經系統疾病,嚴重危害著人類的生命健康。EP發作是神經元過度興奮和自由基堆積的過程,發作時間超過30 min即可造成大腦神經元損傷或喪失,其中海馬神經元最為敏感。有研究發現,氧化應激和炎癥反應在EP所致腦損傷過程中發揮著重要作用[1-2],而內質網應激是機體調控氧化應激和炎癥反應的關鍵通路[3-4]。藏紅花素(又名西紅花苷)為中藥藏紅花的主要活性成分,具有良好的抗氧化、抗炎活性[5-6]。有研究發現藏紅花素能夠通過抑制氧化應激和炎癥反應對缺血性腦損傷起到保護作用[7],但藏紅花素對EP所致腦組織損傷及內質網應激通路的影響尚未見文獻報道。本實驗通過制備EP大鼠模型,研究藏紅花素對氯化鋰-匹羅卡品(Li-Pc)所致EP大鼠腦組織的保護作用及其機制,現將研究結果報告如下。
1 材料與方法
1.1 實驗動物8周齡SPF級健康雄性SD大鼠120只,體質量230~250 g,購自河北省實驗動物中心,生產許可證號:SCXK(冀)2018-004。飼養于邯鄲康業制藥有限公司,使用許可證號:SCXK(冀)2019-003。適應性飼養7 d后開展實驗,飼養條件:光照黑暗各12 h交替,室溫23~25℃,相對濕度55%~65%。本實驗方案經冀中能源峰峰集團有限公司總醫院倫理委員會批準,倫理批件號:FFZY[K]字2019-028。
1.2 藥物與試劑 藏紅花素(美國Sigma公司,純度≥98%,批號:17304-1G);注射用丙戊酸鈉(VPA,四川科瑞德制藥股份有限公司,批號:20190826);MDA檢測試劑盒(批號:191107)、SOD檢測試劑盒(批號:190830)、CAT檢測試劑盒(批號:191214)(南京建成生物工程研究所);TNF-α試劑盒(貨號:SEKR-0009)、IL-1β試劑盒(貨號:SEKR-0002)、IL-6試劑盒(貨號:SEKR-0005)(北京索萊寶生物技術有限公司);調節蛋白78(GRP78,貨號:bs-1219R)、增強子結合蛋白同源蛋白(CHOP,貨號:bs-1630R)、激活型半胱氨酸蛋白酶-12(Cleved Caspase-12,貨號:bs-1105R)、B細胞淋巴瘤基因-2(bcl-2,貨號:bs-20352R)、bcl-2相關X蛋白(Bax,貨號:bsm-52316R)、核因子-κB(NF-κB,貨號:bs-0465R)、β-actin(貨號:bs-0061R)(北京博奧森生物技術有限公司)。
1.3 主要儀器RM2125型石蠟切片機(德國Leica公司);CKX31型倒置光學顯微鏡(日本Olympus公司);UV762型紫外-可見分光光度計(上海楚定分析儀器有限公司);Synergy-HT型多功能酶標儀(美國BioTck公司);SE300型電泳儀、TE22型轉膜儀(美國Hoefer公司);EC3 410型化學發光成像系統(美國UVPN公司)。
1.4 分組與造模 將120只大鼠按照隨機數字表法分為正常對照組,模型組,丙戊酸鈉組和藏紅花素低、中、高劑量組,每組20只。除正常對照組外,其余各組均采用氯化鋰-匹羅卡品(Li-Pc)化學點燃法制備EP大鼠模型[8]:以127 mg/kg劑量腹腔注射Li溶液,20 h后以15 mg/kg劑量背部皮下注射Pc溶液;空白對照組各步驟均同步給予0.9%氯化鈉溶液。造模成功判斷標準[9]:按照Racine分級標準對EP發作進行分級(見“1.6.1”),連續出現5次4~5級EP發作即認定為造模成功。
1.5 實驗給藥 各組大鼠均于注射Pc前30 min腹腔注射給藥1次,丙戊酸鈉組腹腔注射給予濃度60 mg/mL的丙戊酸鈉溶液(注射劑量5 mL/kg)[10],藏紅花素低、中、高劑量組分別腹腔注射濃度1、2、4 mg/mL的藏紅花素(注射劑量5 mL/kg)[11],模型組和正常對照組同步腹腔注射給予0.9%氯化鈉溶液(注射劑量5 mL/kg)。
1.6 觀察指標
1.6.1 EP發作程度分級Pc注射后2 h,對照Racine分級標準對EP發作進行分級[9]:無發作為0級;口周及面部肌肉抽搐為1級;點頭或頻繁抖動為2級;前肢局限性陣攣為3級;前肢局限性陣攣伴后肢站立的全身強直性發作為4級;前肢局限性陣攣伴有站立并摔倒、翻滾的全身強直陣攣發作為5級。
1.6.2 HE染色法行大腦海馬組織病理學檢查Pc注射24 h后,分別隨機取各組大鼠10只,腹腔注射10%水合氯醛溶液(3 mL/kg)實施麻醉,脊椎脫臼處死,斷頭取腦,去除小腦、腦干后置于4%多聚甲醛溶液固定72 h,石蠟包埋、5μm厚度切片、梯度乙醇脫蠟和二甲苯透明,然后行HE染色,通過光學顯微鏡觀察各組大鼠海馬組織病理學改變。
1.6.3 TUNEL法觀察海馬神經元凋亡水平 取腦組織石蠟切片,經梯度乙醇脫蠟和二甲苯透明后,按照TUNEL試劑盒操作說明進行染色處理,封片后通過光學顯微鏡觀察各組大鼠海馬神經元凋亡狀態;凋亡指數(Apoptosis Index,AI)計算:每只大鼠選取同部位5張染色切片,每張切片選取5個不重疊視野計數凋亡細胞數和細胞總數,取平均值,AI(%)=(凋亡細胞數/細胞總數)×100%。
1.6.4 海馬組織生化制備檢測Pc注射24 h后,分別取各組剩余的10只大鼠,麻醉后脊椎脫臼處死,在冰上斷頭取腦并剝取海馬組織,加入適量4℃裂解液后研磨勻漿,4℃、3 000 r/min離心(離心半徑10 cm)10 min取上清液,然后遵照試劑盒操作方法進行處理后,通過紫外-可見分光光度計檢測各組大鼠海馬組織MDA含量和SOD、CAT活力,通過酶標儀檢測TNF-α、IL-1β、IL-6含量。
1.6.5 Western blotting法檢測海馬組織蛋白表達 取海馬組織勻漿液,4℃、12 000 r/min離心(離心半徑10 cm)25 min取沉淀,通過BCA法檢測蛋白總濃度后95℃水浴使蛋白變性,30μg蛋白量上樣、SDS-PAGE膠電泳、濕法轉PVDF膜、5%脫脂奶粉37℃封閉1 h后,滴加目標蛋白和β-actin一抗后4℃孵育過夜,洗膜后滴加IgG二抗室溫孵育1 h,洗膜后滴加DAB顯色,以β-actin為內參半定量目標蛋白表達,檢測海馬組織糖調節蛋白78(GRP78)、增強子結合蛋白同源蛋白(CHOP)、激活型半胱氨酸蛋白酶-12(Cleved Caspase-12)、B細胞淋巴瘤基因-2(Bcl-2)、Bcl-2相關X蛋白(Bax)、核因子-κB(NF-κB)蛋白表達情況。
1.7 統計學方法 采用SPSS 25.0進行統計分析,計量資料以(±s)表示,多組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗;EP發作等級比較采用Kruskal-Wallis H檢驗,兩兩比較采用Nemenyi法檢驗;P〈0.05為差異有統計學意義。
2 結 果
2.1 各組大鼠EP發作等級比較 正常對照組大鼠未見EP發作;模型組大鼠EP發作等級明顯高于正常對照組(P〈0.01);丙戊酸鈉組和藏紅花素中、高劑量組大鼠EP發作等級明顯低于模型組(P〈0.01);藏紅花素低劑量組大鼠EP發作等級與模型組比較,差異無統計學意義(P〉0.05);藏紅花素高劑量組EP發作等級明顯低于丙戊酸鈉組(P〈0.01)。(見表1)

表1 各組大鼠EP發作等級比較
2.2 各組大鼠大腦海馬組織病理學改變情況 正常對照組大鼠大腦海馬神經元呈圓形或橢圓形,排列整齊,核膜、核仁邊界清晰;模型組大鼠海馬神經元可見形態不規則、排列紊亂、層次不清,核膜不清,核仁固縮、偏移、深染等病理學形態結構改變;與模型組比較,丙戊酸鈉組和藏紅花素低、中、高劑量組大鼠海馬神經元病變呈不同程度減輕;藏紅花素高劑量組大鼠大腦海馬神經元形態較規則、排列較整齊、核膜核仁邊界清晰,效果優于藏紅花素低、中劑量組。(見圖1)
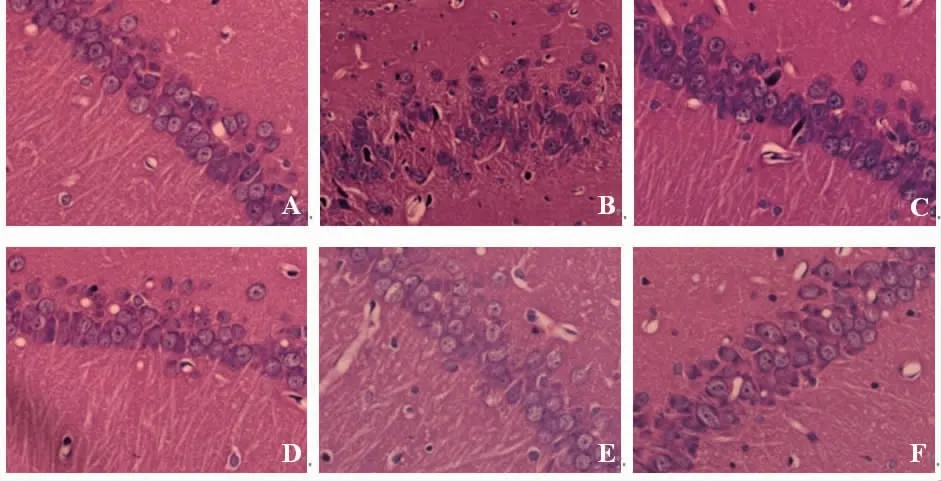
圖1 各組大鼠大腦海馬組織病理學改變比較(HE,×400)
2.3 各組大鼠海馬神經元凋亡情況比較 與正常對照組比較,模型組大鼠海馬神經元凋亡數量明顯增多;與模型組比較,丙戊酸鈉組和藏紅花素中、高劑量組大鼠海馬神經元凋亡數量明顯減少;藏紅花素低劑量組大鼠海馬神經元凋亡數量與模型組比較,未見明顯變化;與丙戊酸鈉組比較,藏紅花素高劑量組大鼠海馬神經元凋亡數量明顯減少。(見圖2)
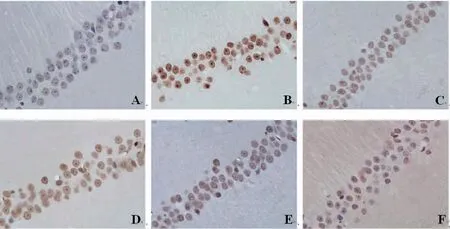
圖2 各組大鼠海馬神經元凋亡情況(TUNEL,×400)
與正常對照組比較,模型組大鼠海馬神經元AI明顯升高(P〈0.01);與模型組比較,丙戊酸鈉組和藏紅花素中、高劑量組大鼠海馬神經元AI明顯降低(P〈0.01);藏紅花素低劑量組大鼠海馬神經元AI與模型組比較,差異無統計學意義(P〉0.05);與丙戊酸鈉組比較,藏紅花素高劑量組AI明顯降低(P〈0.01)。(見表2)
表2 各組大鼠海馬神經元AI比較(±s)
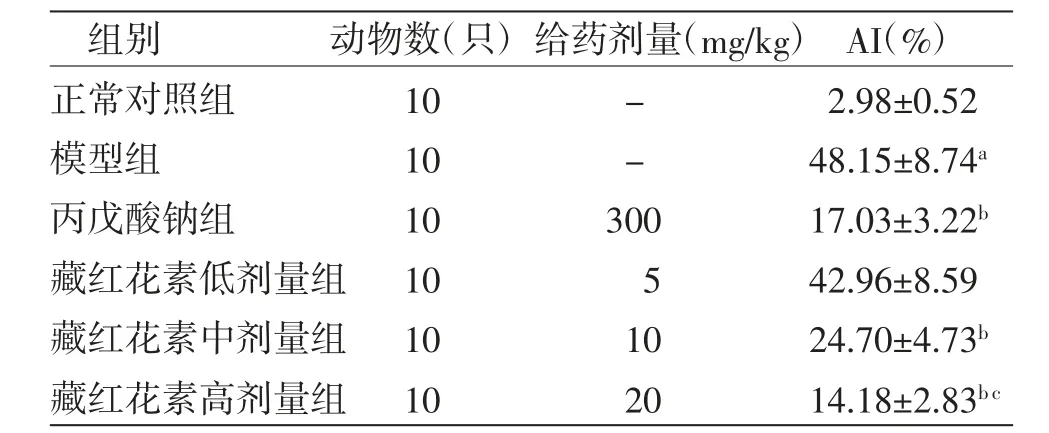
表2 各組大鼠海馬神經元AI比較(±s)
注:與正常對照組比較,aP〈0.01;與模型組比較,bP〈0.01;與丙戊酸鈉組比較,cP〈0.01
組別 動物數(只)給藥劑量(mg/kg)AI(%)正常對照組 10 - 2.98±0.52模型組 10 - 48.15±8.74a丙戊酸鈉組 10 300 17.03±3.22b藏紅花素低劑量組 10 5 42.96±8.59藏紅花素中劑量組 10 10 24.70±4.73b藏紅花素高劑量組 10 20 14.18±2.83b c
2.4 各組大鼠海馬組織SOD、CAT活力和MDA含量比較 與正常對照組比較,模型組大鼠海馬組織SOD、CAT活力降低,MDA含量升高(P〈0.01);與模型組比較,丙戊酸鈉組和藏紅花素中、高劑量組大鼠海馬組織SOD、CAT活力升高,MDA含量降低(P〈0.05或P〈0.01);藏紅花素低劑量組大鼠海馬組織SOD、CAT活力和MDA含量與模型組比較,差異均無統計學意義(P〉0.05);與丙戊酸鈉組比較,藏紅花素高劑量組大鼠海馬組織SOD活力升高,MDA含量降低(P〈0.05或P〈0.01)。(見表3)
表3 各組大鼠海馬組織SOD、CAT活力和MDA含量比較(±s)

表3 各組大鼠海馬組織SOD、CAT活力和MDA含量比較(±s)
注:與正常對照組比較,aP〈0.01;與模型組比較,bP〈0.05,cP〈0.01;與丙戊酸鈉組比較,dP〈0.05,eP〈0.01
組別 動物數(只)給藥劑量(mg/kg)SOD(U/mg)CAT(U/mg)MDA(nmol/mg)正常對照組 10 - 2.73±0.35 55.31±6.59 7.24±1.46模型組 10 - 1.38±0.16a 44.87±4.62a 28.05±3.92a丙戊酸鈉組 10 300 1.80±0.22c 50.15±5.40b 16.39±3.07c藏紅花素低劑量組10 5 1.46±0.18 46.79±5.03 24.87±3.83藏紅花素中劑量組10 10 1.91±0.24c 49.86±5.24b 20.16±3.17c藏紅花素高劑量組10 20 2.36±0.30c e 52.37±5.86c 13.45±2.44c d
2.5 各組大鼠海馬組織TNF-α、IL-1β、IL-6含量比較 模型組大鼠海馬組織TNF-α、IL-1β、IL-6含量明顯高于正常對照組(P〈0.01);丙戊酸鈉組和藏紅花素中、高劑量組大鼠海馬組織TNF-α、IL-1β、IL-6含量明顯低于模型組(P〈0.01);藏紅花素低劑量組大鼠海馬組織TNF-α、IL-1β、IL-6含量與模型組比較,差異均無統計學意義(P〉0.05);藏紅花素高劑量組大鼠海馬組織TNF-α、IL-6含量明顯低于丙戊酸鈉組(P〈0.01)。(見表4)
表4 各組大鼠海馬組織TNF-α、IL-1β、IL-6含量比較(±s,pg/mL)

表4 各組大鼠海馬組織TNF-α、IL-1β、IL-6含量比較(±s,pg/mL)
注:與正常對照組比較,aP〈0.01;與模型組比較,bP〈0.01;與丙戊酸鈉組比較,cP〈0.01
組別 動物數(只)給藥劑量(mg/kg)TNF-α IL-1β IL-6空白對照組 10 - 502.73±54.16 28.13±3.77 42.96±5.31模型組 10 - 1 142.35±128.40a 50.26±5.94a 99.05±10.72a丙戊酸鈉組 10 300 680.17±83.26b 37.02±4.03b 59.17±5.73b藏紅花素低劑量組10 5 1 039.52±131.08 46.14±5.52 91.42±9.86藏紅花素中劑量組10 10 804.15±98.42b 40.32±4.79b 68.04±7.53b藏紅花素高劑量組10 20 495.22±57.49b c 34.27±4.11b 51.16±4.60b c
2.6 各組大鼠海馬組織GRP78、CHOP蛋白表達比較 與正常對照組比較,模型組大鼠海馬組織GRP78、CHOP蛋白表達明顯上調(P〈0.01);與模型組比較,丙戊酸鈉組和藏紅花素中、高劑量組大鼠海馬組織GRP78、CHOP蛋白表達明顯下調(P〈0.01);藏紅花素低劑量組大鼠海馬組織GRP78、CHOP蛋白表達與模型組比較,差異無統計學意義(P〉0.05);與丙戊酸鈉組比較,藏紅花素高劑量組大鼠海馬組織GRP78、CHOP表達明顯下調(P〈0.01)。(見圖3、表5)
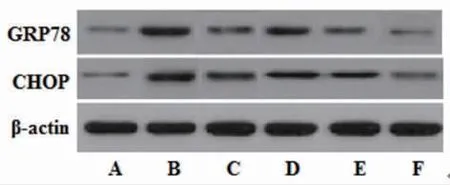
圖3 各組大鼠海馬組織GRP78、CHOP蛋白表達電泳圖
表5 各組大鼠海馬組織GRP78、CHOP蛋白表達比較(±s)
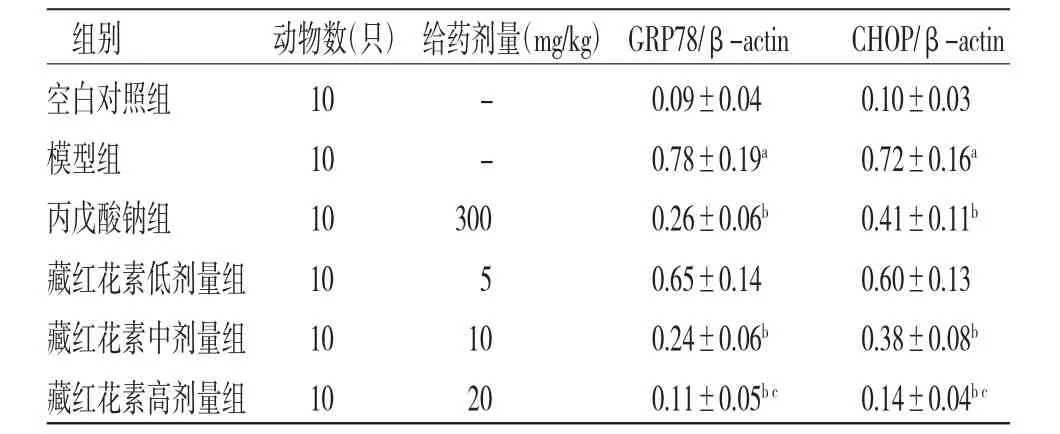
表5 各組大鼠海馬組織GRP78、CHOP蛋白表達比較(±s)
注:與正常對照組比較,aP〈0.01;與模型組比較,bP〈0.01;與丙戊酸鈉組比較,cP〈0.01
組別 動物數(只)給藥劑量(mg/kg)GRP78/β-actin CHOP/β-actin白對照組 10 - 0.09±0.04 0.10±0.03型組 10 - 0.78±0.19a 0.72±0.16a戊酸鈉組 10 300 0.26±0.06b 0.41±0.11b紅花素低劑量組 10 5 0.65±0.14 0.60±0.13紅花素中劑量組 10 10 0.24±0.06b 0.38±0.08b空模丙藏藏藏紅花素高劑量組 10 20 0.11±0.05b c 0.14±0.04b c
2.7 各組大鼠海馬組織Cleved Caspase-12、Bcl-2、Bax、NF-κB蛋白表達比較 與正常對照組比較,模型組大鼠海馬組織Cleved Caspase-12、Bax、NF-κB蛋白表達明顯上調,Bcl-2表達明顯下調(P〈0.01),Bcl-2/Bax比值明顯降低(P〈0.01);與模型組比較,丙戊酸鈉組和藏紅花素中、高劑量組大鼠海馬組織Cleved Caspase-12、Bax、NF-κB蛋白表達明顯下調,Bcl-2表達明顯上調(P〈0.01),Bcl-2/Bax比值明顯升高(P〈0.01);藏紅花素低劑量組大鼠海馬組織Cleved Caspase-12、Bcl-2、Bax、NF-κB蛋白表達與模型組比較,差異均無統計學意義(P〉0.05),藏紅花素低劑量組大鼠海馬組織Bcl-2/Bax比值明顯高于模型組(P〈0.01);與丙戊酸鈉組比較,藏紅花素高劑量組大鼠海馬組織Cleved Caspase-12、NF-κB表達明顯下調而Bcl-2表達明顯上調(P〈0.05或P〈0.01),Bcl-2/Bax比值明顯升高(P〈0.01)。(見表6、圖4)

圖4 各組大鼠海馬組織Cleved Caspase-12、Bcl-2、Bax、NF-κB蛋白表達電泳圖
表6 各組大鼠海馬組織Cleved Caspase-12、bcl-2、Bax、NF-κB蛋白表達及Bcl-2/Bax比值比較(±s)
注:與正常對照組比較,aP〈0.01;與模型組比較,bP〈0.01;與丙戊酸鈉組比較,cP〈0.05,dP〈0.01
組別 動物數(只)給藥劑量(mg/kg)Cleved Caspase-12/β-actin Bcl-2/β-actin Bax/β-actin NF-κB/β-actin Bcl-2/Bax空白對照組 10 - 0.13±0.03 0.95±0.16 0.04±0.02 0.03±0.02 23.75±4.86模型組 10 - 1.08±0.19a 0.07±0.04a 0.45±0.09a 0.98±0.20a 0.15±0.05a丙戊酸鈉組 10 300 0.19±0.05b 0.73±0.14b 0.14±0.04b 0.35±0.08b 5.21±1.17b藏紅花素低劑量組10 5 0.96±0.17 0.11±0.05 0.39±0.08 0.82±0.18 0.28±0.08b藏紅花素中劑量組10 10 0.52±0.11b 0.32±0.07b 0.16±0.04b 0.50±0.12b 2.06±0.43b藏紅花素高劑量組10 20 0.12±0.04b d 0.88±0.15b c 0.06±0.03b d 0.08±0.03b d 14.67±2.37b d
3 討 論
EP是一種常見的慢性神經系統疾病,以感覺、意識、精神、行為等功能性障礙為主要臨床表現,具有反復、急性自發的特點。EP發作是大腦神經元過度興奮和同步異常放電所致,該過程導致神經元損傷或丟失使EP病情進行性加重,而海馬體是最敏感的腦區。EP發病機制十分復雜,其中氧化應激和炎癥反應是EP發作和神經退行性變的重要機制。
藏紅花(又名番紅花)是一種鳶尾科番紅花屬多年生植物,為我國傳統中藥品種,味甘、性平,具有活血化瘀、散郁開結之功效。藏紅花素是藏紅花的主要活性成分,具有良好的抗氧化、抗凋亡活性,較易通過血腦屏障,溫彬等[7]研究發現藏紅花素能夠通過抑制氧化應激反應和神經元凋亡減輕大鼠缺血性腦損傷。丙戊酸鈉是一種廣泛應用于臨床的廣譜抗EP藥,也是EP相關動物實驗研究的常用陽性對照藥物。EP動物模型的制備方法主要有電點燃和化學點燃兩大類,其中Li-Pc化學點燃法制備的EP大鼠模型病理特征與人類高度相似,并且操作簡便、重復性高,是目前公認的EP大鼠模型制作方法。本實驗采用Li-Pc法制備EP大鼠模型,并以丙戊酸鈉作為陽性對照藥物,研究發現經藏紅花素干預能夠有效降低EP發作等級,抑制大腦海馬組織病變和海馬神經元凋亡,并且藏紅花素高劑量組效果優于丙戊酸鈉組,提示藏紅花素對Li-Pc所致EP大鼠腦組織具有保護作用。
活性氧簇(reactive oxygen species,ROS)過剩是發生氧化應激反應的物質基礎,EP發作時大腦神經元過度興奮和異常放電導致ROS大量生成,抗氧化酶(SOD、CAT)被過度消耗,導致ROS代謝失衡而蓄積;過剩的ROS破壞核酸、蛋白質及生物膜脂質等分子結構,生成具有生物毒性的MDA,因此MDA含量和SOD、CAT活性能夠反映機體氧化應激反應程度[12]。EP發病過程中大腦神經元過度興奮將刺激炎癥細胞因子(TNF-α、IL-1β、IL-6)大量釋放,引發系列炎癥反應進而導致海馬神經元損傷;并且TNF-α、IL-1β作為炎性趨化因子能夠刺激粒細胞而進一步釋放炎癥因子,形成炎癥級聯反應而加重炎癥損傷[13];IL-6則能夠刺激細胞大量產生活性氧(ROS)而加重氧化應激損傷[14]。本研究發現,藏紅花素干預能夠明顯提高EP大鼠大腦海馬組織SOD、CAT活力并降低MDA、TNF-α、IL-1β、IL-6含量,并且藏紅花素高劑量組對CAT活力和MDA、TNF-α、IL-6含量的調控作用優于丙戊酸鈉組,提示藏紅花素對Li-Pc所致EP大鼠海馬組織氧化應激損傷和炎癥反應具有抑制作用。
內質網是一種膜性亞細胞器,GRP78是一種鈣離子伴侶蛋白,對維持內質網穩態至關重要,既往研究發現病理性刺激細胞導致內質網過度應激時,導致大量錯誤折疊和未折疊的蛋白蓄積,進而誘導GRP78大量合成[15]。因此,GRP78升高可作為內質網應激標志檢測物質。CHOP是重要的促凋亡信號分子,內質網應激將誘導CHOP表達上調,刺激Cleved Caspase-12表達,進而誘導細胞凋亡[16]。Bcl-2和Bax同屬于Bcl-2蛋白家族,Bax能夠誘導線粒體膜通透性異常升高,導致細胞色素C(Cyt C)釋放而啟動線粒體凋亡途徑[17];Bcl-2則對線粒體膜通透性具有保護作用,并且Bcl-2能夠與Bax形成二聚體而抑制其活性,所以Bax/Bcl-2表達比值能夠反映二者對細胞線粒體凋亡途徑的調控作用[18]。NF-κB能夠刺激炎癥因子(TNF-α、IL-1β)釋放,抑制NF-κB表達則能夠抑制炎癥反應[19]。本研究發現,經藏紅花素干預能夠明顯下調EP大鼠大腦海馬組織GRP78、CHOP、Cleved Caspase-12、Bax、NF-κB蛋白表達并上調Bcl-2表達,提高Bcl-2/Bax比值,并且藏紅花素高劑量組對GRP78、CHOP、Cleved Caspase-12、Bcl-2、NF-κB表達及Bcl-2/Bax比值的調控作用優于丙戊酸鈉組,提示藏紅花素對Li-Pc所致EP大鼠腦組織內質網應激具有抑制作用,這可能是藏紅花素抑制氧化應激損傷和炎癥反應的重要分子機制。
綜上所述,藏紅花素對Li-Pc所致EP大鼠腦組織具有保護作用,其作用機制可能與藏紅花素抑制內質網應激通路介導的氧化應激和炎癥反應有關。

