miR-9-5p靶向CXCL11在幼年小鼠肺炎模型中的作用
王兆建 (青海大學附屬醫院兒科,西寧810001)
小兒肺炎是一種下呼吸道病原體感染的炎癥性疾病,可累及心臟、肝臟、神經系統、消化系統,是我國小兒住院死亡率最高的疾病。因此,探究小兒肺炎的發病機制已成為目前研究的熱點和難點。MicroRNA(miRNA)是一類非編碼內源性的小RNA,它們通過與靶基因的3'端非編碼區結合,下調靶基因的表達水平,對生物體中許多基本生命過程起到重要的調控作用。miR-9-5p 作為一種炎癥相關miRNA,通過調控炎癥反應在關節炎、多發性硬化等多種疾病的生理和病理過程中發揮著重要的作用[1-2]。但對miR-9-5p 是否參與調控肺炎的炎癥反應研究較少。趨化因子配體11(chemokine C-X-C motif ligand 11,CXCL11)是CXC 趨化因子家族中的一員,通過介導炎癥細胞浸潤到組織損傷部位參與重癥肺炎的發病[3]。生物信息學篩查發現,CXCL11可能是 miR-9-5p 的靶基因。miR-9-5p 與 CXCL11 在肺炎發病過程中是否具有調控作用,有待于進一步探究。本研究以脂多糖(lipopolysaccharide,LPS)誘導的幼年小鼠肺炎為模型,初步探討了miR-9-5p 靶向調控CXCL11 對幼年肺炎模型小鼠的作用及其分子機制。
1 材料與方法
1.1 材料 兔抗小鼠Bax、CXCL11、TLR4、p-p65、p-I-κB 和 GAPDH 單克隆抗體及 HRP 標記山羊抗兔的二抗、IL-1β(ab216165)、TNF-α(ab208348)的ELISA 試劑盒均購自艾博抗(上海)貿易有限公司;Trizol 試劑、一步法反轉錄熒光定量試劑盒、蛋白雙染marker、顯影液、脫脂奶粉、LPS、miR-9、CXCL11及內參基因引物均購自上海生工生物科技有限公司;雙熒光素酶檢測報告系統試劑盒、miR-9-5p agomir 及其對照(agomir-NC)、miR-9-5p mimic 及其對照(mimic-NC)、pcDNA3.1-CXCL11 及其對照(pcDNA3.1)均購自美國Promega 公司;293T 細胞購自武漢普諾賽生命科技有限公司。
1.2 方法
1.2.1 實驗分組及LPS 誘導的幼年小鼠肺炎模型的建立 健康雄性C57BL/6J 幼年小鼠由中國醫學科學院醫學實驗動物研究所提供,合格證號:SCXK(京)2019-0011。飼養條件為:12 h 光/12 h 暗周期、溫度23~25℃,相對濕度40%~70%。
將36 只小鼠分為對照組、模型組、miR-9-5p agomir組、agomir-NC組、miR-9-5p agomir+pcDNA3.1組、miR-9-5p agomir+pcDNA3.1-CXCL11 組,每組6 只。除對照組外,其余小鼠腹腔注射5 mg/kg LPS[4],然后分別將 1 nmol miR-9-5p agomir、agomir-NC、miR-9-5p agomir+pcDNA3.1、miR-9-5p agomir+pcDNA3.1-CXCL11 用 20 μl PBS 溶 解 ,采 用 Lipofectamine 2000 將上述質粒通過尾靜脈注射到對應分組小鼠體內[5],對照組注射等量生理鹽水。連續處理7 d后取出肺組織。
1.2.2 RT-qPCR 檢測各組小鼠肺組織中miR-9-5p和CXCL11 mRNA 表達水平 Trizol 抽提各組小鼠肺組織的RNA,分別按照一步法反轉錄熒光定量試劑盒說明書檢測miR-9-5p 和CXCL11 mRNA 的表達。以U6 和GAPDH 為內參。RT-qPCR 反應體系:2×onestep RT-qPCR Master Mix 10 μl、0.5 μmo/lL上/下游引物、0.5 μl RNA、RT enzyme Mix 0.65 μl、用 ddH2O 補足 20 μl。RT-qPCR 反應程序,反轉錄50℃ 5 min,1 個循環,95℃ 預變性 5 min,1 個循環,95℃ 變性 10 s,59℃ 退火 10 s,72℃ 延伸 15 s,45 個循環。每個樣品進行 3 次重復,2-ΔΔCt的方法進行相對定量分析。miR-9-5p 正向5'-GAAATGTCGTTCGAATTAGTGAG-3',反 向 5'-GAAAAAAACCGACCTCACGA-3',U6正向:5'-GCTTCGGCAGCACA-3',反向:5'-AACGCTTCACGAATTTGCGT-3'。CXCL11 正向 5'-GACGCTGTCTTTGCATAGGC-3',反向:5'-GGATTTAGGCATCGTTGTCCTTT-3';GAPDH 正向:5'-AGGAGCGAGATCCCTCCAAA-3',GAPDH 反向:5'-GTCTTCTGGGTGGCAGTGAT-3'。
1.2.3 HE 染色觀察各組小鼠肺組織病理變化 各組肺組織按1.5 cm×1.5 cm×0.4 cm 大小取材,采用10%甲醛固定,石蠟包埋后HE 染色進行病理學檢驗。
1.2.4 ELISA 試劑盒檢測各組小鼠肺組織IL-1β、TNF-α 含量 取各組0.1 g組織按1∶9(V/V)的比例加入預冷PBS 緩沖液,研磨后制備成10%的組織勻漿,將組織勻漿以3 000/rmin 離心5 min,收集上清,具體操作步驟按照ELISA法檢測試劑盒說明書,繪制標準曲線測定。
1.2.5 TUNEL 檢測各組小鼠肺組織細胞凋亡情況 各組肺組織分別用100 g/L 中性甲醛固定,石蠟包理,5 μm 厚連續切片。然后按照TUNEL 法檢測組織細胞凋亡試劑盒說明操作,檢測小鼠肺組織凋亡情況。
1.2.6 雙熒光素酶實驗驗證miR-9-5p 與CXCL11的靶向關系 構建野生型(CXCL11-W)和突變型(CXCL11-M)的CXCL11 3'-UTR 雙熒光報告質粒。將對數生長期的293T 細胞以每孔1×105個接種至12 孔細胞板上,將CXCL11-W、CXCL11-M 與miR-9-5p mimics 或 mimics NC 共轉染至 293T 細胞。每組實驗設置6 個重復。培養箱內培養48 h 后,參照雙熒光素酶報告基因檢測試劑盒步驟檢測熒光素酶活性。
1.2.7 Western blot 檢測各組小鼠肺組織CXCL11、Bax、TLR4、p-p65、p-I-κB 蛋白表達水平 各組肺組織中分別加入RIPA 裂解液,冰上裂解20 min,蛋白定量后進行SDS-PAGE 電泳,轉至PVDF 膜,用5%脫脂奶粉封閉。用兔抗CXCL11(1∶1 000)、Bax(1∶1 000)、TLR4(1∶1 000)、p-p65(1∶1 000)、p-I-κB(1∶1 000)、GAPDH 單克隆抗體(1∶10 000)在室溫下孵育2 h、洗膜;用羊抗兔HRP 二抗(1∶10 000)在室溫下孵育1 h、洗膜,ECL顯影。化學發光系統拍照。
1.3 統計學分析 采用SPSS21.0軟件進行數據分析。計量資料用表示,符合正態分布的計量資料,兩組比較采用獨立樣本t檢驗,多組比較采用單因素方差分析,檢驗水準α=0.05(雙側)。
2 結果
2.1 miR-9-5p 和CXCL11 在肺炎小鼠中的表達 對照組肺炎小鼠miR-9-5p 和CXCL11 mRNA 表達水平 分 別 為 3.09±0.15、1.01±0.06,模 型 組 0.99±0.08、3.40±0.30,agomir-NC 組 1.06±0.09、3.36±0.35,miR-9-5p agomir 組 4.88±0.84、0.34±0.05。小鼠肺組織中miR-9-5p 表達水平較對照組顯著下降,CXCL11 mRNA 表達水平較對照組顯著升高(均P<0.05);小 鼠 肺 組 織 中 miR-9-5p 表 達 水 平 較agomir-NC 組顯著升高,CXCL11 mRNA 表達水平較agomir-NC組顯著下降(均P<0.05)。
2.2 各組小鼠肺組織病理變化 對照組小鼠肺組織無炎性浸潤,結構完整,肺泡腔正常;模型組和agomir-NC組小鼠肺組織出現大量炎性浸潤,肺泡結構受損,肺泡壁增厚。與agomir-NC 組比,miR-9-5p agomir組小鼠肺組織炎性浸潤肺泡結構受損和肺泡壁增厚情況得到改善,見圖1。

圖1 各組小鼠肺組織病理切片(×100)Fig.1 Pathological sections of lung tissues of mice in each group(×100)
2.3 各組小鼠IL-1β、TNF-α 含量變化 模型組和agomir-NC 組小鼠肺組織中 IL-1β、TNF-α 含量較對照組顯著升高(P<0.05),miR-9-5p agomir 組小鼠肺組織中 IL-1β、TNF-α 含量較 agomir-NC 組顯著降低(P<0.05),見表1。
表1 各組小鼠IL-1β、TNF-α含量(,n=6,pg/ml)Tab.1 Contents of IL-1β and TNF-α in each group of mice(,n=6,pg/ml)
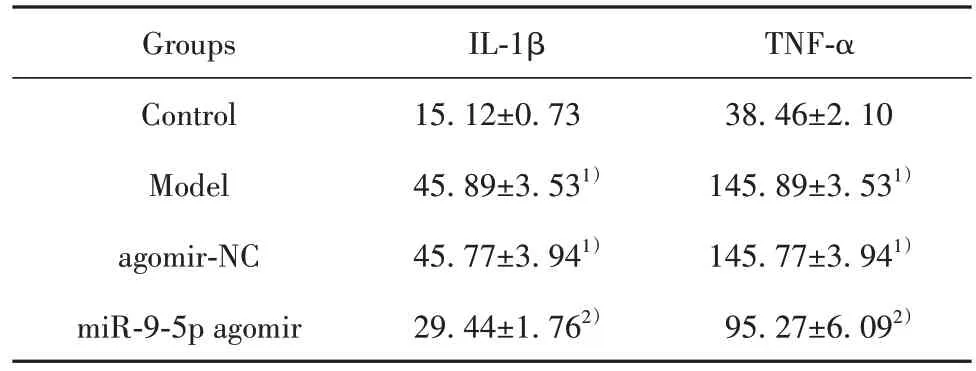
表1 各組小鼠IL-1β、TNF-α含量(,n=6,pg/ml)Tab.1 Contents of IL-1β and TNF-α in each group of mice(,n=6,pg/ml)
Note:1)P<0.05 vs control;2)P<0.05 vs agomir-NC.
TNF-α 38.46±2.10 145.89±3.531)145.77±3.941)95.27±6.092)Groups Control Model agomir-NC miR-9-5p agomir IL-1β 15.12±0.73 45.89±3.531)45.77±3.941)29.44±1.762)
2.4 各組小鼠肺組織細胞凋亡情況 模型組和agomir-NC 組小鼠肺組織陽性細胞數和Bax 蛋白表達水平較對照組顯著升高(均P<0.05),miR-9-5p agomir 組小鼠肺組織細胞陽性細胞數和Bax 蛋白表達水平較agomir-NC組顯著下降(均P<0.05),見圖2。
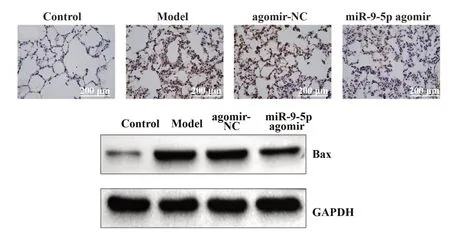
圖2 各組小鼠肺組織細胞凋亡情況Fig.2 Cell apoptosis in lung tissue of mice in each group
2.5 miR-9-5p 調控 TLR4/NF-κB 信號通路 與對照組比,模型組和agomir-NC 組TLR4、p-p65、p-I-κB蛋白表達水平均顯著升高(P<0.05),與agomir-NC組比,miR-9-5p agomir組TLR4、p-p65、p-I-κB蛋白表達水平均顯著降低(P<0.05),見圖3。
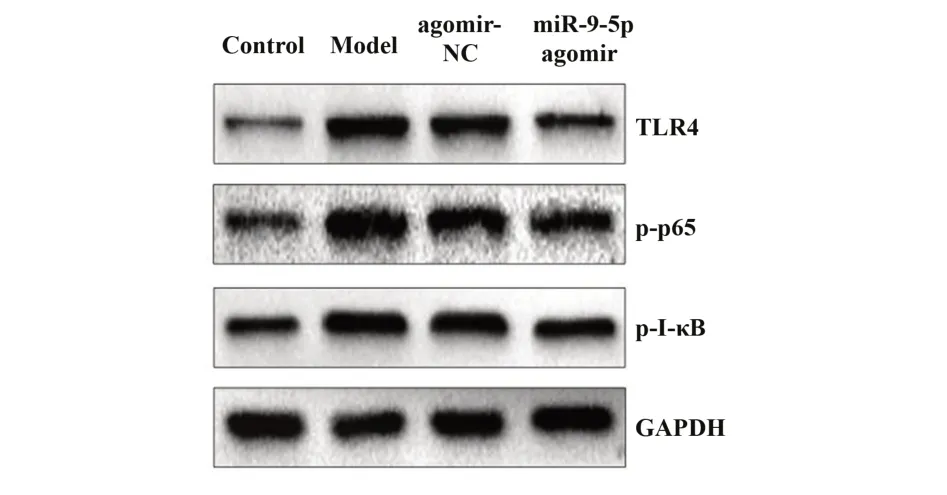
圖3 miR-9-5p調控TLR4/NF-κB信號通路Fig.3 miR-9-5p regulates TLR4/NF-κB signaling pathway
2.6 miR-9-5p 靶 向 CXCL11 Targetscan 網 站 預測到miR-9-5p 與CXCL11 存在結合位點,miR-9-5p agomir 顯著抑制野生型CXCL11 3'UTR 熒光素酶活性,對突變型CXCL11 3'UTR 熒光素酶活性無作用,Western blot 實驗結果顯示:miR-9-5p agomir 組 CXCL11蛋白表達水平較agomir-NC組顯著升高,見圖4。

圖4 miR-9-5p靶向CXCL11Fig.4 miR-9-5p targets CXCL11
2.7 CXCL11 回 補 miR-9-5p 的 作 用 miR-9-5p agomir+pcDNA3.1-CXCL11組IL-1β、TNF-α 含量、肺組織陽性細胞數、Bax 蛋白以及TLR4、p-p65、p-I-κB表達水平均顯著高于miR-9-5p agomir+pcDNA3.1組(P<0.05),見表2、圖5。
表2 各組小鼠IL-1β、TNF-α含量(,n=6,pg/ml)Tab.2 Contents of IL-1β and TNF-α in each group of mice(,n=6,pg/ml)

表2 各組小鼠IL-1β、TNF-α含量(,n=6,pg/ml)Tab.2 Contents of IL-1β and TNF-α in each group of mice(,n=6,pg/ml)
Note:1)P<0.05 vs miR-9-5p agomir+pcDNA3.1.
TNF-α 95.27±6.09 145.77±3.94 96.68±4.87 160.84±3.811)Groups miR-9-5p agomir agomir-NC miR-9-5p agomir+pcDNA3.1 miR-9-5p agomir+pcDNA3.1-CXCL11 IL-1β 29.44±1.76 45.77±3.94 30.01±1.24 58.12±2.241)

圖5 CXCL11回補miR-9-5p的作用Fig.5 Effect of CXCL11 rescue miR-9-5p
3 討論
miRNA作為小RNA中的一種,與糖尿病、腫瘤、心血管疾病、人類遺傳疾病和神經系統疾病等多種疾病的發生發展密切相關[6]。GUO 等[7]研究表明miR-1247可以抑制LPS誘導的A549細胞急性肺炎;PODSIAD 等[8]研究表明miR-155通過IL-23/IL-17途徑調節宿主對細菌性肺炎的免疫應答;WANG 等[9]研究表明在支原體肺炎小鼠中上調miR-143-3p 表達,可以改善肺部炎癥。因此,miRNA 在肺炎發病機理中可能起關鍵作用。
miR-9-5p 起初發現于神經系統,目前已被證實能夠參與神經系統的生長發育過程,同時還被證實在不同類型的腫瘤中可以發揮抑癌或者促癌作用[10-12]。值得注意的是,OU 等[13]研究指出過度表達miR-9-5p 通過下調 p50 抑制 NF-κB 信號通路,從而減輕深靜脈血栓(DVT)大鼠的炎癥和血栓形成。YI等[14]研究發現 miR-9-5p 通過靶向 CXCR4 減輕高糖誘導的人臍靜脈血管內皮細炎癥反應。以上研究提示miR-9-5p 是一個抗炎因子。本研究發現miR-9-5p 在LPS 誘導的幼年肺炎小鼠肺組織中表達下調。由此推測miR-9-5p 可能在調控肺炎的炎癥反應中發揮作用。基于此結果,本研究將miR-9-5p agomir注射到肺炎小鼠體內,肺組織中IL-1β、TNF-α明顯降低,肺組織炎癥細胞滲出和浸潤減輕,進一步證實miR-9-5p在肺炎中發揮抗炎作用。
CXCL11 稱為干擾素誘導的T 細胞α 趨化因子,位于人類第4 號染色體上,主要表達在白細胞、胰腺、肝臟。在小鼠甲型H1N1 流感病毒介導小鼠肺炎中CXCL11 的表達量隨著炎癥程度的增加而增加,且與其受體CXCR3結合參與肺炎的免疫調節過程,與炎癥細胞趨化游走密切相關[3,15]。本研究在Targetscan 網站預測查詢發現,CXCL11 3'UTR 中存在miR-9-5p 的目標堿基序列,且發現CXCL11 在LPS 誘導的幼年肺炎小鼠肺組織中表達量升高。RT-qPCR 和 Western blot 分析結果顯示,CXCL11 在miR-9-5p agomir 注射后下調,由此推測miR-9-5p 對CXCL11 有靶向調控作用。本研究應用雙熒光素酶實驗驗證了此推測。且通過回復實驗進一步證明miR-9-5p 通過調控CXCL11 的表達參與肺炎發生發展。Toll 樣受體 4(Toll-like receptor 4,TLR4)是先天免疫受體,參與機體免疫調控和炎癥反應。LPS 作為革蘭氏陰性菌的主要致病成分能夠特異激活TLR4信號通路,引發核轉錄因子NF-κB活化和促炎癥因子產生,從而損傷肺組織[16-17]。目前越來越多研究表明在多種疾病中miRNA 調控炎癥反應與TLR4/NF-κB 信號通路有關[18-19]。在肺炎中,WANG等[9]研 究 表 明 miRA-143-3p 調 控 TLR4/MyD88/NF-κB通路降低小鼠肺部炎癥因子。本研究結果表明,miR-9-5p agomir 注射后,TLR4、p-p65、p-I-κB 蛋白表達水平均顯著降低。由此得出miR-9-5p 在肺炎中發揮抗炎作用可能與抑制TLR4/NF-κB 信號通路有關。
在肺炎的發展中,細胞凋亡與肺炎的嚴重程度密切相關,且激活凋亡通路可加重肺組織炎癥反應[20]。CHEN 等[21]研究表明上調 microRNA-9-5p 通過下調固生蛋白C(Tnc)抑制脛骨平臺骨折后骨關節炎小鼠軟骨細胞凋亡;YI 等[14]研究表明在高糖誘導損傷的人臍靜脈血管內皮細胞中過表達miR-9-5p 能降低細胞凋亡率。本研究發現miR-9-5p agomir 注射到肺炎小鼠體內,肺組織細胞凋亡率和Bax 蛋白明顯降低,提示miR-9-5p 通過抑制細胞凋亡對肺炎具有保護作用。
綜上所述,miR-9-5p 靶向CXCL11 可能通過抑制TLR4/NF-κB 信號通路降低炎癥反應、抑制細胞凋亡對幼年肺炎模型小鼠具有保護作用,提示miR-9-5p 有可能成為小兒肺炎治療的新靶點。但值得注意的是,miRNA 對靶基因的調控機制比較復雜,一個miRNA 可能調控了若干個靶基因。因此,需要進一步探究miR-9-5p在幼年小鼠肺炎的具體機制。