黃烷-3-醇類化合物在體內的吸收、代謝特征與機制研究進展
劉若男,陳婉冰,晏芳芳,劉 敏,魯 群,楊 宏,劉 睿,*
(1.華中農業大學食品科學與技術學院,環境食品學教育部重點實驗室,湖北 武漢 430070;2.武漢市蜂產品質量控制工程技術研究中心,湖北 武漢 430000;3.農業農村部華中都市農業重點實驗室,湖北 武漢 430000)
黃烷-3-醇類化合物基本組成單位的分子骨架是C6—C3—C6,即兩個芳香環(A環、B環)之間以一個三碳鏈的吡喃環(C環)相連,形成最基本的黃烷-3-醇單體,其中以兒茶素、表兒茶素及其衍生物最為常見,再以此聚合形成黃烷-3-醇聚合物(即原花青素),包括二聚體、三聚體和高聚體等。根據聚合方式的不同將黃烷-3-醇聚合物分為A型原花青素和B型原花青素,B型原花青素是基本結構單元之間通過C4—C8鍵或C4—C6鍵連接而形成,而A型原花青素還在C2—C7、C2—C5間形成醚鍵[1]。黃烷-3-醇類化合物分布廣泛,水果(葡萄、蘋果、藍莓和蔓越莓等)及其制品、豆類(鷹嘴豆、蠶豆、蕓豆和小扁豆等)、堅果(夏威夷果、榛子和開心果等)、谷物(高粱)、中草藥(銀杏、黃連和桂皮等)等都是黃烷-3-醇類化合物的重要來源,且大多數為人類日常飲食,因此人類對黃烷-3-醇類化合物的攝入量并不匱乏。據調查,美國成年人的黃烷-3-醇類化合物攝入量為95 mg/d;黃烷-3-醇類化合物攝入量的占比由高到低依次為高分子聚合物(30%)、單體(22%)、二聚體(16%)、四至六聚體(15%)、七至十聚體(11%)和三聚體(5%)[2-3];西班牙人的類黃酮攝入量為313 mg/d,其中黃烷-3-醇類化合物為189 mg/d,占類黃酮攝入量的60%[4]。
許多國內外研究都證明黃烷-3-醇類化合物在促進健康方面發揮著重要作用,如抗氧化,抗炎,預防心血管疾病、癌癥以及衰老相關的代謝綜合征。同時隨著消費者對于其相關功能性食品和產品的需求增加,以及植物性保健食品和膳食補充劑等商業產品開發的興起,黃烷-3-醇類化合物在體內的吸收和代謝也受到了關注。近年來許多研究發現攝入黃烷-3-醇類化合物后,其代謝產物可能比母體化合物在體內發揮的生物活性更強[5]。有研究報道人體攝入原花青素后,其在體內血液中的濃度僅能達到10-9~10-8mol/L,人體吸收量不到攝入量的1%[6]。但Stoupi等的研究結果提示評估黃烷-3-醇類化合物在體內發揮的作用時需要考慮其代謝產物,他們首先對14C標記的原花青素B2生物利用度進行了評估,根據雄性大鼠口服14C標記的原花青素B2后0~96 h尿液中14C的總放射性,得出14C標記的原花青素B2絕對生物利用度約為82%;然后對比了靜脈攝入和經口攝入后血液中的14C總放射性,結果表明,14C標記的原花青素B2經口攝入后,其血漿放射性代謝動力學特征值(總清除率和表觀分布體積)比靜脈攝入高出8 倍,但是經口攝入的曲線下面積(血液中原花青素B2濃度隨時間變化的積分值)僅為靜脈攝入曲線下面積的11%;這些都表明經口攝入后進入血液循環的14C標記化合物不僅有母體化合物本身,還包含其他物質,而這些物質是由母體化合物代謝和轉化而來,研究者將母體化合物代謝和轉化歸因于腸道微生物[7]。因此要充分評價黃烷-3-醇類化合物在體內的生物利用度,不僅要考慮黃烷-3-醇類化合物在體內的吸收情況,還要考慮腸道微生物對其代謝過程及代謝產物。
1 黃烷-3-醇類化合物在體內的吸收與分布
黃烷-3-醇類化合物經口攝入后首先進入胃,但在胃部基本不被吸收。6 名健康受試者食用了富含黃烷-3-醇類化合物的可可飲料后,黃烷-3-醇類化合物在胃運輸持續約50~60 min,在此期間并未觀察到胃內容物中黃烷-3-醇類化合物含量的變化,這表明黃烷-3-醇類化合物在胃環境中穩定,大多數經口攝入的黃烷-3-醇類化合物可以完整地到達小腸[8],在小腸進行黃烷-3-醇類化合物(主要是單體和少量的低聚體等)的初次吸收,其余大量的黃烷-3-醇類化合物將完好無損地到達大腸[9]。Stalmach等在研究中發現大量黃烷-3-醇類化合物會從小腸轉運到大腸,他們獲取了人攝取綠茶后的回腸液,發現回腸液中含有70%的黃烷-3-醇類化合物及其代謝物,其中33%是未被胃和小腸吸收的母體化合物,其余37%是黃烷-3-醇類化合物的代謝物,這兩類化合物都將到達大腸進一步被代謝[10];被吸收的一小部分黃烷-3-醇類化合物及其代謝產物可通過II-相代謝酶的作用代謝為葡萄糖醛酸衍生物、硫酸鹽衍生和甲基衍生物。這些葡萄糖醛酸衍生物的親水性有助于其分布于各組織和器官,而硫酸鹽衍生物和甲基衍生物主要在肝臟中積累[1]。
目前的研究認為高分子質量的原花青素在胃和小腸中難以吸收,而小分子質量的黃烷-3-醇類化合物可以被小腸直接吸收。攝入黃烷-3-醇類化合物后,少量的二聚體(包括B1[11]、B2[12]、B5[13]、A1[14]和A2[14])以及三聚體C1[15]均在血漿中被檢測到。此外有研究也證實黃烷-3-醇類化合物單體比聚合物更容易被吸收,二聚體或三聚體的吸收率僅能達到黃烷-3-醇單體的10%。Shoji等使用高效液相色譜/串聯質譜法研究大鼠對蘋果黃烷-3-醇類化合物吸收的過程,以1 g/kgmb的劑量經口給藥后,表兒茶素、原花青素二聚體B2和三聚體C1在體內的吸收呈現差異,發現大鼠攝入后2 h,二聚體B2和三聚體C1在血漿中的濃度達到峰值,分別為0.4 μmol/L和0.14 μmol/L,而單體表兒茶素在給藥后1 h達到峰值(1.3 μmol/L)[13],遠高于黃烷-3-醇聚合物在血漿中的濃度。這一現象也在口服葡萄籽提取物的小鼠實驗中出現,以1 g/kgmb的劑量口服給藥1 h后,(-)-表兒茶素、原花青素二聚體和三聚體在血漿達到的最大濃度分別為2.5、0.57、0.10 nmol/L,而且二聚體和三聚體的吸收率分別僅為1.69%和0.04%[14]。
攝入黃烷-3-醇類化合物后,其代謝產物幾乎遍布全身。大鼠攝入原花青素B2后,原花青素B2本身可在小鼠血漿、小腸、肝臟、心臟、腎臟等組織中被檢出;其代謝產物在血漿、肝臟、小腸、腎臟、肺、心臟、腦組織和脾臟中被檢出,原花青素B2的結合型代謝產物在肝組織中被檢出的種類最多,亦有少部分經過血液循環在被腎臟組織富集后排泄[15]。肝臟被認為可能是原花青素及其代謝產物積累的主要器官,而大腸(盲腸和結腸)被認為是機體代謝原花青素非常活躍的器官。聚合度大于4的原花青素幾乎不能被小腸直接吸收,而是直達大腸被腸道微生物分解代謝。經過腸道微生物代謝的產物一部分會出現在糞便中,另一部分則經門靜脈抵達肝臟,在肝臟經歷II-相代謝反應,這類反應形成的代謝產物將進入循環系統;最終,一部分代謝產物會經尿液、糞便排出[1]。大鼠急性攝入榛子皮黃烷-3-醇類提取物(5 g/kgmb)后,其代謝物幾乎到達全身的各個器官(肝、腦、肺、腎、腸、睪丸、脾臟、心臟和胸腺),甚至可以穿越血腦屏障[16];此外,Wu Qian等研究發現大鼠急性攝入荔枝果皮黃烷-3-醇類提取物后在腦組織中最先檢測到原花青素——A型原花青素二聚體、A型原花青素三聚體和甲基-(-)-表兒茶素[17]。機體攝入黃烷-3-醇類化合物的吸收分布總結見圖1。
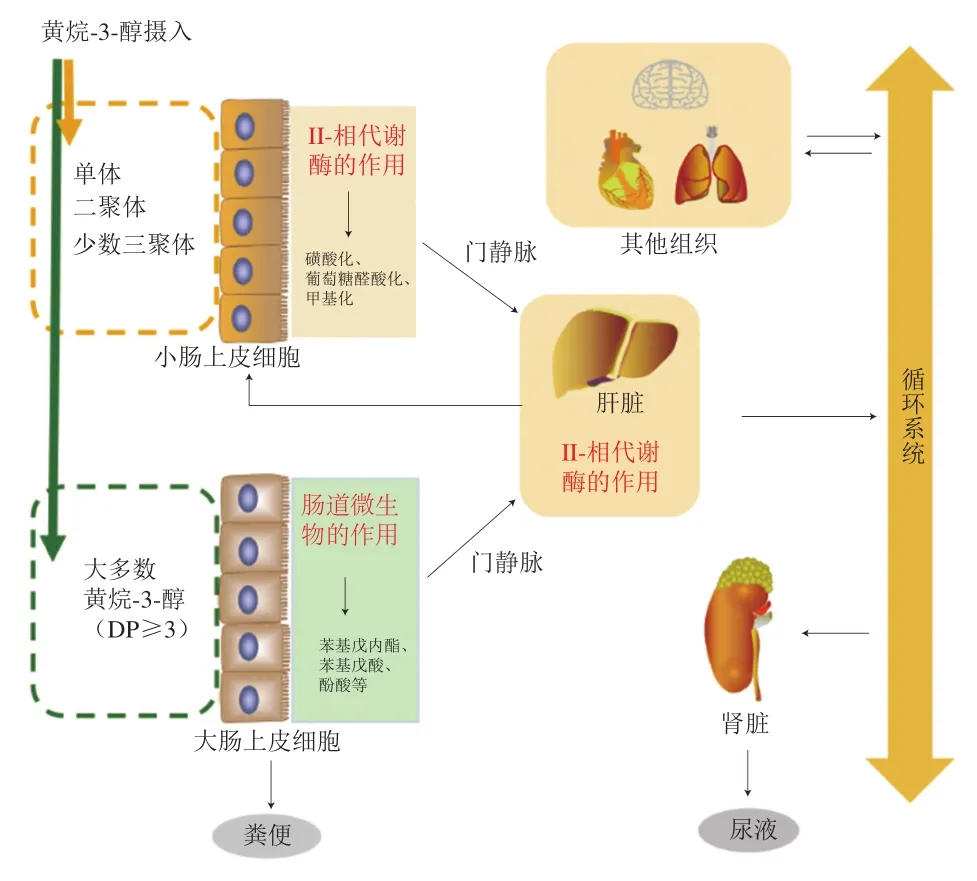
圖1 黃烷-3-醇類化合物在體內的吸收與分布Fig. 1 Absorption and distribution of flavan-3-ols in humans
2 黃烷-3-醇類化合物在體內的代謝
2.1 代謝機制
2.1.1 黃烷-3-醇類化合物在小腸中的代謝
黃烷-3-醇類化合物在人體內經歷多種代謝歷程,最先發生代謝的場所是小腸。腸上皮細胞會對黃烷-3-醇類化合物進行結構修飾,通過磺基轉移酶、葡萄糖醛酸轉移酶和甲基轉移酶的作用發生磺酸化、葡萄糖醛酸化和甲基化等[18-19]。這一過程相當迅速,在1 h內就可在血漿中檢測到這些衍生化的代謝產物[20],同時也表明黃烷-3-醇類化合物進入腸上皮細胞被代謝為衍生物后,再次被排出。將(+)-兒茶素通過小鼠小腸灌注時證實了這一點,腸系膜靜脈中檢測到甲基化代謝產物和葡萄糖醛酸代謝產物[20]。研究發現葡萄糖醛酸轉移酶在小腸和大腸的腸黏膜中活性最高,磺基轉移酶在肝臟中活性最高,而甲基轉移酶在肝臟和腎臟中活性最高[21]。
2.1.2 黃烷-3-醇類化合物在大腸中的代謝
大腸腸道微生物被認為可以進一步代謝黃烷-3-醇類化合物。1964年,Griffith等研究發現大鼠僅通過口服方式攝入(+)-兒茶素時,在尿液和糞便中可以檢測到間羥基苯丙酸和間羥基馬尿酸,而通過腹腔注射攝入(+)-兒茶素或者大鼠經過飼喂抗生素減少其腸道微生物后再經口攝入(+)-兒茶素,在糞便和尿液中均未檢測到間羥基苯丙酸和間羥基馬尿酸,后兩種攝入方式沒有經歷大腸腸道菌群的作用;因此,該作者認為黃烷-3-醇類化合物某些代謝產物的形成依賴于腸道菌群的作用[22]。這一發現引起了學者們的興趣,主要包括黃烷-3-醇類化合物的腸道微生物轉化及這一轉化對黃烷-3-醇類化合物生物活性的影響。
許多研究認為腸道微生物參與并促進了黃烷-3-醇類化合物在體內的分解代謝,同時在提高其生物活性和改善生物利用度等方面具有積極效果;另一方面,黃烷-3-醇類化合物可以發揮出良好的腸道菌群調節作用,促進腸道有益菌(主要是雙歧桿菌、乳酸菌、阿克曼菌)生長,并抑制腸道有害菌(主要為沙門氏菌、假單胞菌、奇異變形桿菌、致病性大腸桿菌)的繁殖[23],這種相互作用也被認為是黃烷-3-醇類化合物在生物體內代謝的重要機制之一。葡萄籽提取物(含98%的黃烷-3-醇類化合物)能促進人糞便微生物體外發酵模型中乳酸桿菌生長,抑制腸球菌和溶組織梭菌生長,通過對葡萄籽提取物中黃烷-3-醇類化合物的代謝產物分析發現,與發酵前相比,變化最大的是酚酸類代謝產物,且主要發生在孵育10 h后,但是在該研究中沒有明確發現微生物種群與母體化合物或微生物代謝物之間的相關性[24]。在其他的研究中鑒定出一些可以代謝黃烷-3-醇類化合物的腸道微生物,有研究者從轉化表兒茶素的人糞便懸液中分離出2 種細菌菌株rK3和aK2,基于表型特征和16S rRNA基因序列,將其分別鑒定為Eggerthella lenta和Flavonifractor plautii。其中Eggerthella lentarK3可以還原性切割(-)-表兒茶素和(+)-兒茶素的雜環C環,生成1-(3’,4’-二羥基苯基)-3-(2’,4’,6’-三羥基苯基)丙烷-2-醇;而Flavonifractor plautiiaK2可以進一步將1-(3’,4’-二羥基苯基)-3-(2’,4’,6’-三羥基苯基)丙烷-2-醇轉化為5-(3’,4’-二羥基苯基)-γ-戊內酯和4-羥基-5-(3’,4’-二羥基苯基)戊酸[25]。Stoupi等研究發現人糞便微生物Eubacterium oxidoreducens能夠在黃烷-3-醇類化合物的A環中插入氧形成新的羥基,從而促進A環的打開[26],關于其他不同微生物介導的黃烷-3-醇單體的代謝見表1。此外,在體外發酵荔枝皮的過程中發現,添加飲食來源的嗜熱鏈球菌和干酪乳桿菌能夠代謝荔枝果皮中的A型原花青素,嗜熱鏈球菌能夠將原花青素A2轉化為其異構體,而干酪乳桿菌可以分解原花青素A2,形成3-(3’,4’-二羥基)苯乙酸、4-羥基苯丙酸、間香豆酸和對香豆酸等[27]。

表1 不同微生物介導的黃烷-3-醇單體的代謝Table 1 Metabolism of flavan-3-ol monomer mediated by different microorganisms
2.2 代謝動力學
多年來,研究者主要是通過富含黃烷-3-醇類化合物的膳食干預來探究其代謝動力學。目前報道的膳食研究對象有茶類、可可、葡萄及葡萄制品、蔓越莓、蘋果、杏仁以及富含黃烷-3-醇類化合物的食品補充劑。
攝入富含黃烷-3-醇類化合物的膳食后,代謝產物主要有3 種類型:母體化合物及其II-相代謝產物、5-碳開環代謝產物(主要為戊內酯類和戊酸類及其II-相代謝衍生物)、小分子的酚酸以及II-相代謝衍生物。后兩類代謝物在血漿或尿液中的含量占主導。大鼠攝入紅酒的黃烷-3-醇類化合物提取物后,血漿中檢測到(-)-表兒茶素、原花青素B1和B2在1 h時濃度達峰值,分別為27、127、101 nmol/L;血漿中黃烷-3-醇單體濃度低于其二聚體濃度,可能是因為單體被II-相代謝酶迅速作用,產生了(表)兒茶素衍生物,如(表)兒茶素-5-葡萄糖醛酸、(表)兒茶素-7-葡萄糖醛酸、(表)兒茶素-3-甲氧基-5-葡萄糖醛酸、3’-甲氧基-(表)兒茶素-5-硫酸鹽、3’-甲氧基-(表)兒茶素-5-葡萄糖醛酸等,上述化合物在血漿中的濃度也在攝入1 h達到峰值,這些(表)兒茶素衍生物濃度峰值的平均值之和高達5 393 nmol/L;5-碳開環代謝產物在攝入黃烷-3-醇類化合物后4~8 h在血漿中濃度達到峰值(1 306 nmol/L);而小分子的酚酸以及II-相代謝衍生物達到的濃度峰值高于5-碳開環代謝產物,約為4 700 nmol/L[34]。人體攝入100 g黑巧克力(含有79 mg表兒茶素、26 mg兒茶素和49 mg原花青素B2)后1~4 h,血漿中黃烷-3-醇類化合物相關的II-相代謝產物水平達到最大值,且主要以葡萄糖苷酸、硫酸鹽和甲基衍生物的形式出現;而在血漿中檢測到的一些開環代謝產物(2-(3’,4’-二羥基)-苯乙酸、2-(4’-羥基)-苯乙酸、2-(3’-羥基)苯乙酸、2-(3’-甲氧基-4’-羥基)-苯乙酸、馬尿酸、羥基馬尿酸、3-甲基沒食子酸、苯甲酸和丁香酸等)主要是大腸中微生物作用的結果,而且這些代謝物在血漿中達到最大濃度的時間也較晚,通常在5~10 h左右[35]。志愿者攝入綠茶(主要成分為兒茶素)后,在其尿液和血漿中均檢測到兩種代謝物,分別被鑒定為(-)-5-(3’,4’,5’-三羥基苯基)-γ-戊內酯和(-)-5-(3’,4’-二羥基苯基)-γ-戊內酯,且這兩種代謝產物在血漿中達到最大濃度的時間是在5~12 h,而胃和小腸基本排空的時間為5 h左右,因此相較于胃和小腸等部位對茶中兒茶素的吸收和代謝,處于消化道后端的大腸微生物作用可能對其在體內分解代謝具有更重要的意義。值得注意的是,這兩種主要的代謝產物經尿液排泄時濃度達到峰值的時間相對于血漿濃度達到峰值時間有3 h左右的滯后,大約在攝入綠茶后7.5~13.5 h[36]。人食用可可粉后也有相似的情況,形成5-(3’,4’-二羥基苯基)-γ-戊內酯以及其他酚酸代謝產物,如3-(4’-羥基)苯丙酸、羥基苯甲酸、香草酸和2-(4’-羥基)苯乙酸等,這些代謝物在攝入6 h后在血漿中被檢測到[37]。一項關于葡萄渣中黃烷醇-3-醇類化合物代謝動力學的研究發現,5-(3’4’-二羥基)-γ-戊內酯和其衍生物為最豐富的代謝產物,血漿中它們的最高濃度在268~1 171 nmol/L,其余的苯基-γ-戊內酯最高濃度均未超過100 nmol/L。大多數開環代謝產物(苯基-γ-戊內酯以及衍生物、苯基-γ-戊酸以及衍生物和小分子質量的酚酸等)在血漿中濃度達峰值時間約5~7 h,之后逐漸降低,24 h后血漿中濃度基本都低于100 nmol/L[38]。
此外,有研究指出實驗對象的病理狀態會影響到黃烷-3-醇類化合物的代謝,同樣給予1 000 mg/kgmb葡萄籽黃烷-3-醇類提取物,相較于健康大鼠而言,具有代謝綜合征的大鼠血漿黃烷-3-醇類化合物濃度達到峰值的時間延遲,且它們的II-相代謝物和微生物代謝物水平升高[39]。因此,黃烷-3-醇類化合物的代謝和生物利用度也依賴于機體的健康狀態。
2.3 代謝途徑
黃烷-3-醇單體在小腸中產生的代謝物主要是以(表)兒茶素-3’-O-葡萄糖醛酸、3’-O-甲基-(表)兒茶素-5-硫酸鹽和(表)兒茶素-3’-硫酸鹽的形式存在,部分母體化合物到達結腸后經歷了腸道微生物群介導的生物轉化,產生了5-碳環裂變代謝產物,如5-(羥苯基)-γ-戊內酯和5-(羥苯基)-γ-羥基戊酸[40]。
B型原花青素的代謝途徑中,首先最為可能發生的是裂解分子結構單元間的黃烷鍵。原花青素B2與人類糞便菌群混合孵育12 h后,在培養基中檢測到(+)-表兒茶素,證明了上述途徑[26]。但是,該途徑似乎較慢且分解代謝的原花青素B2不到10%;更主要的途徑可能是原花青素在特定細菌的作用下,其上部結構單元發生A環裂解將直接形成小分子酚酸,其下部結構單元發生C環裂解或A環裂解以形成代謝物[41],轉化為5-(3’,4’-二羥基苯基)-γ-戊內酯和/或4-羥基-5-(3’,4’-二羥基苯基)戊酸[41-42]。代謝產生的苯基戊內酯類化合物仍可在腸道菌群或者人體內酶的作用下被進一步代謝,其中,微生物代謝產物苯基戊內酯類的脫羥基作用發生在脂肪族側鏈C4’位置處,它們被緩慢降解為苯基戊酸,再進一步通過α-氧化和β-氧化反應縮短苯基戊酸的側鏈長度,從而產生苯丙酸、苯乙酸和苯甲酸及其衍生物[43-45](圖2)。這一代謝途徑被Sanchez等利用人糞便細菌孵育黃烷-3-醇類化合物的代謝研究證實,他們發現在孵育的前10 h產生了苯基戊內酯,在10~48 h更長的時間內,戊內酯類代謝物被進一步代謝(鏈縮短和脫羥基),這一過程在整個代謝過程中占據主要地位[46]。聚合度不同的黃烷-3-醇類化合物代謝速率也存在一定差異,腸道菌群體外代謝模型(豬盲腸微生物模型)代謝不同結構原花青素(B2、B5、C1),研究發現原花青素B5在2 h內有62%被分解,之后降解速率降低,在4 h內幾乎完全消失;而原花青素B2也是在4 h內幾乎完全降解;但在這4 h內,三聚體C1含量僅降低了約12%,而且在這次研究中4 h內沒有檢測到三聚體C1的降解產物,僅有少量三聚體C1與基質發生結合。很顯然,微生物介導黃烷-3-醇類化合物代謝時,二聚體降解速率顯著快于三聚體C1[47]。

圖2 原花青素B2的代謝途徑Fig. 2 Metabolic pathway of procyanidin B2
A型原花青素除了分子結構單元間的C4—C8或C4—C6連接鍵外,還具有更牢固的C2—O—C7或C2—O—C5共價鍵,這種結構使得其抵抗腸道微生物分解代謝的能力比B型原花青素強[48]。大鼠分別攝入等量原花青素A2(二聚體)和原花青素A3(三聚體),原花青素A2在兩組大鼠尿液中的排出量分別為0.50 mol和0.88 mol,前者原花青素A2的排泄是原花青素A2部分吸收的結果,后者原花青素A2的排泄是由于原花青素A3三聚體降解,這也表明在C環打開之前,會存在二聚體和三聚體會被部分分解為單體[49]。借助豬盲腸模型研究原花青素A2和肉桂酸單寧B1(一種A型三聚體)的代謝時,相對于二聚體(原花青素A2)而言,A型三聚體多羥基代謝物更豐富,這可能是由于A型三聚體的分子質量更大,結構更復雜,其腸道微生物代謝機制也更復雜;但是兩種A型原花青素代謝的共性是在降解過程中末端單元上的C環均會發生裂解,并進一步代謝生成羥基或二羥基苯甲酸、苯乙酸、苯丙酸酸和間苯三酚[50]。因此,A型原花青素的降解始于部分分解為單體和末端結構單元C環的裂解,隨后進一步代謝形成各種酚酸。
2.4 代謝特征
大腸菌群代謝黃烷-3-醇類化合物的能力隨著被代謝化合物分子質量的增大而降低。大鼠分別攝入黃烷-3-醇單體、二聚體、三聚體及多聚體后,對尿液中代謝產物進行分析發現,酚酸類代謝產物的產率依次降低,分別為10%、7%、0.7%和0.5%[51]。兩組志愿者分別攝入等劑量的表兒茶素和原花青素低聚體,22%的表兒茶素轉化成苯基-γ-戊內酯通過尿液途徑排泄;而原花青素低聚體轉化為苯基-γ-戊內酯的量非常有限,且前者(攝入兒茶素)苯基-γ-戊內酯通過尿液的排泄量是后者(攝入原花青素)的10 倍,由此可見黃烷-3-醇單體轉化為苯基-γ-戊內酯的轉化率高于原花青素低聚體[52]。
盡管A型和B型原花青素具有不同的化學結構,但是兩種不同結構類型原花青素的代謝產物卻有交叉和共性,例如(表)兒茶素、3-(3’,4’-二羥基)-苯丙酸、3-(3’,4’-二羥基)-苯乙酸、5-(3’,4’-二羥基苯基)-γ-戊酸以及5-(3’,4’-二羥基苯基)-γ-戊內酯。其中,代謝產物γ-苯基戊酸類和γ-苯基戊內酯類及其衍生物被認為是黃烷-3-醇類化合物在體內發揮生物活性的主要貢獻者[53],這主要是因為攝入膳食來源的黃烷-3-醇類化合物后,這兩者在循環系統和尿液中含量較高,如人體在攝入綠茶后,苯基戊內酯類代謝產物在尿液中的含量是(表)兒茶素II-相代謝產物的10 倍[36]。對比經常攝入可可(富含黃烷-3-醇類化合物)和不攝入可可的兩類人群,發現前者血漿和尿液中的5-(3’,4’二羥基苯基)-γ-戊內酯及其硫酸鹽衍生物、葡萄糖衍生物的含量顯著高于后者[54]。志愿者食用專門制備的可可飲料(含黃烷-3-醇單體到十聚體),24 h內5-(3’,4’二羥基苯基)-γ-戊內酯經尿排泄量大約為93 μmol[55]。在人攝入葡萄渣中黃烷-3-醇類提取物(葡萄酒和果汁工業的主要副產品)后,發現在血漿中γ-苯基戊酸類和γ-苯基戊內酯類濃度可高達2 500 nmol/L,而(表)兒茶素及其衍生物的最高濃度僅能達到330 nmol/L,小分子的酚類及酚酸(苯甲酸、苯乙酸以及衍生物等)最高濃度約為1 600 nmol/L[37]。
此外,其他類黃酮(槲皮素、楊梅素、木犀草素、柚皮素和山柰酚鼠李糖苷)通過微生物分解代謝也可以產生[56],而苯基戊內酯僅能在攝入富含黃烷-3-醇類化合物的綠茶[57]、可可粉[52]和松樹皮萃取物[57]等的受試者血漿中被檢測到,即苯基戊內酯可能是黃烷-3-醇類化合物的典型代謝產物,其中5-(3’,4’-二羥基苯基)-γ-戊內酯被認為是主要的代謝產物之一。在一些糞便體外代謝模型和大鼠體內代謝的尿液中發現苯基戊內酯的濃度超過了游離的苯基戊酸和缺乏側鏈羥基的酚酸濃度,這可能一方面是由于在代謝過程中黃烷-3-醇類化合物的環裂解產物——二苯基丙烷-2-醇衍生物可以直接代謝轉化為苯基戊酸,進而形成各種小分子游離酚酸;另一方面,二苯基丙烷-2-醇衍生物需要先代謝為苯基戊內酯類,進而形成戊酸和一些缺乏側鏈羥基的酚酸,并且在苯基戊內酯和苯基戊酸之間存在一定的相互轉化[58]。但是對于這一現象仍需要進一步研究以確認原因,例如:苯基戊內酯是否是由側鏈羥基自發形成的以及苯基戊內酯在血漿和大腸環境下水解的難易程度[59-60]。
黃烷-3-醇類化合物的腸道微生物代謝物是否仍然具有生物活性及活性發生變化的機制也同樣值得探討。原花青素A2經大鼠腸道(盲腸和結腸)的微生物體外孵育結果表明,其代謝產物的抗氧化能力顯著高于原花青素A2。在體外孵育代謝6 h時,其代謝產物的總抗氧化活性、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)清除能力自由基和2’-聯氮-雙-3-乙基苯并噻唑啉-6-磺酸陽離子自由基清除能力分別提高了2.01、2.16 倍和1.34 倍。并且最近的一項研究顯示,采用體外糞便微生物共孵育培養24 h后,兒茶素和表兒茶素孵育體系抗氧化活性的增加與C環裂解代謝物的積累呈正相關,并且研究者對這一結果進一步驗證,從孵育液中分離出了C環裂解代謝物(1-(3’,4’-二羥基苯基)-3-(2’,4’,6’-三羥基苯基)丙-2-醇),該代謝物的DPPH自由基清除能力顯著提高(兒茶素的2 倍、表兒茶素的1.8 倍)[61]。因此代謝產物很可能在母體化合物生物活性作用過程中發揮重要作用[62]。此外,黃烷-3-醇類化合物的典型代謝產物——5-(3’,4’-二羥基苯基)-γ-戊內酯就體外抗氧化能力而言雖然低于其母體化合物之一的(+)-表兒茶素,但強于L-抗壞血酸[63]。Lee等的研究證實,5-(3’,4’-二羥基苯基)-γ-戊內酯是原花青素A1、A2、B1、B2和(+)-兒茶素、(-)-表兒茶素這6 種黃烷-3-醇類化合物的標志性代謝產物,且該化合物具有比其母體化合物以及母體化合物的其他代謝產物(3-(3’,4’-二羥基)苯丙酸和2-(3’,4’-二羥基)苯乙酸)更強的抑制THP-1(人類單核細胞)對人臍靜脈內皮細胞黏附的作用,說明5-(3’,4’-二羥基苯基)-γ-戊內酯在預防動脈粥樣硬化方面具有更高的潛力[64]。同時也有研究發現5-(3’,4’-二羥基)-γ-戊內酯和5-(3’-甲基-4’-羥基)-戊內酯比其母體兒茶素具有更強的抑制巨噬細胞中一氧化氮產生及炎癥相關酶(基質金屬蛋白酶)活性的作用[65-66]。(-)-兒茶素的15 種腸道代謝物中,(3’,4’,5’-三羥基苯基)-戊酸對宮頸癌細胞增殖具有最強的抑制作用,半抑制濃度為5.58 μmol/L,證實了兒茶素的腸道代謝產物對預防宮頸癌具有重要作用[67]。而且苯基-γ-戊內酯能夠抑制由過氧化氫誘導的棕色脂肪細胞氧化應激并抵消炎癥[68]。大鼠攝入冷凍干燥藍莓(主要含有黃烷-3-醇類化合物)后,主要代謝產物是小分子酚酸,如馬尿酸、3-(3’-羥基)苯乙酸、3-(3’羥基)苯甲酸、3-(3’-羥基)苯丙酸和3-(4’-羥基)苯丙酸等。并且這些酚酸代謝物的混合物能夠抑制炎癥細胞因子的產生和泡沫細胞的形成,這對于動脈粥樣硬化具有潛在保護作用[69]。
3 黃烷-3-醇類化合物及其代謝產物的排泄
黃烷-3-醇類化合物代謝產物可隨人體的糞便和尿液排出體外。尿液排泄前未被吸收的一部分黃烷-3-醇類化合物以及發生吸收和轉化的一些代謝產物(包括部分母體化合物、小腸部分吸收產生的代謝物以及大腸菌群介導的代謝產物)均可通過門靜脈到達肝臟并被吸收,其中一部分可通過II-相代謝酶的作用產生結合衍生物,隨后隨尿液排出;此外,糞便中主要含有未吸收的高分子質量母體化合物、代謝產物及其衍生物[70]。
尿液是黃烷-3-醇類化合物代謝產物的主要排出途徑。大鼠攝入(分為靜脈攝入組和經口攝入組,攝入劑量相同)14C標記的原花青素B2后,放射性物質排盡的時間為96 h,在這期間這兩種不同攝入方式組尿液放射性物質含量都高于糞便,且最主要的排泄時間在24 h內;0~24 h時靜脈注射組在尿液中的放射性物質占總攝入放射性物質劑量的68.7%,糞便中為24.6%;而經口攝入組上述指標在尿液和糞便中分別為58.3%和39.6%[7]。這些結果表明原花青素無論是經口攝入還是靜脈攝入,形成的代謝產物大部分是經過腎臟代謝途徑清除,小部分經肝臟進入膽汁,由膽汁流入腸腔,然后隨糞便排出。大鼠攝食含有高粱麩皮(原花青素含量為23.3 mg/g)的飼料后,尿液中總酚酸排泄量為23 μmol/d,未攝入高粱麩皮的大鼠尿液中總酚酸的排泄量為0.8 μmol/d[71]。黃烷-3-醇類化合物代謝產物排泄的主要的形式之一是酚酸及其衍生物。Urpi-Sarda等研究發現,與未食用可可粉組相比,食用40 g富含黃烷-3-醇類化合物可可粉的受試者尿液中香豆酸、香草酸、3-羥基苯甲酸酸和阿魏酸含量均增加了2 倍以上[72]。同樣,人食用80 g巧克力(含586 mg黃烷-3-醇類化合物)后,3-(3’-羥基)苯丙酸、2-(3’-羥基)苯乙酸、香草酸(4-羥基-3-甲氧基)苯甲酸和間羥基苯甲酸的尿排泄量增加[73]。大鼠在分別攝入黃烷-3-醇單體(含兒茶素16.4 mg和表兒茶素79.6 mg)和黃烷-3-醇二聚體(含原花青素B1 21.2 mg和原花青素B2 74.8 mg)后,兩組尿液中均發現了大量酚酸及其II-相代謝產物[74]。
4 結 語
黃烷-3-醇類化合物是重要的膳食多酚,大量的研究證實其具有抗氧化、抗腫瘤、抗炎、防治心腦血管疾病等多種生理功能和藥理活性,并被應用于醫藥、膳食補充劑、日化等產品中。黃烷-3-醇類化合物在體內的吸收、代謝途徑,在體內循環系統中的分布、排泄以及在各器官中發揮生理活性的機制已經成為膳食多酚現階段研究領域的熱點。
到目前為止,關于黃烷-3-醇類化合物代謝產物的定性及部分定量工作已經取得很大的進展,同時在黃烷-3-醇類化合物的代謝機制與代謝途徑方面也得到了越來越深刻的認識,研究者們將黃烷-3-醇類化合物的代謝歸因于腸道菌群的作用。最為關鍵的是,黃烷-3-醇類化合物對于健康的益處可能更大程度上歸因于它們的腸道微生物代謝產物,這意味著黃烷-3-醇類化合物在人體內發揮作用時不再僅局限于母體化合物,這些研究結果表明代謝產物可能會成為改善健康且不具有排斥性和副作用的精準目標物質。但是這些代謝產物發揮生理活性時劑量的確定以及驗證這些代謝產物的活性仍有一定的困難,如獲得的代謝產物經口攝入時是否會再次發生改變;其在發揮生理功能時的機制仍需進一步的研究和確認;某些目標代謝物的大量獲得會面臨一些挑戰。
雖然腸道微生物在黃烷-3-醇類化合物的代謝過程中發揮的重要作用已被證實,但是這一過程中活躍的具體微生物(群)以及其對黃烷-3-醇類化合物代謝過程中的明確作用等仍然需要繼續關注。接下來,還需清晰全面地探究這些相關微生物,進一步的研究可以通過一定方式有針對性地改善人體的腸道菌群來提高黃烷-3-醇類化合物在體內的生物利用度,或者可以在體外條件下精準培養這些發揮代謝作用的微生物來產生和富集目標代謝產物,這對于未來產品研發將大有益處。

