歐盟體外診斷醫(yī)療器械分類監(jiān)管體系變化與思考
【作 者】周良彬,崔樂,程娟,黃穎
1 廣東省醫(yī)療器械質(zhì)量監(jiān)督檢驗所,廣州市,510663
2 中國食品藥品檢定研究院,北京市,100050
0 引言
20世紀(jì)90年代以來,歐盟的醫(yī)療器械主要通過有源植入醫(yī)療器械指令 90/385/EEC、醫(yī)療器械指令 93/42/EEC和體外診斷醫(yī)療器械指令98/79/EC[1](in vitrodiagnostic medical devices directive,IVDD)的施行來實現(xiàn)監(jiān)管。隨著行業(yè)發(fā)展和科技新成果的引入,原有的三個指令監(jiān)管體系暴露出愈來愈多的問題,其中各成員國對指令的解讀分歧和實施差異,硅膠乳房植入物等器械事故的出現(xiàn),暴露了原有法律體系的缺點,監(jiān)管的乏力,極大地破壞了患者、消費者和醫(yī)療衛(wèi)生專業(yè)人士對歐盟醫(yī)療器械安全性的信任。為適用行業(yè)和科技發(fā)展速度,避免同類質(zhì)量問題的重復(fù)發(fā)生,增強在EU供應(yīng)的醫(yī)療器械的安全性,增強各方面對歐盟醫(yī)療器械監(jiān)管體系的信心,保持其在醫(yī)療器械領(lǐng)域的領(lǐng)先地位,2012年歐盟啟動了醫(yī)療器械監(jiān)管法規(guī)體系的全面修訂更新。2017年,歷時五年的修訂工作結(jié)束,新版醫(yī)療器械條例(EU)2017/745(medical devices regulation,MDR)與體外診斷醫(yī)療器械條例(EU)207/746[2](in vitrodiagnostic medical devices regulation,IVDR)發(fā)布,前者代替指令90/385/EEC和 93/42/EEC,后者代替98/79/EC。
兩個新條例致力于創(chuàng)建一個國際公認的健全透明及可持續(xù)的監(jiān)管框架,提升臨床安全性,為廠商創(chuàng)造更為公平的市場準(zhǔn)入機會。歐盟通過MDR的修訂發(fā)布,提高了對臨床調(diào)查的要求,對風(fēng)險進行管理以確保患者安全,加強了對醫(yī)療器械和體外診斷醫(yī)療器械整個生命周期的督查和管理,提高了透明度和可追溯性,明確分類和定義從而減少解讀歧義。此外,與指令相比,條例在各成員國可直接適用,不需要轉(zhuǎn)化為成員國國家法律,因而MDR和IVDR將降低整個歐盟市場可能出現(xiàn)釋法分歧的風(fēng)險。最終,新法規(guī)系統(tǒng)將有助于歐盟立法與技術(shù)進步、醫(yī)學(xué)變革和立法完善保持協(xié)調(diào)一致。
對體外診斷醫(yī)療器械而言,IVDR最大的變化涉及體外診斷醫(yī)療器械的風(fēng)險分類和認證機構(gòu)的職責(zé),導(dǎo)致約有85%的體外診斷醫(yī)療器械需接受認證機構(gòu)的監(jiān)督,而IVDD指令中只有約20%。IVDR引入了一個和國際指南一致的風(fēng)險分類新系統(tǒng),取代了IVDD附錄Ⅱ的清單A和清單B,強化了其IVD分類管理體系。IVDR參考引入了國際醫(yī)療器械法規(guī)協(xié)調(diào)組織(the global harmonization task force,GHTF)2011年在此工作組基礎(chǔ)上成立了國際醫(yī)療器械監(jiān)管者論壇
(international medical device regulators forum,IMDRF),于2008年發(fā)布的包含在《IVD醫(yī)療器械的分類原則》[3]中的IVD產(chǎn)品風(fēng)險分類思路和體系,并以之為基礎(chǔ)明確各風(fēng)險分類對應(yīng)的監(jiān)管要求,完善了產(chǎn)品風(fēng)險監(jiān)管體系,以期實現(xiàn)風(fēng)險管理與合規(guī)成本的最優(yōu)平衡。
與MDR對原有產(chǎn)品分類監(jiān)管系統(tǒng)進行補充完善的修訂工作思路相比,IVDR中產(chǎn)品分類監(jiān)管系統(tǒng)的調(diào)整是根本的、方向性的,更為全面而深入,這一調(diào)整所引起的產(chǎn)品監(jiān)管要求變化的幅度更大,范圍更廣,制造商、使用方、監(jiān)管者在合規(guī)方面需要調(diào)整和跟進的工作也更多。因而,為了讓行業(yè)各方面更好地適應(yīng)法規(guī)變化,歐盟理事會將MDR的過渡期設(shè)置為4年的同時,給予了IVDR更長的過渡期,為5年。
產(chǎn)品風(fēng)險等級的劃分和確定,是各方面開展產(chǎn)品合規(guī)工作的基礎(chǔ)和起始點。IVDR這一全新IVD產(chǎn)品分類系統(tǒng)的建立和實施,勢必給歐盟地區(qū)醫(yī)療器械的生產(chǎn)、銷售、使用、監(jiān)管等相關(guān)活動帶來根本性的影響和沖擊,筆者旨在對歐盟IVDR這一監(jiān)管體系及其思路做一系統(tǒng)分析,為給我國相關(guān)工作提供參考和借鑒。
1 IVDR分類監(jiān)管體系
1.1 分類監(jiān)管文件系統(tǒng)
IVDR分為正文和附錄兩大部分,其中正文一共10章113條,分別對法規(guī)基本概念、產(chǎn)品上市責(zé)任、產(chǎn)品追溯監(jiān)管、公告機構(gòu)、分類與符合性評估、臨床與性能評估、上市后產(chǎn)品監(jiān)管、監(jiān)管組織協(xié)調(diào)合作、數(shù)據(jù)安全、法規(guī)實施等方面明確了要求;為了進一步明確正文條款相關(guān)要求,提高其可執(zhí)行性,IVDR在正文基礎(chǔ)上增加了15個附錄,涉及產(chǎn)品基本安全性和性能、技術(shù)文檔、上市后監(jiān)管、信息提交、公告機構(gòu)要求、分類規(guī)則、符合性評估等方面內(nèi)容。
IVDR的分類監(jiān)管要求主要集中在正文第5章“分類與符合性評估”第47條“器械分類”、第48條“符合性評估程序”,以及第7章“上市后監(jiān)管、警戒和市場監(jiān)管”第80條“上市后監(jiān)督報告”、第81條“定期安全性報告”,分類規(guī)則則在附錄Ⅷ中進行規(guī)定。IVDR[2]作為基礎(chǔ)文件和依據(jù),首先在正文中建立基本的分類監(jiān)管要求:第47條“器械分類”對IVD分類系統(tǒng)的基本要素做了明確,包括基本原則、管理類別、分類程序;第48條“符合性評估程序”則針對不同管理類別明確了其符合性評估要求;第80條“上市后監(jiān)督報告”、第81條“定期安全性報告”則對不同管理類別產(chǎn)品的上市后報告要求做了規(guī)定。IVDR附錄Ⅷ則針對產(chǎn)品不同的預(yù)期用途,給出了對應(yīng)的IVD器械分類規(guī)則,同時明確了這些規(guī)則的適用思路和邏輯。
為了幫助規(guī)則使用者盡快理解和掌握附錄Ⅷ的分類規(guī)則,同時協(xié)調(diào)各方對規(guī)則的解讀一致性,依據(jù)條例建立的咨詢醫(yī)療器械協(xié)調(diào)組(medical device coordination group,MDCG)為保障規(guī)則的順利實施于2020年11月制定發(fā)布了指南文件[4],對規(guī)則相關(guān)的定義、使用原則進行了具體闡述,并對產(chǎn)品分類規(guī)則進行了逐條解析和舉例說明。該文件雖然不是法律文件,但對于IVDR所建立分類規(guī)則的實施具有重要的指導(dǎo)意義,可切實提高規(guī)則的執(zhí)行效率和解讀一致性。
1.2 分類監(jiān)管框架
IVDR的正文第47條明確,IVD器械根據(jù)預(yù)期用途及內(nèi)在風(fēng)險分為A、B、C和D類共四類,風(fēng)險水平依次由低到高,產(chǎn)品的分類規(guī)則在條例的附錄Ⅷ中具體說明。制造商在開展產(chǎn)品上市前合規(guī)活動之初,應(yīng)首先根據(jù)附錄中分類規(guī)則劃分產(chǎn)品管理類別,并在提交的資料中進行明確。制造商與公告機構(gòu)如因附錄Ⅷ中規(guī)則的應(yīng)用發(fā)生分歧,應(yīng)將爭議事項提交該制造商商業(yè)注冊地所屬成員國的主管當(dāng)局裁定。
歐盟理事會可應(yīng)成員國請求或自發(fā),在咨詢醫(yī)療器械協(xié)調(diào)組之后,以執(zhí)行性法案的方式,決定:(a)應(yīng)用附錄Ⅷ確定某一器械、某一類器械或某一器械組的分類;(b)基于新的技術(shù)證據(jù),或上市后警戒和市場監(jiān)管活動獲得的信息,出于公共健康的理由,以減損附錄Ⅷ的方式,對某一器械、某一類器械或某一組器械進行重新分類。另一方面,為了確保附錄Ⅷ規(guī)則實施的一致性,考慮到相關(guān)技術(shù)委員會的技術(shù)意見,理事會可以采用必要程度的執(zhí)行法案,以解決解讀分歧和實際實施的相關(guān)問題。
針對不同管理類別和產(chǎn)品特性,IVDR明確提出了與其風(fēng)險水平對應(yīng)的監(jiān)管要求,基本要求,如表1所示。

表1 IVDR中管理類別與監(jiān)管要求對應(yīng)關(guān)系Tab.1 Correspondence between classes and regulatory requirements in IVDR
IVDR第48條第5款、第6款規(guī)定,在對D類IVD器械進行符合性評估時,除了公告機構(gòu),還需要一家特定歐盟參考實驗室的參與,以驗證廠商宣稱的性能和審核器械是否符合適用的統(tǒng)一規(guī)范。此外,對于目前尚無統(tǒng)一規(guī)范的D類創(chuàng)新型器械,必須由一個獨立的專家小組對廠商提交的性能表現(xiàn)評估報告發(fā)表意見(見第48條第6款)。
另一方面,針對特定類型的IVD器械,IVDR在分類管理基礎(chǔ)上提出了額外的相關(guān)要求,其中:對于B類/C類/D類的自測器械和床旁檢測器械,附錄Ⅸ第5.1小節(jié)適用于其技術(shù)文檔的評估;對于伴隨診斷器械(通常為C類或D類),附錄Ⅸ第5.2小節(jié)適用于其技術(shù)文檔的評估,C類的伴隨診斷器械同時適用附錄Ⅸ第4.1~4.8小節(jié),公告機構(gòu)在評估過程中應(yīng)按附錄Ⅸ5.2小節(jié)和附錄Ⅹ第3節(jié)(k)規(guī)定的程序咨詢負責(zé)藥品管理的主管當(dāng)局。
此外,作為提高產(chǎn)品可追溯性的關(guān)鍵舉措,IVDR中對各個管理類別產(chǎn)品的UDI實施要求提出了相關(guān)要求:配發(fā)UDI的工作必須在IVDR生效日(2022年5月26日)之前完成;標(biāo)簽上加貼UDI時限,則根據(jù)產(chǎn)品類別有所不同,分別為D類-2023年5月26日、B類/C類-2025年5月26日和A類-2027年5月26日,在上述日期之前,廠商可自行選擇在器械上加貼UDI,但是不作強制要求;對于可重復(fù)使用的器械,條例要求在器械上直接標(biāo)刻UDI,其時限為標(biāo)簽加貼UDI時限的兩年后。
需要注意的是,各個管理類別的產(chǎn)品在符合性評估工作相關(guān)的公告機構(gòu)、參考實驗室、專家小組(見表1)完成指定或組建工作之前,將無法完成符合性評估工作進而投放市場。然而,完成這些配套工作需要較長時間,如認證機構(gòu)的指定過程可能需要18個月甚至更長,且需要成員國和歐盟有關(guān)部門的評定員參與。有鑒于此,歐盟理事會為IVDR設(shè)置了為期5年的過渡期,并制定了過渡期相關(guān)規(guī)定,分步驟實現(xiàn)法規(guī)的新舊交替,以避免市場受到擾亂,確保從指令向條例的順利過渡。在過渡期內(nèi),依照IVDD認證的產(chǎn)品和依照IVDR認證的產(chǎn)品可能在市場上共存,二者均享有同等的法律地位,公開招標(biāo)采用的資格標(biāo)準(zhǔn)中不可出現(xiàn)任何歧視。
1.3 分類規(guī)則
IVDR附錄Ⅷ分為實施規(guī)則和分類規(guī)則兩部分,其中實施規(guī)則是對分類規(guī)則的分類依據(jù)、適用原則進行明確,分類規(guī)則部分則匯總了對相同或相似風(fēng)險類型的產(chǎn)品進行歸納并明確其管理類別的具體分類規(guī)則。
1.3.1 實施規(guī)則
實施規(guī)則共計十條,主要分為以下三方面內(nèi)容:
(1)分類依據(jù):分類規(guī)則的實施由器械的預(yù)期用途決定。
(2)器械的配合使用:與器械配合使用的器械(含附件類),分類規(guī)則單獨適用;驅(qū)動或影響器械使用的軟件,與該器械為同一類別,獨立軟件類器械,獨立分類;器械的校準(zhǔn)品類別與該器械相同;定值質(zhì)控品,與對應(yīng)器械類別相同。
(3)分類規(guī)則的適用:綜合考慮所有適用的規(guī)則;器械具有多個預(yù)期用途,使其依據(jù)規(guī)則具有多個管理類別時,按最高類別確定分類;不同規(guī)則適用同一器械,則適用得出最高管理類別的規(guī)則;每條分類規(guī)則均適用于一線試劑、確證試劑和補充試劑。
1.3.2 分類規(guī)則
IVDR附錄Ⅷ以預(yù)期用途為依據(jù),以風(fēng)險分析為思路,對IVD領(lǐng)域產(chǎn)品進行風(fēng)險特征的歸納總結(jié),形成了7條IVD產(chǎn)品分類規(guī)則。
作者基于IVDR附錄Ⅷ及MDCG指導(dǎo)文件,對分類規(guī)則的主要內(nèi)容、分類思路及其起草思路和邏輯進行了總結(jié)分析,列于表2。如表所示,規(guī)則1至規(guī)則5,是以管理類別(風(fēng)險水平)由高到低的順序?qū)VD類產(chǎn)品進行了歸納總結(jié),并對其中分類風(fēng)險點進行了明確。規(guī)則6所表述的是“其他”產(chǎn)品,即不適用規(guī)則1~規(guī)則5的產(chǎn)品;規(guī)則7專用于非定值質(zhì)控品,該類產(chǎn)品在前面的分類規(guī)則及實施規(guī)則中均未涵蓋述及(定值質(zhì)控品的分類在實施規(guī)則中已明確)。
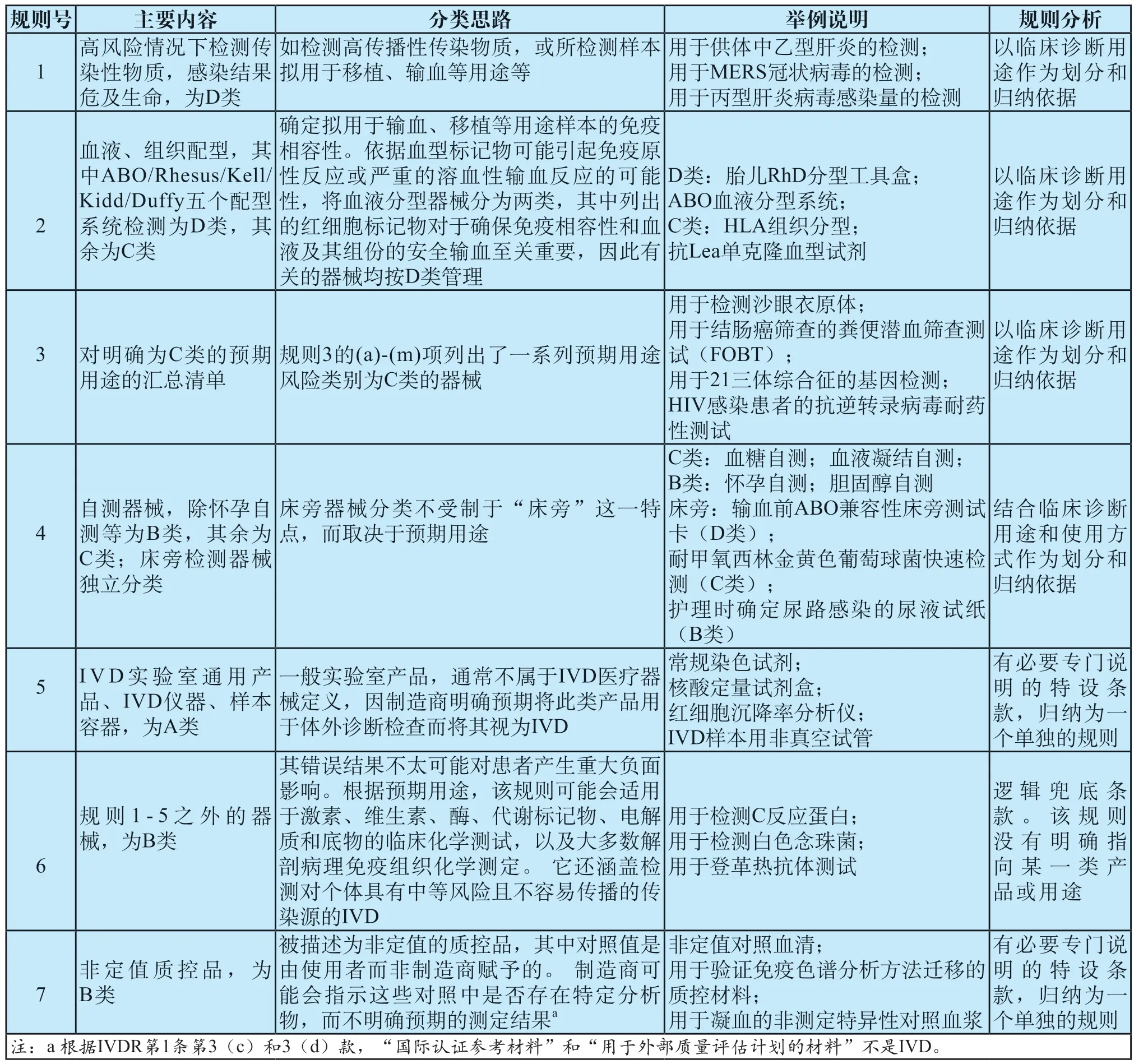
表2 IVDR分類規(guī)則基本情況Tab.2 Overall situation of IVDR classification rules
作為從邏輯上對整個分類系統(tǒng)進行兜底的規(guī)則,規(guī)則6是否囊括所有“其他”產(chǎn)品?新出現(xiàn)的產(chǎn)品類型是否自動按規(guī)則6劃分為B類?筆者認為視情況而定,如IVDR第47條所要求,制造商和公共機構(gòu)的意見出現(xiàn)分歧,或者主管當(dāng)局覺得有必要,均可以由主管當(dāng)局咨詢MDCG之后進行分類及重新分類。
2 分類監(jiān)管體系修訂思路
IVDR分類監(jiān)管體系的分類規(guī)則源自于IMDRF的IVD分類規(guī)則基本框架和思路,細節(jié)方面根據(jù)其監(jiān)管思路做了補充完善,形式和表述則按照IVDR法規(guī)整體起草思路做了修改。該體系的基本分類思路是基于產(chǎn)品的風(fēng)險水平,主要考慮產(chǎn)品所提供的信息對于臨床診斷的重要性,以及檢測結(jié)果的錯誤給公共健康和/或個人健康帶來的危害。
與原有的IVDD清單式分類管理體系相比,IVDR的分類監(jiān)管系統(tǒng),具有以下幾方面特點:
(1)在歐盟這一醫(yī)療器械最大的銷售市場和生產(chǎn)商聚集地率先接軌和實踐國際監(jiān)管思路(IMDRF的IVD分類思路尚未在中美日等國家引入),體現(xiàn)了其修訂法規(guī)的一個重要目標(biāo)——保持國際器械監(jiān)管者先行者地位;
(2)從具體化的清單制走向原則化的規(guī)則制,這一變革中既有大量新產(chǎn)品類型的補充,又有產(chǎn)品風(fēng)險分析思路和監(jiān)管原則的歸納精煉,更加利于適應(yīng)高速、高效率且復(fù)雜化的行業(yè)發(fā)展新趨勢,有力地呼應(yīng)了其法規(guī)修訂的另一出發(fā)點——適用行業(yè)和科技發(fā)展速度;
(3)通過分類監(jiān)管體系的整體調(diào)整,根本上實現(xiàn)了歐盟整體提高IVD產(chǎn)品監(jiān)管要求的工作思路,B類/C類/D類產(chǎn)品的符合性評估均需要公告機構(gòu)的認證,D類產(chǎn)品還需要歐盟參考實驗室的驗證,與IVDD中僅清單A和清單B所列產(chǎn)品需要公告機構(gòu)認證相比,相當(dāng)大比例產(chǎn)品的監(jiān)管要求趨于嚴(yán)格,體現(xiàn)了歐盟加強監(jiān)管,重塑、增強市場對歐盟器械監(jiān)管體系信心的初衷;
(4)IVDR作為可在成員國直接適用的法規(guī),歐盟在其中正文和附錄中明確了分類監(jiān)管體系的相關(guān)要求和規(guī)則,并且由MDCG編寫并發(fā)布了詳盡的規(guī)則解讀指南,有利于提高規(guī)則的可行性,避免原有法規(guī)的其中一個弊端——各執(zhí)行方的解讀分歧;
(5)床旁診斷、伴隨診斷、一線試劑、確證試劑、補充試劑等概念的系統(tǒng)引入及其針對性監(jiān)管要求的明確,及時地納入了行業(yè)發(fā)展新動態(tài)和,體現(xiàn)了監(jiān)管新思路;
(6)歐盟參考實驗室、MDCG等歐盟層面監(jiān)管輔助機構(gòu)的建立和運行,一定程度上體現(xiàn)了歐盟整體層面的管理水平提高和管理組織強化。
3 借鑒意義
目前,我國的IVD產(chǎn)品分類監(jiān)管體系,采取的是規(guī)則與目錄結(jié)合的形式。現(xiàn)行的IVD產(chǎn)品分類規(guī)則,來自2014年版《體外診斷試劑注冊管理辦法》(國家食品藥品監(jiān)督管理總局令第5號)[5],其中對IVD產(chǎn)品分類規(guī)則進行了明確表述,按風(fēng)險程度高低,對第一類(2類情形)、第三類(8類情形)產(chǎn)品的產(chǎn)品類型進行了歸納,其他產(chǎn)品則劃為第二類,此外,還對規(guī)則特殊情況進行了規(guī)定。2017年,食藥總局發(fā)布《體外診斷試劑注冊管理辦法修正案》(國家食品藥品監(jiān)督管理總局令第30號)[6],對分類程序相關(guān)條款的內(nèi)容進行了調(diào)整。目錄部分,則以《6840體外診斷試劑分類子目錄(2013版)》為基礎(chǔ),根據(jù)監(jiān)管實踐進行動態(tài)調(diào)整,2017年《總局關(guān)于過敏原類、流式細胞儀配套用、免疫組化和原位雜交類體外診斷試劑產(chǎn)品屬性及類別調(diào)整的通告(2017年第226號)》、2020年《國家藥監(jiān)局關(guān)于調(diào)整,〈6840體外診斷試劑分類子目錄(2013版)〉部分內(nèi)容的公告(2020年 第112號)》兩次發(fā)文對子目錄部分內(nèi)容進行調(diào)整,補充細化了部分品種,同時對部分產(chǎn)品的管理類別進行了調(diào)整,如2020年112號文[7]中將29個Ⅲ類產(chǎn)品的管理類別調(diào)為了Ⅱ類。綜上所述,我國IVD產(chǎn)品的分類監(jiān)管體系一直以來都采取規(guī)則指導(dǎo)下的分類目錄制,結(jié)合監(jiān)管需求和經(jīng)驗進行適時的動態(tài)調(diào)整。
我國和歐盟的醫(yī)療器械監(jiān)管法規(guī)體系和執(zhí)行系統(tǒng)在整體上都存在一定差異,因此各自選取了適應(yīng)其監(jiān)管需要的IVD分類監(jiān)管體系。雖然在具體操作層面存在差異,作者認為歐盟本次法規(guī)修訂工作中的一些思路,仍然對我國IVD分類監(jiān)管體系持續(xù)完善工作具有借鑒意義:
(1)注重與國際監(jiān)管思路的接軌,以利于促進行業(yè)及產(chǎn)品的國際化發(fā)展;
(2)高度概括性的分類規(guī)則的歸納總結(jié),有利于監(jiān)管體系具有較強的靈活性和較大的操作空間,以及更為寬泛的容納性,結(jié)合適時地補充更新,能更好地適應(yīng)行業(yè)發(fā)展速度;
(3)規(guī)則作為概括性的原則文件,協(xié)調(diào)各個執(zhí)行方以取得一致的解讀,是保障規(guī)則實施效果的關(guān)鍵點;
(4)目錄或清單,作為規(guī)則或原則的具體化文件,其優(yōu)勢在于內(nèi)容具體,操作性強,易于執(zhí)行,但表述的具體化也使其靈活性相對較差,滯后性較明顯,易落后于新業(yè)態(tài)新趨勢,因此該類系統(tǒng)需注重動態(tài)調(diào)整,以適應(yīng)變化;
(5)基于行業(yè)對現(xiàn)有法規(guī)的適應(yīng)情況與法規(guī)執(zhí)行實際效果,及時從整體層面進行調(diào)整,對保持監(jiān)管體系有效運行有重要意義,就像本次IVDR整體提高了IVD大批產(chǎn)品的監(jiān)管要求。

