雙酚B對斑馬魚性別分化的影響及作用機制
楊倩,劉建梅,丁潔,陳麗紅
1. 南京財經大學食品科學與工程學院,南京 210023 2. 江蘇雅信昆成檢測科技有限公司,南京 210034 3. 南京中醫藥大學藥學院,南京 210023
雙酚A(bisphenol A, BPA)是生產量最大的化工原料之一,廣泛用于食品包裝材料、奶瓶、水杯以及其他數百種日用品的制造過程[1]。作為一種典型的內分泌干擾物,全球許多國家和地區都出臺了法律法規限制BPA的使用。為了應對管控措施和市場需求,一些結構與BPA類似、可耐受較高溫度的化合物被開發用來替代BPA,如雙酚F(bisphenol F, BPF)、雙酚S(bisphenol S, BPS)和雙酚B(bisphenol B, BPB)等。其中,BPB常用于制造酚醛樹脂,并在多種環境介質[2-3]、食品[4-6]、日常消費品[7]、人體尿液[8]和血液[9]中被檢測到,表明人類可能通過多種途徑暴露于BPB。雖然BPB的檢出頻率和濃度略低于BPF和BPS,但是BPB具有更高的生物蓄積性和難生物降解性[10-11],因此仍具有潛在的環境和健康危害。

圖1 雙酚A(BPA)和雙酚B(BPB)的分子結構圖Fig. 1 Chemical structures for bisphenol A (BPA) and bisphenol B (BPB)
由于BPB的結構與BPA類似,預計可能對生物系統產生同樣的毒性效應。一些體內外實驗及模型計算結果表明,BPB甚至具有比BPA更強的雌激素效應及抗雄激素效應。在體外測試中,Kitamura等[12]發現BPB的雌激素和雄激素活性均比BPA更強。Yang等[13]構建了用于雙酚A類似物抗雄激素效應的QRSA預測模型,發現BPB的抗雄激素活性與BPA具有相同的數量級。目前為止,針對BPB的體內實驗研究還比較有限,Ullah等[14]研究發現,BPB對成年大鼠暴露28 d,能夠抑制垂體促性腺激素的分泌,表現出雌激素和抗雄激素的作用,誘導睪丸組織的氧化應激,并引起精巢結構的改變。我們之前的研究表明,斑馬魚成魚暴露于BPB 21 d能夠對斑馬魚的性腺發育造成損傷,擾亂性激素的平衡[15]。環境中污染物的暴露是長期慢性暴露過程,目前針對BPB慢性暴露的研究還比較缺乏,尤其是針對魚類性別分化這一關鍵時期的暴露。
魚類的性別決定和性別分化,受到多種因素的影響,包括遺傳基因、環境因素(如溫度、pH值)和類固醇激素等。類固醇激素在性分化過程中起到重要的作用,任何外源性激素對類固醇激素造成的改變都會導致斑馬魚出現部分甚至完全的性別偏離[16]。例如,BPA和BPS在對斑馬魚從胚胎期開始暴露后,均造成發育異常、胚子形成中斷以及性別比例失衡等現象[17-19],而20 mg·L-117β-雌二醇(17β-estradiol, E2)暴露直接造成了斑馬魚的完全雌性化[20]。但是,影響斑馬魚性別分化的具體的作用機制尚不清晰,此外,污染物對斑馬魚性分化期間不同階段的影響研究也比較缺乏。
本研究將斑馬魚從胚胎時期開始暴露于BPB中,研究BPB在性分化啟動前、性分化期以及性分化結束后,對芳香化酶及性分化相關關鍵轉錄因子的影響,并結合性別比例、性腺組織病理學和激素水平的變化情況,探討BPB對斑馬魚性分化影響的作用機制,為BPB潛在的風險評價提供科學依據。
1 材料與方法(Materials and methods)
1.1 材料與試劑
雙酚B,CAS號77-40-7,純度>98%,美國J&K公司;焦碳酸二乙酯(diethyl pyrocarbonate, DEPC)處理過并經高溫高壓滅菌的超純水(DEPC水),B.R.級,上海杰瑞生物工程有限公司;雌二醇酶聯免疫試劑盒、睪酮酶聯免疫試劑盒,96T,武漢艾博伊科技有限公司;RNA Later,C.P.級,美國賽默飛世爾科技公司;Trizol試劑,美國英杰生命技術有限公司;ReverTra Ace?qPCR RT Master Mix with gDNA Remover試劑盒(200次),東洋紡(上海)生物科技有限公司;Sso fast EvaGreen Supermix,美國伯樂公司;甲醇、乙醇和乙腈均為色譜純,德國Merck公司;水為Milli-Q超純水。
1.2 儀器與設備
顯微鏡(DM2500,德國Leica公司),冷凍離心機(2-16PK,美國Sigma公司),生態培養箱(CLIMACELL型,德國MMM公司),高效液相色譜串聯質譜儀(LC-Agilent Technologies 1290 Infinity,MS-AB SCIEX QTRAP 4500),熒光定量PCR儀(CFX96TMOptics型,美國Bio-Rad公司),酶標儀(Infinite M200型,瑞士TECAN公司),核酸蛋白分析儀(DU800SERIES,美國Sigma公司),多功能水質參數測定儀(HQ40d,美國HACH公司),電熱恒溫培養箱(INNOVA?43,鄭州南北儀器設備有限公司)、旋轉蒸發儀(R-210,B-491,V-850,瑞士BUCHI公司)。
1.3 實驗方法
1.3.1 斑馬魚馴化和胚胎收集
四月齡野生成年斑馬魚(AB型)購于中國科學院武漢水生生物研究所,并在實驗室斑馬魚養殖系統中養殖并繁殖了3代以上。系統運行期間,光照/黑暗周期設定為16 h∶8 h(光照∶黑暗),維持溫度在26 ℃±1 ℃,每天定時投喂豐年蝦2次。雌魚和雄魚在光照刺激下交配產卵,收集質量高的胚胎,置于26 ℃恒溫光照培養箱中待用。
1.3.2 暴露實驗
使用前將BPB用二甲基亞砜(DMSO)配制成10 000 mg·L-1的貯備液,儲存于4 ℃,實驗中所用相應濃度的暴露液用斑馬魚養殖水稀釋,保證暴露液中的DMSO含量不超過溶液體積的0.01%(V/V)。
BPB對斑馬魚性分化階段的毒性實驗的濃度設置分別為1、10、100和1 000 μg·L-1,同時設置空白對照組。每個濃度設置3個平行,每個平行隨機放置500粒發育正常的受精卵于500 mL暴露液中,暴露周期為60 d,在暴露期間,設置溫度為26 ℃,光照周期為16 h∶8 h(光照∶黑暗),光照強度50 lux。試驗期間,每48 h更換75%的暴露溶液,并清洗容器。從第10天開始,將幼魚轉移至20 L的玻璃缸內,并置于恒溫流水式水浴槽內以保持穩定的溫度(26 ℃±1 ℃),設置光照周期為16 h∶8 h(光照∶黑暗)。在第20天,將缸內魚的數量調整為每缸100條;第30天,調整為每缸40條。暴露期間,定期對魚進行取樣以分析性分化及性別決定基因,具體取樣階段及每個平行的采集數量如下:10 dpf(n=20尾),20 dpf(n=20尾),30 dpf(n=10尾),42 dpf(n=5尾)。所取幼魚置于RNAlater中,保存于-20 ℃冰箱,用于接下來的RNA提取實驗。在60 d暴露結束后,在每個平行中隨機挑選雌雄魚各6條,置于-80 ℃保存,用于激素水平的測定。另外,每個濃度中隨機挑選出50條魚解剖取性腺,進行性腺組織學分析,并計算性別比例。
1.3.3 暴露溶液中BPB的化學分析
為了確定暴露溶液中BPB的實際濃度,在暴露第1天溶液配制好加入魚缸后(0 h)和換水前(48 h)這2個時間點收集暴露溶液,采用液相色譜串聯質譜儀進行分析,以表征暴露溶液在試驗期間的變化情況。水樣的處理和凈化方法、液相色譜條件和質譜條件見陳玫宏等[21]的研究。
1.3.4 性腺組織學分析和性別比例
暴露60 d后,隨機收集50條魚,置于冰上,凍僵后解剖取性腺制備石蠟切片,用電子顯微鏡拍照進行性腺組織學分析及性別比例鑒定。
1.3.5 激素水平分析
暴露結束后每個平行各取6條雌魚和雄魚用于性激素水平的測定,分別將每條魚的頭和尾部切下后,每個平行中雌魚的頭尾合并作為雌性組,雄魚的頭尾合并作為雄魚組,加入預冷的勻漿緩沖液和蛋白酶抑制。用勻漿器充分勻漿后收集上清液并分裝,置于-80 ℃保存直至采用酶聯免疫吸附法進行E2和睪酮(testosterone, T) 2種性激素水平的測定。使用魚類E2和T試劑盒(武漢艾博伊科技有限公司)進行分析。
1.3.6 基因轉錄水平分析
對暴露不用階段所采集的魚樣進行性分化相關基因水平的測定。采用Trizol試劑,嚴格按照說明書的要求提取總RNA,獲得的RNA溶液分裝后置于-80 ℃冰箱待用。采用ReverTra Ace?qPCR RT Master Mix with gDNA Remover試劑盒對所提取的RNA進行反轉錄,合成cDNA。所合成的cDNA樣品保存于-20 ℃,進行熒光定量PCR時,作為模板直接或稀釋后添加。
實時熒光定量PCR反應在BIO-RAD公司的CFX96TMOptics儀器上進行,根據SYBR Green PCR kit說明書操作。實驗中所采用的目標基因和管家基因相關引物信息如表1所示。引物信息根據引物設計標準,用Primer Premier 5.0軟件設計。
1.3.7 數據處理
實時熒光定量PCR的調控倍數是以管家基因β-actin作為內參基因,以空白對照組進行標準化,采用2-ΔΔCT方法計算所得[22]。采用IBM SPSS 9進行統計學分析。基因轉錄水平在暴露組和空白對照組之間的差異性采用單因素方差分析。當P<0.05表示暴露組與對照組之間具有顯著性差異。
2 結果(Results)
2.1 暴露溶液中BPB的實際濃度分析
在暴露期間,空白對照中的BPB濃度低于檢出限;BPB在試驗開始時(0 h)和換水前(48 h)的實測濃度均無較大差異,除了1 μg·L-1濃度組外,所有實測濃度都非常接近所設置的名義濃度(表2),說明這BPB在胚胎暴露實驗中濃度保持相對穩定。為了方便敘述,所有暴露濃度均以所設置的名義濃度來敘述。
2.2 性腺組織學分析和性別比例
暴露60 d后,隨機從各個濃度組中挑選出50條魚進行性腺組織學檢查,以研究化合物暴露對性腺發育的損傷以及對性別比例的影響。BPB處理后,斑馬魚的精巢和卵巢的組織變化情況如圖2和圖3所示。由圖2可知,發育正常的精巢中,均含有各個發育時期的精細胞,包括精原細胞(S)、早期精母細胞(ES)、晚期精母細胞(LS)、精子(SZ)和精細胞(SPs)5個階段,不同發育階段的精母細胞排列整齊。但是,在100 μg·L-1和1 000 μg·L-1的BPB處理后,出現了精小囊排列不規則,非細胞區域增大的現象,同時出現了發育異常的精巢-卵精巢,即在一些精巢中出現了不同發育時期的卵母細胞,直徑為30~50 μm(圖2(a)、(c)、(e)、(f)),在100 μg·L-1和1 000 μg·L-1濃度組,卵精巢出現的比例分別為12%和18%。
發育正常的雌魚的卵巢中,同時存在4個階段的卵母細胞,包括卵黃發生前期卵母細胞(Ⅰ和Ⅱ)、卵黃發生期卵母細胞(Ⅲ)、卵黃發生后期卵母細胞(Ⅳ)(圖3)。與對照組相比,經100 μg·L-1和1 000 μg·L-1BPB暴露時,卵巢中卵黃發生前期卵母細胞(Ⅰ)出現的比例遠遠高于其余3個階段的卵母細胞(圖3),而在1 000 μg·L-1濃度組,觀察到一些卵巢中只有卵原細胞和卵黃發生前期卵母細胞(圖3(c)),說明卵母細胞的發育受到了抑制。
BPB對斑馬魚性別比例的影響如表3所示,BPB暴露導致斑馬魚呈現雌性化的趨勢,并出現雌雄間體的現象。10 μg·L-1及以上濃度BPB暴露后,斑馬魚雌魚數量開始增多,在100 μg·L-1和1 000 μg·L-1濃度中呈現出較為顯著的雌性化趨勢,并且能夠觀察到雌雄間體的現象(出現的頻次分別為12%和18%)。
2.3 BPB暴露對激素水平的影響
BPB對斑馬魚暴露60 d后,雌魚和雄魚的性激素水平出現了不同程度的改變(圖4)。對于雄魚,在10、100和1 000 μg·L-1的BPB暴露組,T水平分別降低了31.86%、49.54%和60.28%,而雌魚的T水平分別降低了36.13%、47.81%和56.24%,雄魚和雌魚體內的E2水平分別升高了50.55%、89.57%、103.44%和40.74%、51.64%、63.84%,并最終導致了T與E2的比值的顯著性降低,并呈現出明顯的劑量-效應關系,說明BPB對斑馬魚的性激素平衡具有擾亂作用。

表1 性分化相關基因的引物序列信息Table 1 Sequences of primers for the genes of sex differentiation

表2 暴露過程中BPB的名義濃度和實測濃度Table 2 The nominal and measured concentrations of BPB

圖2 BPB暴露至60 dpf的雄性斑馬魚精巢組織切片圖(HE染色)注:(a)空白對照組精巢(10×);(b)100 μg·L-1 BPB暴露組精巢(10×);(c)1 000 μg·L-1 BPB暴露組精巢(10×); (d)空白對照組精巢(20×);(e)100 μg·L-1 BPB暴露組精巢(20×);(f)1 000 μg·L-1 BPB暴露組精巢(20×); a.精原細胞,b.早期精母細胞,c.晚期精母細胞,d.精子,e.精細胞,f.卵黃發生前期卵母細胞,g.卵黃發生后期卵母細胞。Fig. 2 Histology of testis from male zebrafish after BPB exposure until 60 dpf (hematoxylin and eosin (HE) stain)Note: (a) testis from a control male (10×); (b) 100 μg·L-1 BPB exposed zebrafish (10×); (c) 1 000 μg·L-1 BPB exposed zebrafish (10×); (d) testis from a control male (20×); (e) 100 μg·L-1 BPB exposed zebrafish (20×); (f) 1 000 μg·L-1 BPB exposed zebrafish (20×); a. spermatogonia; b. early spermatocyte; c. late spermatocyte; d. spermatids; e. spermatozoa; f. pre-vitellogenic stage oocyte; g. late-vitellogenic stage oocyte.
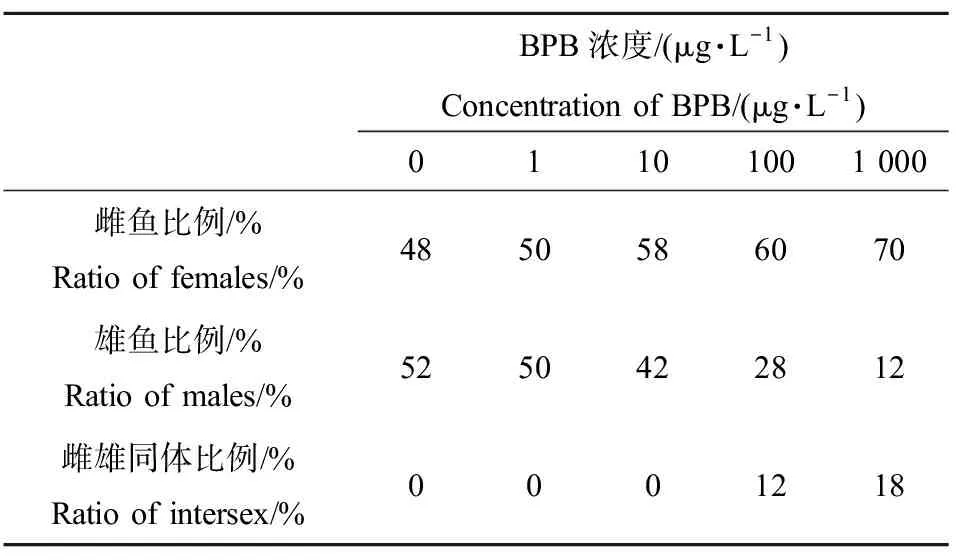
表3 BPB暴露對60 dpf斑馬魚性別比例的影響Table 3 Sex ratios of 60 dpf zebrafish exposed to BPB
2.4 BPB暴露對斑馬魚性分化相關基因轉錄水平的影響
BPB暴露后,性分化相關基因轉錄水平的變化情況如圖5所示,由圖5可知,在暴露第10天,1 000 μg·L-1的BPB使cyp19a1a的水平上調至對照組的1.89倍(圖5(a)),但是導致dmrt1和sox9a的轉錄水平分別降低至對照組的0.8倍和0.48倍(圖5(e))。暴露第20天,1、10、 100 和1 000 μg·L-1的BPB暴露組均使foxl2的轉錄水平顯著提高(分別上調至對照組的2.24倍、2.02倍、1.63倍和2.98倍)(圖5(f));10 μg·L-1以上濃度的BPB暴露導致cyp19a1a的水平顯著性提高,并呈現出明顯的劑量-效應關系,其中1 000 μg·L-1濃度組使cyp19a1a的水平提高至對照組的3.56倍(圖5(a)),而1 000 μg·L-1濃度組顯著降低了dmrt1、amh和sox9a的表達水平(分別降低至對照組的0.54倍、0.48倍和0.43倍)(圖5(b)~5(e))。暴露第30天,4個濃度組均顯著提高了foxl2的轉錄水平(圖5(f)),而10 μg·L-1以上濃度的BPB導致cyp19a1a轉錄水平顯著性升高(圖5(a)),這2個基因的表達水平均呈現良好的劑量-效應關系;在100 μg·L-1和1 000 μg·L-1BPB暴露下,dmrt1、amh和sox9a的表達水平均顯著性降低至對照組的0.5倍以下。暴露第42天,cyp19a1a和foxl2在4個濃度組的處理下,轉錄水平均顯著升高(圖5(a)和5(f)),而在10 μg·L-1以上濃度時,amh的轉錄水平顯著降低,最低達到對照組的0.38倍;1 000 μg·L-1BPB使dmrt1和sox9a的表達水平分別顯著性降低至對照組的0.38倍和0.3倍。

圖3 BPB暴露至60 dpf的雌性斑馬魚卵巢組織切片圖(HE染色)注:(a)空白對照組卵巢(10×);(b)100 μg·L-1 BPB暴露組卵巢(10×);(c)1 000 μg·L-1 BPB暴露組卵巢(10×); a.卵原細胞;b.卵黃發生前期卵母細胞;c.卵黃發生期卵母細胞;d.卵黃發生后期卵母細胞。Fig. 3 Histology of ovary from female zebrafish after BPB exposure until 60 dpf (HE stain)Note: (a) ovary from a control female (10×); (b) 100 μg·L-1 BPB exposed zebrafish (10×); (c) 1 000 μg·L-1 BPB exposed zebrafish (10×); a. oogonia; b. pre-vitellogenic stage oocyte; c. vitellogenic stage oocyte; d. late-vitellogenic stage oocyte.

圖4 BPB暴露至60 dpf對斑馬魚性激素水平的影響注:T表示睪酮,E2表示雌二醇;結果以3次重復的平均值±SD 表示;*表示暴露組與對照組之間具有顯著性差異(P<0.05)。Fig. 4 Effects of BPB exposure until 60 dpf on steroid hormone concentrations of zebrafishNote: T stands for testosterone; E2 stands for 17β-estradiol; the results are shown as mean±SD of three replicates; asterisk indicates significant difference from control (P<0.05).
3 討論(Discussion)
本研究將斑馬魚胚胎暴露于BPB溶液中至60 dpf,暴露期結束后,從性腺切片圖中可以看出,從10 μg·L-1開始,隨著BPB暴露濃度的增加,斑馬魚的性腺發育受到抑制,且雌魚的比例不斷上升,呈現了雌性化的趨勢,說明BPB在性分化的關鍵期暴露發揮了雌激素效應,并呈現出劑量依賴效應。同樣的性腺發育異常現象在BPA及其類似物的暴露中也被觀察到,10 μg·L-1BPA暴露導致日本青鳉的雌魚比例高于雄魚,并且在此濃度出現雌雄間體的現象[18],而BPS和BPF也在10 μg·L-1時引起斑馬魚雌性比例的升高[19,23],與本研究中出現性別比例失衡的起始濃度相同。而BPB對斑馬魚成魚的暴露也導致了精巢和卵巢發育的異常[15],進一步說明BPB暴露會對繁殖系統造成損傷。目前為止,污染物對斑馬魚的性別分化影響的具體機制尚不清晰,但是研究表明,性激素對魚類性腺發育起至關重要的作用,是性腺發育和成熟的重要調控因子[24],而芳香化酶是性激素合成過程中的關鍵酶,在維持魚體性激素的平衡以及調控性別分化起到至關重要的作用[25]。內源性類固醇激素的合成受到外源性激素的干擾時,會對性腺分化產生影響或損傷,可能會引起雌雄間體現象或其他性腺發育異常狀況,從而改變魚類的性別比例,導致性別失衡現象,例如,魚類在早期性分化階段暴露于雌激素類物質會導致雌性化趨勢,而雄激素類物質會引起性別比例偏向于雄魚[26]。對斑馬魚性激素水平的檢測進一步證實,BPB暴露導致了斑馬魚雌激素水平升高以及雄激素水平下降,并影響了斑馬魚性激素的平衡。通過對芳香化酶基因的測定發現,從在性分化期之前(10dpf),1 000 μg·L-1BPB即升高了cyp19a1a的基因表達,而性分化期啟動(20 dpf)開始后,10 μg·L-1BPB即能夠顯著提高cyp19a1a基因在整個性分化期的表達。由此我們推測,BPB暴露后,上調了cyp19a1a的轉錄水平,促進了雌激素的合成,而性激素水平的改變抑制了雄魚非功能性卵巢的退化以及精巢分化的啟動與維持,導致出現雌雄間體甚至完全的性別逆轉為雌性的現象,進一步造成了性別比例偏向于雌性。

圖5 BPB暴露對斑馬魚性分化相關基因轉錄水平的影響注:結果以3次重復的平均值±SD表示,*表示暴露組與對照組之間具有顯著性差異(P<0.05)。Fig. 5 Effects of BPB on expression of genes involved in the sex differentiation and determination of zebrafishNote: The results are shown as mean±SD of three replicates; asterisk indicates significant difference from control (P<0.05).
雖然對于斑馬魚而言,目前尚未發現能夠直接決定性別的基因,但是在性分化過程中,有多個轉錄因子在性分化和芳香化酶調節中發揮重要作用,包括dmrt1、amh、ff1b、sox9a和foxl2等,因此,通過對這些基因轉錄水平的評估,可以進一步研究BPB使斑馬魚產生雌性化的分子機制。
dmrt1、amh、ff1d和sox9a都在睪丸中高度表達,而在雌魚和卵巢中表達量很少,在魚類精巢分化和發育中發揮重要作用[27-29]。本研究發現,BPB暴露后,從第10天開始即檢測到dmrt1和sox9a基因表達水平的顯著性下調(1 000 μg·L-1),從第20天開始,amh的表達量也出現降低的趨勢,我們推測在20 d之前,雖然斑馬魚表觀的性別分化還沒開始,但是在分子機制上已經啟動,并且dmrt1和sox9a對類雌激素的暴露非常敏感。在其他內分泌干擾物的暴露中也觀察到了類似的現象,比如性分化期的斑馬魚幼魚暴露于E2后,其dmrt1的基因表達水平下調,幼魚的精巢分化受到抑制或延遲,但是dmrt1水平的改變是在第28天被檢測到[30]。此外,dmrt1、amh、ff1d和sox9a跟cyp19a1a具有負調控的關系[31-33],在本文中,dmrt1和sox9a的表達水平從10 d開始下降,與cyp19a1a升高的變化趨勢一致,進一步證實了dmrt1、sox9a與cyp19a1a之間的負調控關系。
foxl2在斑馬魚卵巢的正常分化中起非常重要的作用,是卵巢分化的標志性啟動因子。FOXL2蛋白可以上調cyp19a1a的轉錄水平,從而調控雌激素的生成[34];而雌激素又可誘導foxl2在早期生活中的表達,并進一步觸發魚類從雄性到雌性的性別逆轉[34-35]。在本研究中,BPB表現出的類雌激素效應誘導了foxl2基因表達量的上升,而上調的foxl2一方面直接導致了斑馬魚從基因型雄性向表型雌性的逆轉,另一方面促進了芳香化酶的表達,進一步證明了斑馬魚體內雌激素與foxl2的表達之間的直接聯系。此外,從結果來看,在性分化過程中,1 μg·L-1BPB即可引起foxl2表達水平的改變,效應劑量比cyp19a1a更低,因此我們推測,foxl2是比cyp19a1a對BPB更敏感的標志物。
綜上所述,BPB對斑馬魚從受精開始暴露至性分化期結束后,抑制了精巢發育相關基因sox9a、amh和dmrt1的表達水平,上調了卵巢發育相關基因foxl2的轉錄水平,導致了cyp19a1a水平的高度表達,促進了雄激素向雌激素的轉化,從而提高了斑馬魚體內雌激素水平,降低了雄激素水平,繼而導致斑馬魚在性別分化時發生異常,出現了部分甚至完全的性別逆轉,以及性別比例偏向于雌性化的現象。

