稻蝦共育田酰胺類除草劑脅迫對克氏原螯蝦幼蝦生長發育的影響
王守紅,吳雷明,楊顯祥,韓光明,張家宏,*,寇祥明,王曙光,李兵
1. 江蘇里下河地區農業科學研究所,揚州 225007 2. 揚州市水產生產技術指導站,揚州 225003 3. 江蘇普興循環農業發展有限公司,揚州 225654 4. 揚州市龍道生態農業有限公司,揚州 225615
稻田養漁最早記載于1 700年前的中國,目前已經成為中國、印度、日本及很多東南亞國家食物保障的重要水產養殖模式之一[1]。稻田養漁是種植業與養殖業有機結合的高效生態農業生產方式,是以提高稻田產出率并保持稻田良性生態環境為目的的一種生產模式。目前,我國是世界上稻田養漁面積最大的國家,并逐步出現了集約化、規模化、專業化、產業化、品牌化、產品向綠色、有機農產品方向發展的趨勢[2]。水稻與魚類互利互惠的生態學原理是稻田養漁復合系統的基礎,兩者結合促進了系統經濟效益和環境效益的提升[3-4]。稻田綜合種養模式與當地的文化、經濟以及生態環境相結合,在保護當地生物多樣性和維持農業可持續發展方面扮演著重要角色[5]。
水稻種植與水產養殖互利共惠的同時,兩者不同的生產要素和需求無可避免會產生矛盾,稻田農藥的環境行為就是其中之一[6-7]。水產動物的生命活動對水稻的病蟲草害有一定的生物防治效果。稻漁綜合種養模式中稻飛虱和紋枯病病株發病率分別降低44.74%和54.35%[8],稻蟹綜合種養模式對雜草的防控效率為26.53%~44.33%[9]。在旱改水的稻蝦共作模式下,通過蝦群活動控制田間雜草的危害,總體效果可達94.03%,而在水稻連作模式下的稻蝦共作直播田,雜草發生量大,特別是千金子的危害難以控制[10]。綜上所述,稻漁綜合種養模式下,水產養殖動物并不能完全起到防控病蟲草害的作用,仍需輔助化學防除、物理防控和生態防控等預防措施[11]。
稻田-克氏原螯蝦(Procambarusclarkia)生態種養模式,是我國克氏原螯蝦主要養殖方式之一[12]。如何解決水稻病蟲害防治與克氏原螯蝦養殖之間的矛盾[13],即如何預防常用農藥對克氏原螯蝦的毒性效應是確保稻蝦綜合種養模式正常生產的關鍵之一。酰胺類除草劑發展迅速,產量逐年增長,在各類除草劑中名列第4位,僅排在氨基酸類、磺酰脲類和有機磷除草劑之后[14-15]。丙草胺和丁草胺作為稻田廣泛應用的酰胺類芽前除草劑,主要用于防除禾本科雜草,具有高效性、選擇性[7]。本文以克氏原螯蝦幼蝦為試驗對象,研究了丙草胺和丁草胺2種酰胺類除草劑對克氏原螯蝦生長發育的影響,以期全面評價酰胺類除草劑在稻蝦綜合種養模式中的環境安全,并指導農藥合理使用。
1 材料與方法(Materials and methods)
1.1 試驗對象
克氏原螯蝦幼蝦來源于江蘇普興循環農業有限公司。選擇規格整齊、附肢齊全、活動能力強的克氏原螯蝦幼蝦為試驗對象,其平均體質量為(4.84±0.46) g。
1.2 試驗藥品
丙草胺有效成分含量為500 g·L-1,助劑成分為乳油,凈含量0.07 L,生產廠家為先正達(蘇州)作物保護有限公司;丁草胺有效成分含量為50%,助劑成分為乳油,凈含量0.26 L,生產廠家為山東勝邦綠野化學有限公司。
1.3 養殖管理
幼蝦暫養10 d,使其適應小水體環境,降低應激反應。試驗采取靜水試驗法[16],即采用一次性投藥,不更換藥水方式。設置對照組、丙草胺和丁草胺3個處理,每個處理設置3個重復,每個重復投放15尾。試驗過程中丙草胺和丁草胺藥物制劑濃度按照稻田常規劑量計算(丙草胺0.0021 mL·L-1;丁草胺0.0045 mL·L-1),藥物有效含量分別為1.05×10-3g·L-1和0.0023 mL·L-1。為降低殘餌和糞便對養殖水體的污染,正式試驗開展前1 d,停止投喂,于第6天取樣結束后開始恢復投喂,按照幼蝦體質量的1%計算投喂量(少量投喂),投喂頻率為每3 d投喂1次。如養殖過程中存在少量殘餌,禁止撈出,減少試驗藥品投入總量的損失。日常記錄幼蝦死亡、蛻殼等情況。養殖水族箱容量為70 L,養殖水體為10 L,持續增氧。
1.4 樣品采集
取樣時間點為1、3、6、11和17 d。每個處理隨機選取6只幼蝦,首先采用電子天平測量體質量,隨后立即進行解剖,取幼蝦肝胰腺樣品急凍低溫保存。樣品加0.85%生理鹽水進行冰浴勻漿離心,取上清液,于4 ℃下保存用于后續分析,樣品于24 h內分析完成。一部分用于測定胰蛋白酶、淀粉酶和脂肪酶活性,另一部分用于測定超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、丙二醛(MDA)、谷胱甘肽過氧化物酶(GPx)活性及總抗氧化力(T-AOC)。取樣前24 h停止投喂飼料,使腸道內容物排空。消化酶和抗氧化酶活性均采用南京建成生物工程研究所生產的試劑盒測定。
1.5 數據統計分析
采用SPSS18.0軟件進行描述性統計及多重比較(Duncan)等分析,P<0.05表示差異顯著,P>0.05表示無顯著性差異。
2 結果(Results)
2.1 酰胺類除草劑對克氏原螯蝦生長的影響
酰胺類除草劑對克氏原螯蝦生長的影響如圖1所示。第1天至第6天,丙草胺組和丁草胺組克氏原螯蝦體質量與對照組之間無顯著性差異(P>0.05)。第11天和第17天,對照組克氏原螯蝦體質量顯著高于丙草胺組和丁草胺組(P<0.05)。丙草胺組與丁草胺組克氏原螯蝦體質量在各取樣時間點均無顯著性差異(P>0.05)。丙草胺組和丁草胺組克氏原螯蝦體質量顯著低于初始值的時間為第11天(P>0.05),對照組為第17天。丙草胺組和丁草胺克氏原螯蝦蛻殼累計次數分別為5次和4次,對照組幼蝦無蛻殼現象。整個試驗養殖過程中,除丁草胺組1只幼蝦因蛻殼被殘食外,各組幼蝦均無死亡個體。
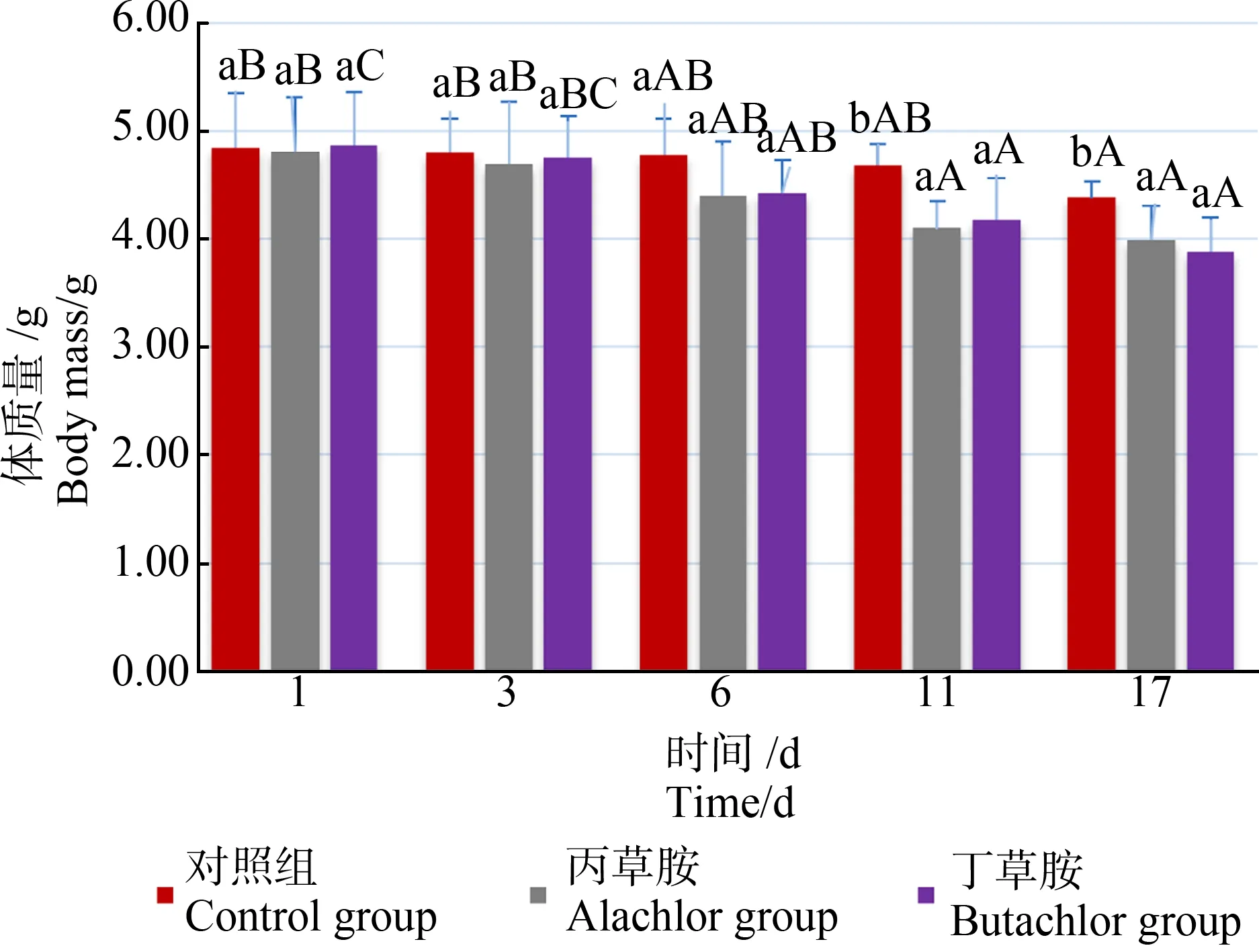
圖1 酰胺類除草劑對克氏原螯蝦幼蝦生長的影響注:不同小寫字母表示同一時間不同處理組差異顯著(P<0.05); 不同大寫字母表示同一處理組不同時間差異顯著(P<0.05)。Fig. 1 Effect of amide herbicide on growth of Procambarus crustacean juvenileNote: Different lowercase letters mean significant differences among different treatments at the same time (P<0.05); different uppercase letters mean significant differences among the same treatments at different time (P<0.05).
2.2 酰胺類除草劑對克氏原螯蝦消化酶活性的影響
酰胺類除草劑對克氏原螯蝦幼蝦消化酶活性的影響如表1所示。第1天時,丁草胺組克氏原螯蝦胰蛋白酶活性顯著低于對照組(P<0.05),至第3天時兩者無顯著性差異(P>0.05)。整個試驗過程中,丙草胺組幼蝦胰蛋白酶活性與對照組均無顯著性差異(P>0.05)。各組克氏原螯蝦胰蛋白酶活性隨著養殖時間的延長均呈顯著性降低趨勢(P<0.05)。第1天時,丙草胺組克氏原螯蝦淀粉酶活性顯著低于對照組和丁草胺處理組(P<0.05)。第3天時,丙草胺組克氏原螯蝦淀粉酶活性顯著低于對照組(P<0.05),而與丁草胺組無顯著性差異(P>0.05)。丁草胺組幼蝦淀粉酶活性始終與對照組無顯著性差異(P>0.05)。第6天時,丙草胺組克氏原螯蝦淀粉酶活性顯著低于對照組(P<0.05),丁草胺組淀粉酶活性顯著高于丙草胺組(P<0.05)。各組克氏原螯蝦淀粉酶活性隨養殖時間的延長呈先上升后降低的趨勢。第6天時,丙草胺組克氏原螯蝦脂肪酶活性顯著低于對照組(P<0.05),其他時間點各組克氏原螯蝦幼蝦脂肪酶活性無顯著性差異(P>0.05)。各組克氏原螯蝦脂肪酶活性隨養殖時間的延長無明顯變化規律。至11 d時,丙草胺組幼蝦各消化酶活性與對照組之間均無顯著性差異(P>0.05),至3 d時,丁草胺組幼蝦各消化酶活性與對照組之間均無顯著性差異(P>0.05)。
2.3 酰胺類除草劑對克氏原螯蝦抗氧化酶活性的影響
酰胺類除草劑對克氏原螯蝦幼蝦抗氧化酶活性的影響如表2所示。第1天時,丙草胺組克氏原螯蝦SOD活性顯著高于對照組和丁草胺組(P<0.05),后兩者之間無顯著性差異(P>0.05)。第3天時,丁草胺組克氏原螯蝦SOD活性顯著高于對照組和丁草胺組(P<0.05),后兩者之間無顯著性差異(P>0.05)。第6天時,對照組、丙草胺組和丁草胺組之間克氏原螯蝦SOD活性無顯著性差異(P>0.05)。
丙草胺組、丁草胺組和對照組之間克氏原螯蝦CAT活性無顯著性差異(P>0.05),僅丁草胺組在第11天時顯著高于對照組(P<0.05)。第1天時,丙草胺組和丁草胺組克氏原螯蝦MDA含量顯著低于對照組(P<0.05),至第3天開始,3組之間無顯著性差異(P>0.05),僅丙草胺組在第11天時顯著高于對照組和丁草胺組(P<0.05)。
第1天時,丙草胺組和丁草胺組克氏原螯蝦GPx活性顯著高于對照組(P<0.05),第3天時,兩者顯著低于對照組(P<0.05),至第6天時,三者之間無顯著性差異(P>0.05)。第11天和第17天時,丁草胺組克氏原螯蝦GPx活性均顯著高于對照組和丙草胺組(P<0.05),而后兩者之間無顯著性差異(P>0.05)。
丙草胺組克氏原螯蝦T-AOC在第1天和第3天時顯著高于對照組(P<0.05),而丁草胺組至第11天時仍顯著高于對照組(P<0.05),第17天時,丙草胺組、丁草胺組和對照組之間無顯著性差異(P>0.05)。至17 d時,丙草胺組、丁草胺組和對照組之間,除丁草胺組幼蝦GPx活性外,各抗氧化酶活性均無顯著性差異(P>0.05)。

表1 酰胺類除草劑對克氏原螯蝦幼蝦消化酶活性的影響Table 1 Effects of amide herbicides on digestive enzyme activities of Procambarus crustacean juvenile
3 討論(Discussion)
營養不足會影響魚類正常生理代謝水平,造成機體能量供應不足,并導致其生長率下降[17-18]。本研究結果顯示,長期營養不足會導致克氏原螯蝦體質量顯著下降,同時,在丙草胺和丁草胺脅迫下,克氏原螯蝦幼蝦體質量損失率顯著增大,相對于對照組,丙草胺組和丁草胺組克氏原螯蝦幼蝦體質量顯著低于初始值的時間提前了6 d。甲殼類能量收支模型為:攝食能=生長能+糞便能+蛻殼能+排泄能+代謝能[19]。丙草胺組和丁草胺組克氏原螯蝦均有多次蛻殼現象發生,同時在藥物因素脅迫下,蛻殼能和代謝能等方面的能量消耗增加,導致2組幼蝦少量的攝食能不足以滿足正常生命活動需求和抵抗環境脅迫(藥物、饑餓),從而造成幼蝦體質量迅速下降。
消化酶活性與水生動物的生長發育有著極其緊密的關系,是反映水生動物營養生理的重要指標,其活性變化可反映水生動物在環境中的生理狀態和對環境的適應性[20-21]。研究證實,低濃度的丁草胺暴露對胡子鯰(Clariasfuscus)淀粉酶活性有一定的提高,脂肪酶活性隨著暴露時間及濃度的增加顯著降低[22]。本研究結果顯示,丙草胺和丁草胺對克氏原螯蝦消化酶活性產生了抑制作用,無誘導升高現象,且丙草胺對克氏原螯蝦消化酶活性影響程度大于丁草胺。隨著饑餓時間的延長,克氏原螯蝦胃腸組織胃蛋白酶和肝胰臟脂肪酶活性呈逐漸降低的趨勢,其胃腸淀粉酶活性則隨饑餓時間的延長呈先升高后降低的趨勢[23]。本研究結果顯示,隨著養殖時間的增加,丙草胺和丁草胺對克氏原螯蝦幼蝦消化酶活性的影響逐漸消失,后期幼蝦消化酶活性變化可能是由于營養缺乏所致,與上述文獻結果相似。
養殖水體環境多源性污染物對養殖對象健康存在較大威脅,微囊藻毒素[24]、硝態氮和氨態氮[25]和重金屬離子[26]等均可誘導養殖對象產生強弱程度不一的氧化應激反應。SOD、CAT和MDA是幾種經典的反映機體氧化脅迫狀況的生理指標,被較多地應用在外源污染物對水生動物的氧化應激損傷研究中[27]。斑馬魚(Brachydaniorerio)暴露于丙草胺,其肝臟SOD、谷胱甘肽巰基轉移酶(GST)活性先誘導后抑制,CAT活性受到抑制,MDA含量升高[28]。毒死蜱對鋸齒新米蝦(Neocaridiandenticulate)的毒性顯著高于Cu2+[29],毒死蜱較低濃度組鋸齒新米蝦SOD表現為“抑制-誘導”的變化趨勢,隨著毒死蜱濃度增加,MDA含量呈逐漸上升的趨勢[30]。本研究結果顯示,丙草胺和丁草胺對克氏原螯蝦幼蝦抗氧化酶活性存在顯著影響,SOD活性呈誘導-抑制變化規律,CAT活性與對照組無顯著性差異,而MDA含量顯著降低后與對照組無顯著性差異,GPx活性呈誘導-抑制變化規律,隨著養殖時間的增加,藥物對其抗氧化酶活性的影響逐漸消失。魏華等[27]研究了溴氰菊酯對克氏原螯蝦肝胰腺氧化脅迫效應,發現SOD和CAT活性呈抑制-誘導-抑制的變化規律,MDA含量則一直高于對照組。本研究結果與上述文獻結果不盡相同,可能與試驗過程中選取的藥物種類、試驗對象、取樣時間節點以及藥物毒性機理差異有關,但結果均表明所選藥物對受試對象的抗氧化系統產生了顯著影響。
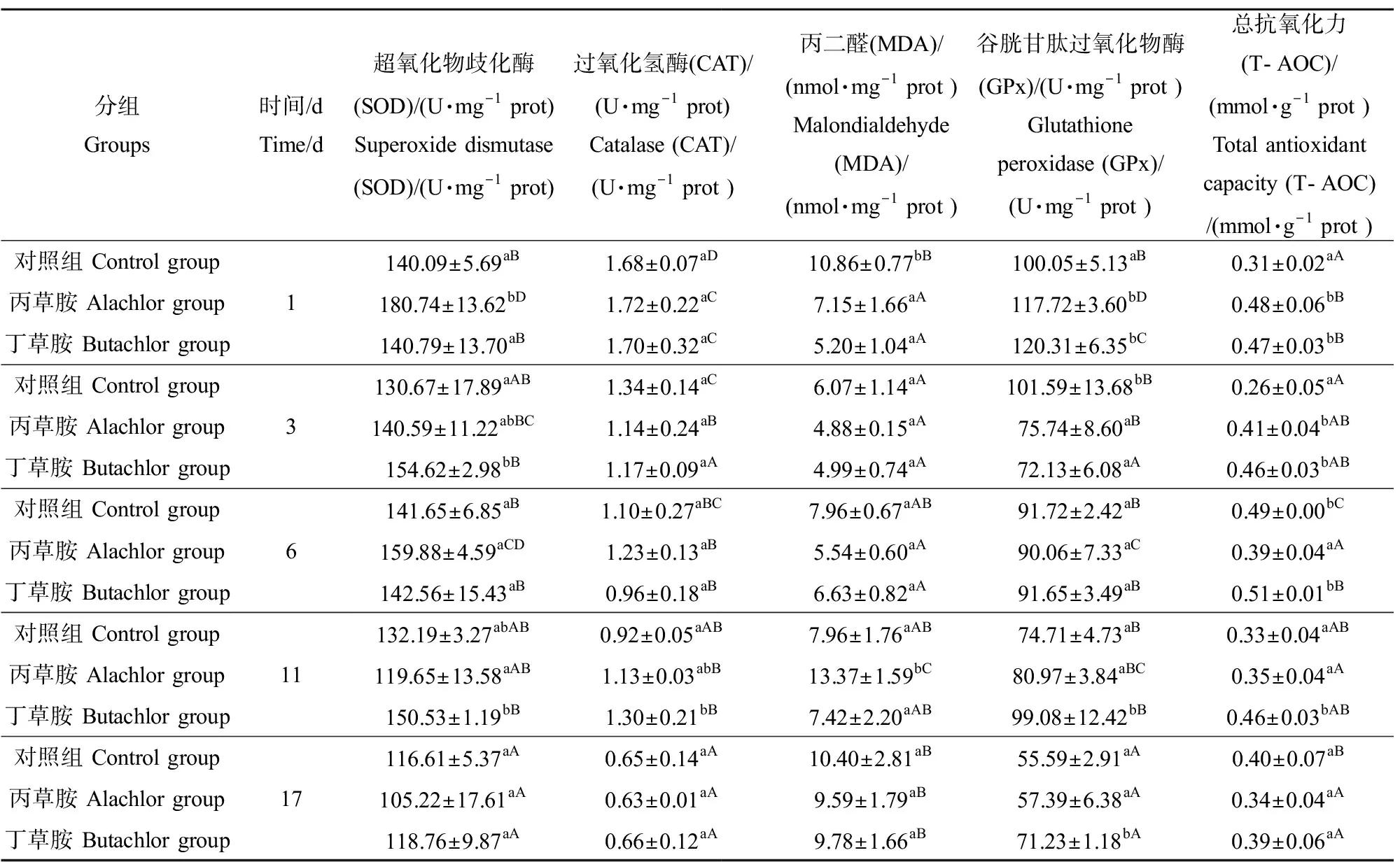
表2 酰胺類除草劑對克氏原螯蝦幼蝦抗氧化酶活性的影響Table 2 Effects of amide herbicides on antioxidant enzyme activities of Procambarus crustacean juvenile
本研究結果表明,丙草胺組和丁草胺組克氏原螯蝦抗氧化酶活性在第6天(除T-AOC外)和第17天(除GPx外)與對照組無顯著性差異,而在第11天時,丙草胺組(MDA)和丁草胺組(GPx、CAT、T-AOC)抗氧化酶活性均顯著高于對照組。研究證實,饑餓顯著影響克氏原螯蝦抗氧化酶活性[31],因此,本文上述現象可能是由營養不足和藥物雙重脅迫因素累積疊加造成的,有待進一步驗證。
稻田除草劑丙草胺和丁草胺可以誘導克氏原螯蝦蛻殼,短時間內可以影響幼蝦消化酶和抗氧化酶活性,幼蝦體質量損失率增大,經短期少量投喂養殖后,負面效應逐漸消失。為避免飼料對試驗結果的影響,本研究試驗對象處于營養缺乏狀態,對于正常投喂養殖條件下,丙草胺和丁草胺對幼蝦生長發育是否仍存在上述影響,有待進一步研究和探索。

