7種大孔吸附樹脂用于苦參堿分離性質研究
任莉莉,楊凌鑒,彭勇,陳紫成,金華峰,徐世明
(1.安康學院化學化工學院,陜西安康725000;2.安康學院秦巴中藥資源研發中心,陜西安康725000;3.北京大學安康藥物研究院,陜西安康725000;4.北醫大院士工作站,陜西安康725000)
苦參(Sophorae flavescens Radix)為豆科植物苦參的干燥根,性寒,味苦,歸心、肝、胃、大腸及膀胱經,具有清熱燥濕、殺蟲、抗菌和利尿的功效。苦參含大量生物堿,其中苦參堿和氧化苦參堿約占苦參總生物堿的70%,除此之外,苦參中還含有其他各類生物堿,如槐果堿、槐定堿等[1-3]。苦參堿(matrine)純品為柱狀或針狀結晶,易溶于水、甲醇、乙醇、苯、氯仿及乙醚等有機溶劑,微溶于石油醚。苦參堿具有很多藥理活性,包括抗腫瘤、抗肝炎病毒、保肝、調節心血管系統、調節免疫、抗炎、抗菌和殺蟲等,已被廣泛的應用于臨床[2,4,5]。氧化苦參堿(oxymatrine)也常與苦參堿一同存在于苦參藥材中[2,4]。根據生產需求,可以將氧化苦參堿和苦參堿互相轉化,從而獲得更多目標產物[6]。
苦參中生物堿常用提取方法為溶劑提取法,依據相似相溶的原理選用對生物堿溶解度大而對其他成分溶解度小的溶劑,常用酸水提取法和乙醇提取法[7,8]。具體操作包括浸提、回流和滲漉等,另外還有超聲輔助提取法和微波輔助提取法等。分離純化方法包括陽離子交換樹脂層析、大孔吸附樹脂層析、硅膠柱層析、氧化鋁柱層析、重結晶和鹽析等[9,10]。很多分離純化方法用到大量有毒試劑,威脅生命安全且污染環境,并且很難高效獲得較純的目標產物[2]。工業生產要求最大程度利用原材料并獲得純度較高的產物,且提取工藝盡可能不使用毒性溶劑。在此,本研究以苦參為原料,在提取過程中,將氧化苦參堿還原為苦參堿,從而獲得更多的目標產物苦參堿;同時基于工業生產對苦參提取工藝的要求,選用制藥公司常用的7種大孔吸附樹脂進行苦參堿的分離研究,優選最佳分離樹脂及條件,為工業生產提供支撐。
1 儀器與材料
1.1 儀器
高效液相色譜儀(LC2000,上海天美科學儀器有限公司);電子調溫加熱套(DZTW,天津工興實驗室儀器有限公司);旋轉蒸發器(RE5286A,上海亞榮生化儀器廠);恒溫水浴鍋(B-260,上海亞榮生化儀器廠);電子天平(SQP,賽多利斯科學儀器有限公司)。
1.2 材料
苦參,由安康北醫大制藥股份有限公司提供,經徐世明教授鑒定為正品。苦參堿(M109802)、氧化苦參堿(A111286)對照品,上海阿拉丁生化科技股份有限公司,98%。無水乙醇,天津天力化學試劑有限公司,分析純。大孔樹脂D101、HPD450、HPD722購自滄州寶恩化工有限公司。大孔樹脂LSA20、LSA21、LSA700B、AB8購自西安藍曉科技新材料股份有限公司。樹脂的物理性能指標見表1。
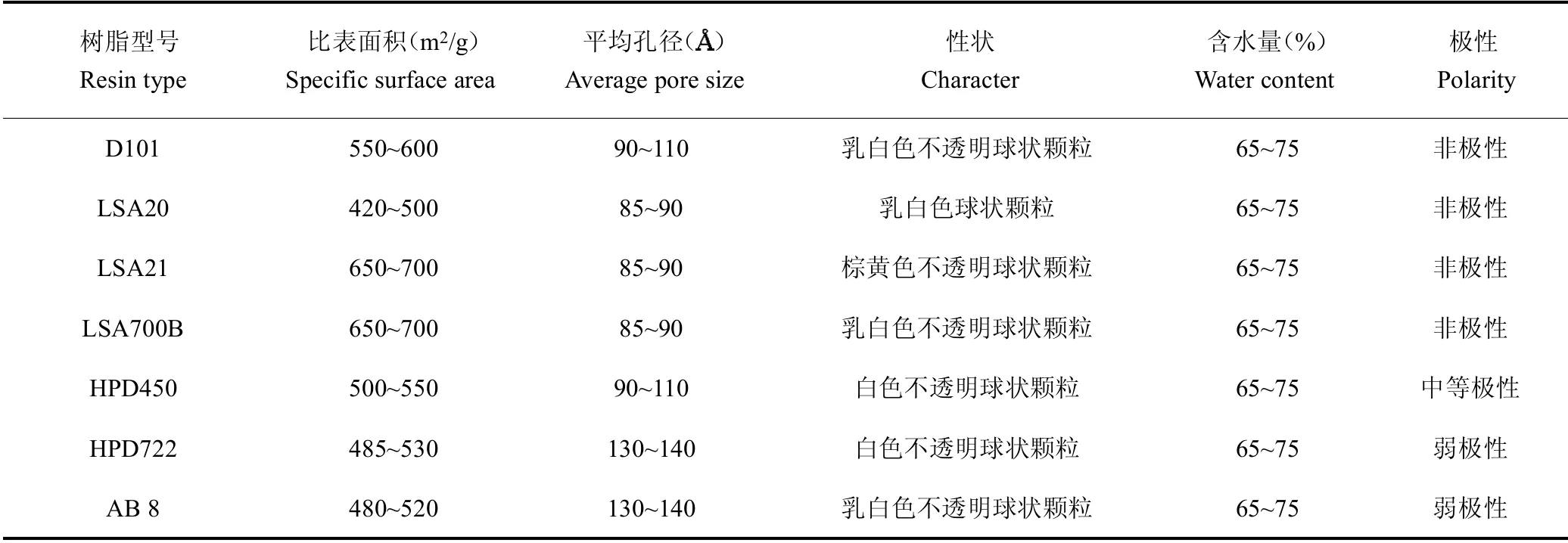
表1 7種大孔吸附樹脂基本性能Table 1 The basic properties of seven kinds of macroporous adsorption resins
2 實驗方法與結果
2.1 苦參堿含量測定
參考2020版藥典苦參藥材項下苦參堿含量測定方法,利用高效液相色譜法(HPLC)進行苦參堿的含量測定。對照品溶液制備:精密稱定苦參堿,加乙腈-無水乙醇(80:20)制成每mL含苦參堿50g。供試品溶液制備:二氯甲烷提取溶液中的苦參堿后,回收溶劑至干,加無水乙醇定量溶解。氨基鍵合硅膠柱(4.6 mm 250 mm,5m);流動相為乙腈-無水乙醇-3%磷酸(80:10:10);流動相流速1.0 mL/min;檢測波長220 nm;柱溫25℃。分別精密吸取對照品和供試品各20L進樣檢測,每組平行檢測3次。苦參堿保留時間約8.9 min(圖1 A)。
2.2 苦參堿粗提液制備
稱取苦參藥材200 g,粉碎并過100目篩。將苦參粉末和7倍量60%乙醇混合,回流2.5 h,收集提取液;第2次和第3次回流提取溶劑加入量均為5倍量,回流時間1 h,過濾收集并合并濾液。利用旋轉蒸發儀回收乙醇,然后加40% HCl調pH 2~3,加4.4 g亞硫酸氫鈉攪拌過夜,將氧化苦參堿轉化為苦參堿,靜置,過濾,待用。按照“2.1”項下方法測得提取液中苦參堿濃度為302.83g/mL(高效液相色譜圖見圖1 B)。
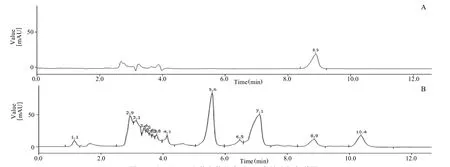
圖1 對照品(A)和苦參待分離液(B)高效液相色譜圖Fig.1 HPLC Chromatograms of the reference substance(A)and the preparation solution of Sophora flavescens(B)
2.3 樹脂預處理
分別量取一定量樹脂,濕法裝柱,2%NaOH淋洗(2 BV),流速為1.5 BV/h左右,然后用蒸餾水以相同流速洗至中性;5% HCl淋洗(2 BV),流速為1.5 BV/h左右,然后用蒸餾水以相同流速洗至中性;95%乙醇淋洗(2 BV),流速為1.5 BV/h左右,然后用蒸餾水以相同流速洗至無醇味[11]。
2.4 靜態吸附法初選樹脂
分別準確量取7種大孔吸附樹脂各5mL于25mL錐形瓶中,加堿性苦參提取液(pH 9)12 mL,搖勻,靜態吸附2 h,過濾,收集濾液。按“2.1”項下高效液相色譜法進行含量測定。苦參堿的吸附率=(苦參堿總量-未吸附苦參堿量)/苦參堿總量100%。濾液苦參堿量及苦參堿吸附率結果,見表2。LSA21靜態吸附率最大,其次是HPD722和D101。后續選擇LSA21、HPD722和D101進行動態吸附及解析實驗。
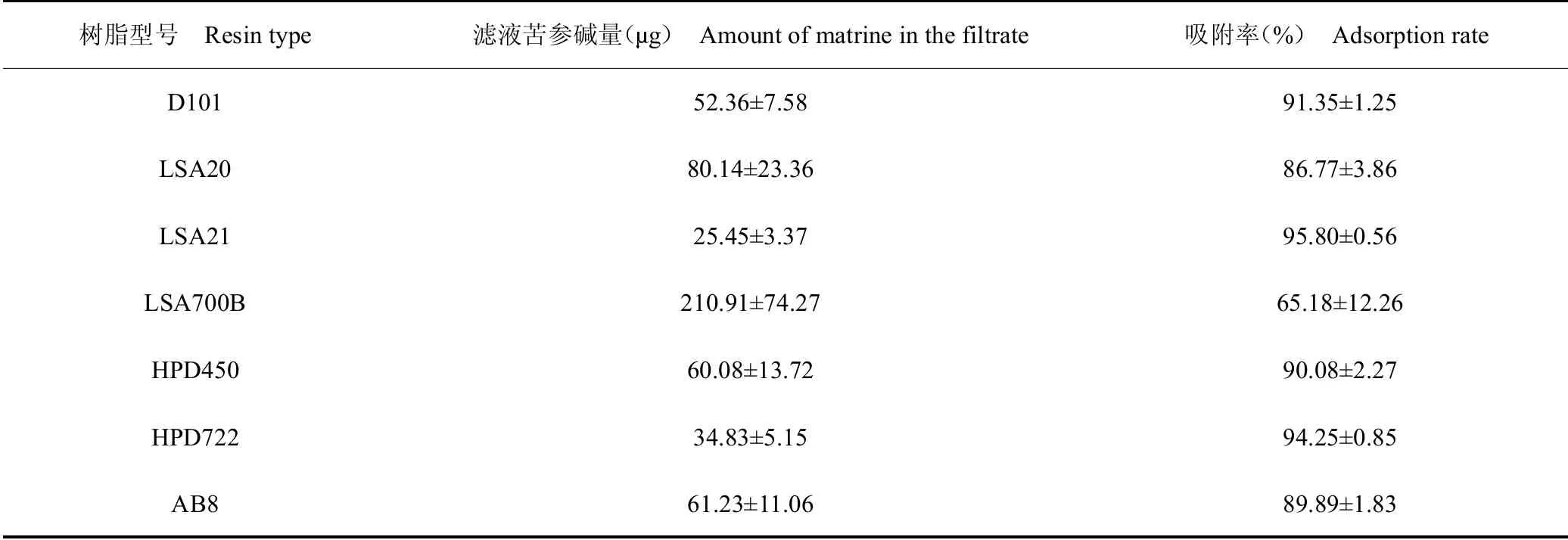
表2 7種大孔吸附樹脂吸附苦參堿情況Table 2 Adsorption of matrine by seven macroporous resins
2.5 動態吸附及解析優選樹脂
準確量取3種樹脂D101、LSA21和HPD722各10 mL,濕法裝柱,分別連續添加堿性苦參提取液(pH 9),流速2 BV/h,收集流出液,進行薄層色譜(TLC)定性檢測,與苦參堿對照品相同位置出現斑點即為動態吸附終點。薄層色譜方法如下:取苦參堿和氧化苦參堿對照品,分別加無水乙醇制成每1 mL含0.2 mg溶液,作為對照品溶液。吸取收集樣品和對照品分別點于同一硅膠G薄層板上,以氯仿-甲醇-25%氨水(5:0.5:0.2)為展開劑,展開,晾干,噴碘化鉍鉀試液。D101、LSA21和HPD722最大吸附苦參提取液體積分別為22mL、32mL和58mL,最大吸附量為提取液體積 苦參堿濃度。其中HPD722動態吸附苦參堿量最大(圖2),為17.56 mg/mL±1.82 mg(1.76 mg/mL±0.18 mg/mL樹脂)。
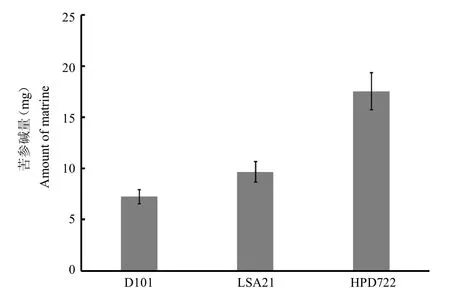
圖2 3種樹脂動態條件下苦參堿最大吸附量Fig.2 The maximum adsorption capacity of matrine of the three resins under dynamic conditions
完成動態吸附后,用3 BV蒸餾水進行沖洗,流速控制在2 BV/h左右,然后用90%乙醇溶液洗脫載樣樹脂,洗脫體積為5 BV,流速控制在2 BV/h左右。收集洗脫液,通過高效液相色譜法檢測其含量,理論解析率為洗脫苦參堿量/苦參堿總量100%。3組樹脂苦參堿解析率結果如圖3所示。LSA21和HPD722都有較高的解析率,分別為85.35%和86.45%。結合動態最大吸附量實驗結果,以選擇吸附量大、解析率高的樹脂,盡可能充分地分離和回收目標產物為目的,故選擇HPD722為最佳樹脂進行后續工藝條件的研究。
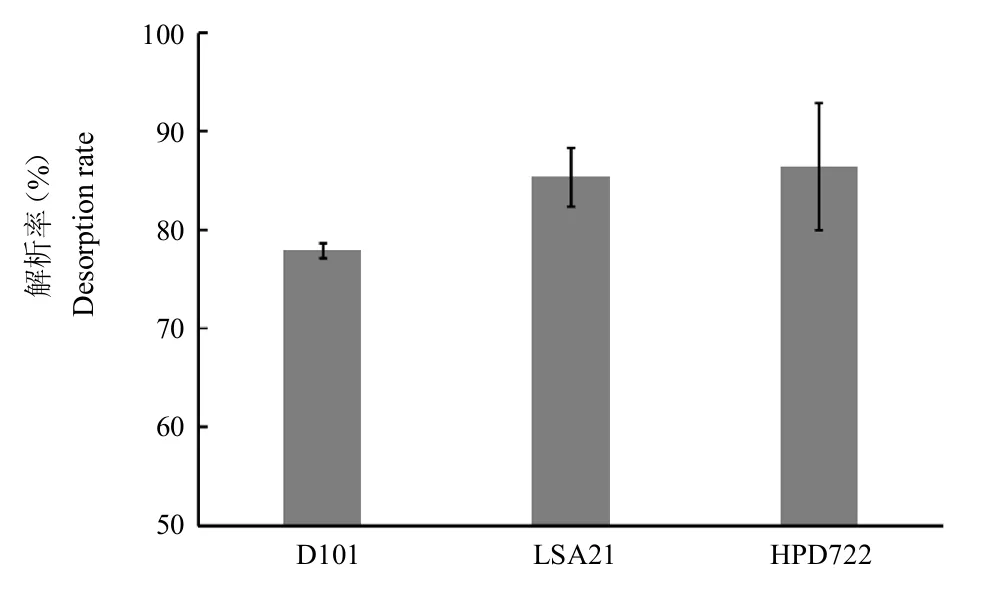
圖3 3種樹脂動態解析率Fig.3 Desorption rate of the three resins under dynamic conditions
2.6 最佳樹脂分離條件研究
2.6.1 上樣速度準確量取HPD722 10 mL共5份,分別裝柱并以2 BV/h、3 BV/h、4 BV/h、5 BV/h、6 BV/h進行上樣,每組堿性苦參提取液用量為3BV(pH為9),收集流出液;用2BV去離子水進行沖洗,收集流出液,并與之前收集流出液合并。按照“2.1”項下方法進行含量測定。苦參堿吸附率為(苦參堿總量未吸附苦參堿量)/苦參堿總量100%。由圖4可以看出,在不同上樣速度條件下,HPD722樹脂對苦參堿的吸附率均較高,在速度為2 BV/h和3 BV/h時,用高效液相色譜儀幾乎檢測不到流出液中苦參堿的信號,吸附率接近100%,故選擇3 BV/h為最佳上樣速度。
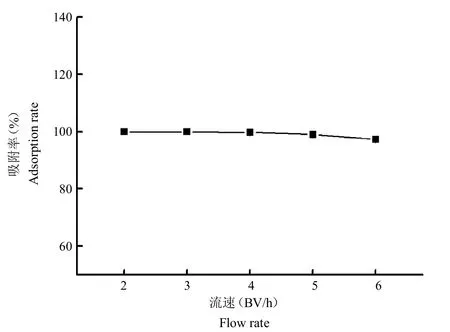
圖4 不同上樣速度時HPD722樹脂對苦參堿的吸附率Fig.4 The adsorption rate of matrine by HPD722 resin at different flow rates
2.6.2 上樣pH準確量取HPD722 10 mL,共5份,分別裝柱,取苦參提取液30 mL共5份,用25%NH3·H2O調pH分別至3、5、7、9和11。以3 BV/h上樣,收集流出液;20 mL去離子水沖洗,收集流出液,并與之前流出液合并。按照“2.1”項下方法進行含量測定。苦參堿吸附率計算公式同2.6.1。由圖5可以看出,在pH為3時,HPD722樹脂對苦參堿幾乎沒有吸附效果;隨著pH增大,吸附率逐漸增大,最大吸附率時(98.47%)上樣pH為9;當pH為11時,吸附率有所降低。故選擇pH為9時為最佳上樣pH。
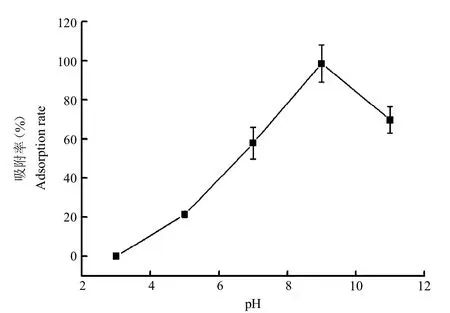
圖5 不同上樣pH時HPD722樹脂對苦參堿的吸附率Fig.5 The adsorption rate of matrine by HPD722 resin at different loading pH
2.6.3乙醇洗脫濃度和體積準確量取HPD72210mL,裝柱,取苦參提取液30mL進行上樣(pH 9),20 mL去離子水沖洗。用不同濃度乙醇(10%、20%、30%、40%、50%、60%、70%、80%和90%)進行洗脫。每個濃度洗脫體積為5 BV,流速控制在2 BV/h。收集每個濃度洗脫液,進行薄層色譜定性檢測,乙醇在低濃度(<20%)時無明顯產物點,≥30%時有產物點,≥70%時無產物點(圖6 A)。說明低濃度乙醇可洗脫除去雜質,高濃度乙醇可洗脫苦參堿。考慮實際生產情況及后續濃縮操作,選用20%乙醇洗脫除雜,70%乙醇洗脫產物。從TLC結果可以看出,乙醇洗脫液中主要產物點為苦參堿,且無明顯氧化苦參堿,說明該工藝過程的可行性,進一步可通過結晶獲得純度較高的苦參堿[9]。
另相同條件下裝柱、上樣,用5 BV 20%乙醇洗脫除雜,再用10 BV 70%乙醇進行洗脫,定量收集流出液(每20 mL一瓶),按照“2.1”項下方法進行含量測定,解析率為洗脫苦參堿量/苦參堿總量100%。由圖6 B可以看出,隨著洗脫液體積的增加,累計解析率不斷增大。大部分苦參堿在乙醇用量為20 mL時就能達到接近90%的解析率,當乙醇用量達到40 mL時,解析率接近100%。所以在此操作條件下,洗脫體積為60 mL,即6 BV時洗脫較為完全。
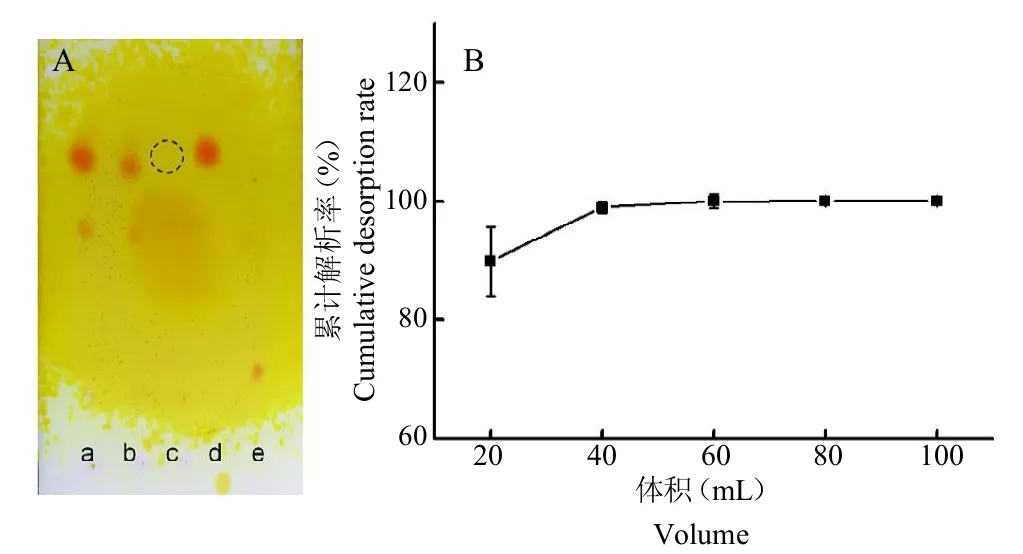
圖6 A:HPD722樹脂解析TLC結果。B:不同洗脫溶劑用量時苦參堿的累計解析率Fig.6 A.The dynamic desorption at different concentrations of ethanol.B.The cumulative desorption rate of matrine at different eluent volume.
2.6.4 洗脫速度準確量取HPD722 10 mL 5份,分別裝柱并取苦參提取液30 mL進行上樣(pH為9),20 mL去離子水沖洗,60 mL 70%乙醇進行洗脫。洗脫速度分別是2BV/h、3 BV/h、4BV/h、5BV/h和6BV/h。收集洗脫液,按照“2.1”項下方法進行含量測定。理論解析率為洗脫苦參堿量/苦參堿總量100%。在各種洗脫流速條件下,苦參堿解析率均較高(圖7),均大于85%。在乙醇洗脫速度為2 BV/h和3 BV/h時,解析率分別為96.49%和96.10%。實際操作時,可選擇3 BV/h為最佳洗脫流速,既節約時間又能達到較高的解析效果。
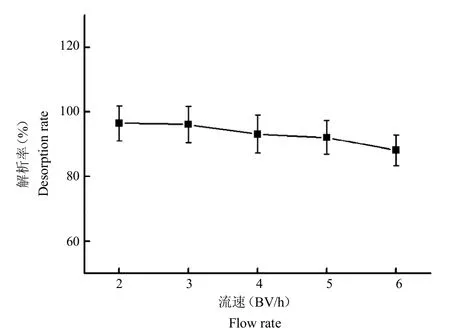
圖7 不同洗脫速度時苦參堿的解析率Fig.7 The desorption rate of matrine at different elution flow rates
3 討論
7種大孔樹脂靜態吸附苦參堿吸附率有明顯差別,可能由于苦參堿屬于弱堿物質,有一定的親水性,有利于非極性或弱極性樹脂的吸附,并且LSA21具有較大的比表面積,靜態吸附量較大[11,12],其次是HPD722和D101。由于動態吸附和靜態吸附過程有所不同,導致在兩種情況下被吸附物質量有所差異,最終樹脂選擇還是以實際生產中使用的動態吸附情況為參考,即選擇動態吸附量最大的HPD722為該條件下的最優吸附樹脂。
HPD722樹脂對苦參堿吸附性能較好。在pH為3時,HPD722樹脂對苦參堿幾乎沒有吸附效果,因為在強酸性條件下苦參堿成鹽后更易溶于水并隨水流出。隨著pH增大,吸附率逐漸增大。當pH為11時,吸附率有所降低,可能是因為苦參堿在強堿性條件下水解開環所致[13]。使用不同濃度乙醇為洗脫溶劑,對環境比較友好,產物收率高。大孔吸附樹脂分離純化苦參提取液中的苦參堿操作簡單,樹脂容易再生。HPD722樹脂可進一步應用于工業放大生產分離純化苦參堿,并結合萃取、結晶等操作進一步增加產物的純度。

