胸腺鱗狀細胞癌41例臨床病理分析及PD-L1表達的意義
吳 龍,馮昌銀,黃建平,楊映紅
胸腺上皮性腫瘤是胸腺最常見的腫瘤,包括胸腺瘤和胸腺癌。WHO(2015)胸腺腫瘤分類包括:鱗狀細胞癌、基底樣癌、黏液表皮樣癌、淋巴上皮瘤樣癌、透明細胞癌、肉瘤樣癌、腺癌和未分化癌等,其中鱗狀細胞癌最常見[1]。原發性胸腺鱗狀細胞癌的診斷需結合臨床特點、影像學表現、組織學及免疫組化檢查。由于該腫瘤少見,有關胸腺鱗狀細胞癌的臨床病理特征分析及其PD-L1表達的報道較少。本文著重探討原發性胸腺鱗狀細胞癌的臨床病理學特征及預后因素,旨在為臨床與病理醫師提供參考。
1 材料與方法
1.1 臨床資料收集2012年1月~2017年12月福建醫科大學附屬協和醫院病理科存檔的胸腺瘤及胸腺癌492例,其中胸腺瘤438例,胸腺癌54例。胸腺鱗狀細胞癌41例,占胸腺上皮性腫瘤的8.3%,占胸腺癌的75.9%。男性28例,女性13例,男女比為2.15 ∶1,年齡9~74歲,中位年齡58歲,發病高峰年齡為50~59歲。另對2019年1月~2021年1月存檔的253例肺鱗狀細胞癌中PD-L1的表達結果進行統計分析。
1.2 方法復習所有病例的HE切片并統計組織學特征。選取典型切片對應的蠟塊,4 μm厚制片,行PD-L1(兔單抗,克隆號SP263,即用型)、CD5、CD117、Ki-67等免疫組化染色,以上抗體均購自瑞士羅氏公司,采用OptiView法,每次試驗均設陽性和陰性對照,由羅氏Ventana BenchMark ULTRA免疫組化儀完成。收集所有病例的病理切片及蠟塊,經兩位資深病理專業醫師參照WHO(2015)胸腺腫瘤分類[1]標準進行組織學分類。
1.3 判斷標準CD5、CD117陽性定位于細胞膜,Ki-67陽性定位于細胞核。由經過PD-L1閱片培訓的病理醫師進行PD-L1判讀,判讀標準按有任何強度細胞膜和(或)細胞質染色的腫瘤細胞占所有腫瘤細胞的百分比≥1%為PD-L1陽性,<1%為陰性,≥50%為高表達,<50%為低表達[2]。
2 結果
2.1 臨床特征患者臨床表現以胸悶、胸痛、咳嗽為主,其他癥狀還有肩背疼痛、氣促、聲嘶、上腔靜脈綜合征、重癥肌無力等,部分患者無癥狀,為體檢發現。對有完整資料的37例胸腺鱗狀細胞癌患者進行Masaoka分期,其中Ⅲ期22例,Ⅳ期15例。手術切除標本30例,其中28例為完整切除,2例為部分切除;21例患者術后輔助放療和(或)化療,5例僅行化療和(或)放療,6例未治療。確診時15例(15/41,36.6%)已發現1處或多處轉移,轉移部位包括肺(11/15,73.3%)、骨(4/15,26.7%)、胸膜(3/15,20%)、肝臟(3/15,20%)、淋巴結(3/15,20%)、心包(3/15,20%)、膈神經(1/15,6.7%)、肺動脈(1/15,6.7%)。本組41例隨訪6~97個月,其中26例無進展生存(63.4%),15例(36.6%)死亡,中位生存時間為54個月,平均生存時間為57.7個月,5年生存率為21.4%。
2.2 影像學特征CT示腫瘤位于前縱隔或前上縱隔,界限大多不清(22/37,59.5%),部分界清(15/37,40.5%)。大部分密度不均勻(31/41,75.6%),輕度至顯著強化均可出現。部分伴囊性變(8/41,19.5%),本組中伴囊性變者均為低分化鱗狀細胞癌。
2.3 病理檢查
2.3.1眼觀 本組10例為穿刺活檢組織,31例為手術切除標本。腫瘤最大徑1.0~12.0 cm。切面常為灰白色,質韌,無包膜,界欠清;小部分有包膜、界清。8例存在囊性變。
2.3.2鏡檢 胸腺鱗狀細胞癌與其他部位鱗狀細胞癌形態相似,可分為高、中、低分化,以非角化型較多見,常為低分化。本組低分化39例,中分化2例,高分化0例,部分病例背景中有豐富的淋巴細胞(圖1A、B)。
2.3.3免疫表型 CD5陽性率為95.1%(39/41)(圖1C)。41例CD117均陽性(圖1D)。Ki-67增殖指數為8%~95%。PD-L1陽性率為82.9%(34/41),高表達率為26.8%(11/41)(圖1E、F)。PD-L1表達與腫瘤大小及背景中淋巴細胞相關,腫瘤最大徑≥6.0 cm以及背景富于淋巴細胞浸潤者PD-L1陽性率更高(P<0.05,表1)。胸腺鱗狀細胞癌中PD-L1陽性率明顯高于肺鱗狀細胞癌(82.9%vs60.9%),差異有統計學意義(P<0.05,表2)。
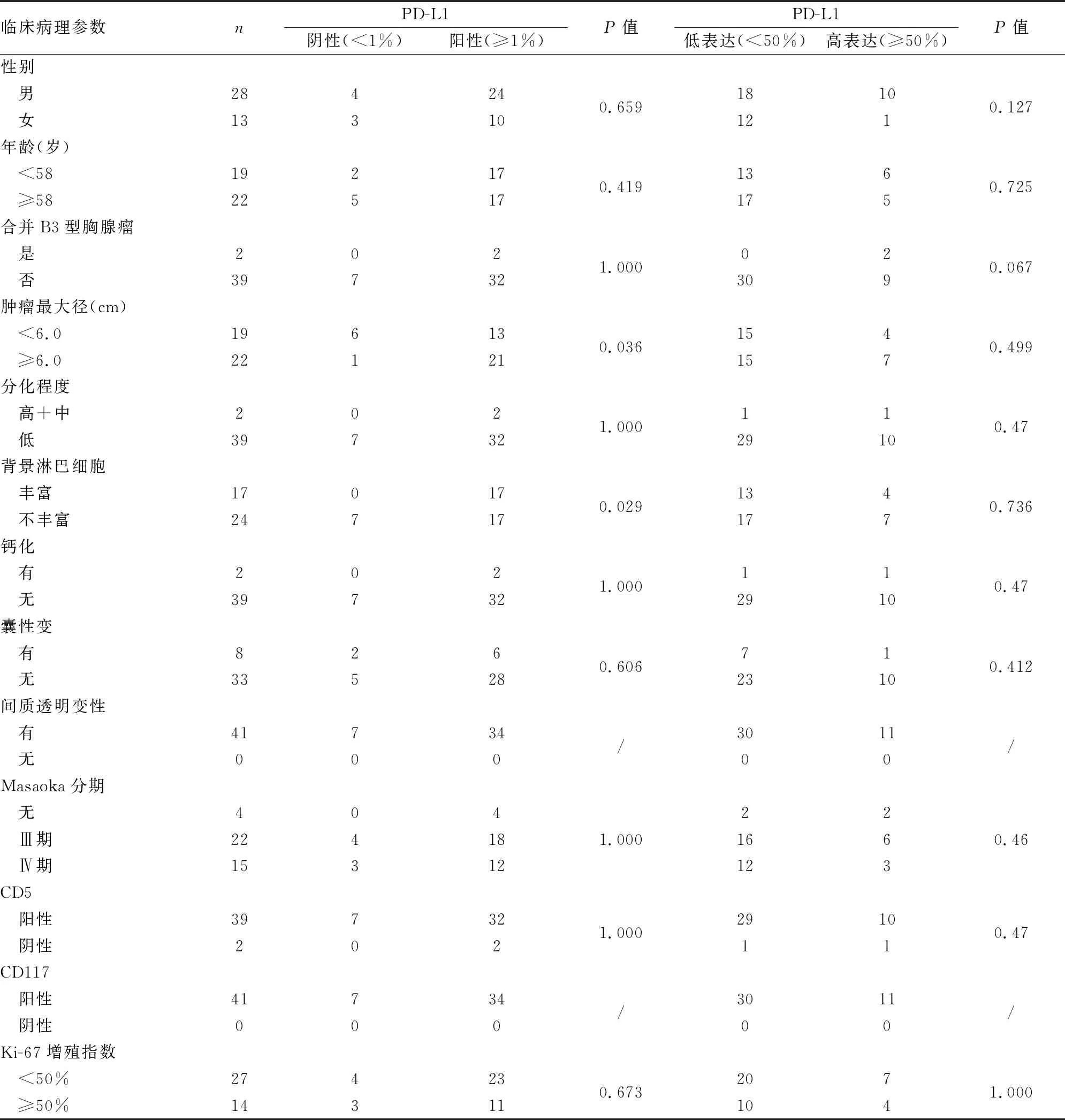
表1 胸腺癌中PD-L1表達與臨床病理特征的關系
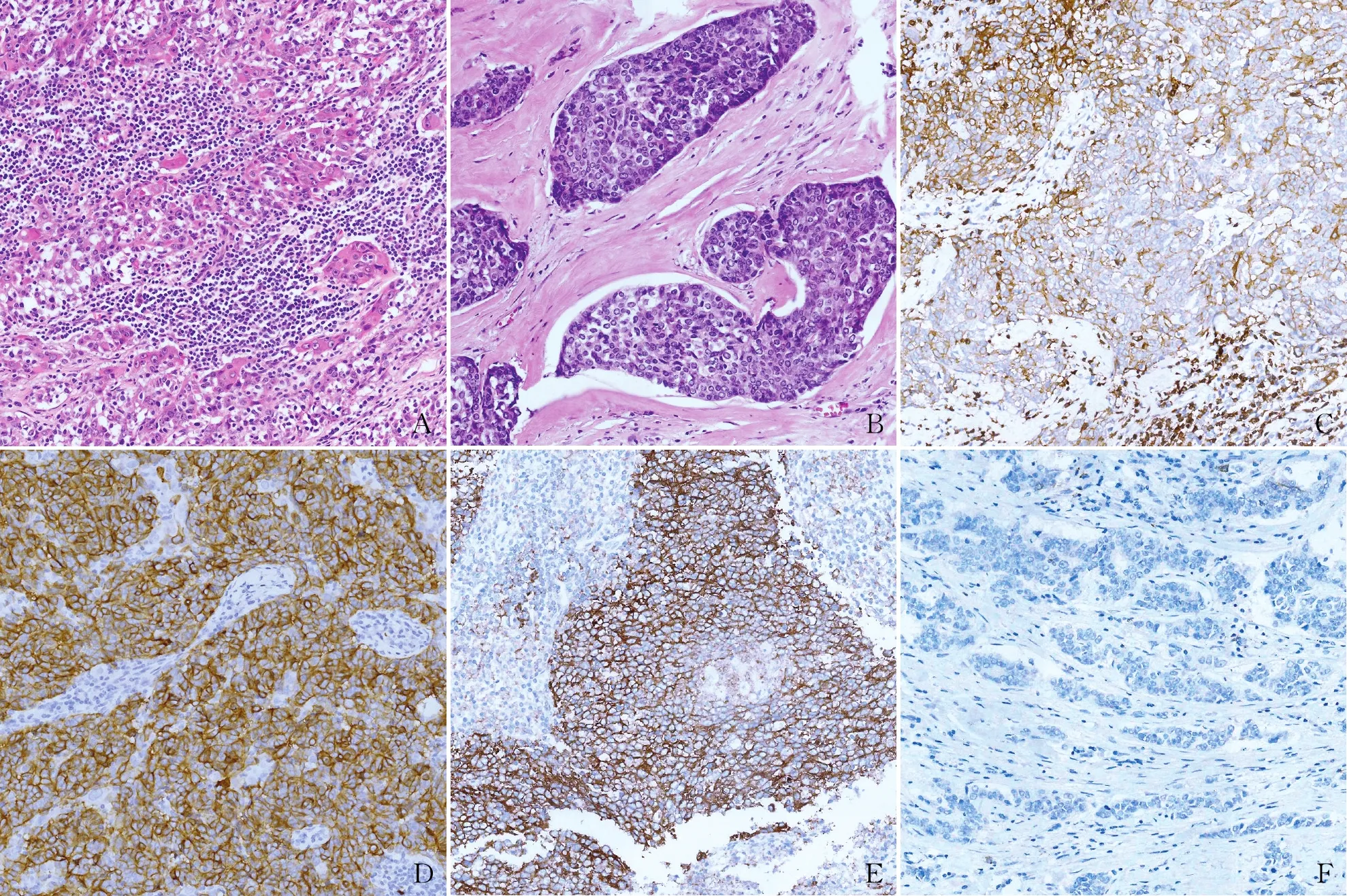
圖1 A.富于淋巴細胞的低分化鱗狀細胞癌;B.胸腺鱗狀細胞癌示背景缺乏明顯的淋巴細胞浸潤;C.低分化胸腺鱗狀細胞癌CD5陽性,OptiView法;D.低分化胸腺鱗狀細胞癌CD117陽性,OptiView法;E.低分化胸腺鱗狀細胞癌PD-L1高表達,OptiView法;F.低分化胸腺鱗狀細胞癌PD-L1陰性,OptiView法

表2 肺鱗狀細胞癌和胸腺鱗狀細胞癌中PD-L1的表達[n(%)]
3 討論
胸腺癌是一類原發于胸腺的惡性上皮性腫瘤,缺乏胸腺分化,無特殊的組織病理學特征可以區分原發或轉移性腫瘤[3]。最常見的類型為鱗狀細胞癌[4],占胸腺上皮性腫瘤的7.2%,占胸腺癌的72.4%。男性多發,中位年齡65歲(24~85歲)。常見的臨床表現為縱隔占位壓迫引起的胸痛、氣短、呼吸困難、咳嗽、聲嘶、吞咽困難、上腔靜脈綜合癥、膈神經麻痹,少數無癥狀患者為影像學檢查時偶然發現[3,5-6]。<5%患者表現為重癥肌無力[7]。本組患者臨床特征與文獻報道相似。
胸腺鱗狀細胞癌CT表現為前縱隔腫塊,界限清或不清,邊緣不規則,可因伴壞死、囊性變、出血而密度降低[3,5-6,8]。MRI的T2WI前縱隔腫物內點狀低密度高度提示胸腺癌[9]。Weissferdt等[5]報道的6例囊性胸腺鱗狀細胞癌均為高分化。本組中伴囊性變者均為低分化鱗狀細胞癌,2例中分化鱗狀細胞癌不伴囊性變,提示囊性變與組織學分化程度的相關性仍需積累更多病例進一步證實。
胸腺鱗狀細胞癌與其他部位鱗狀細胞癌形態相似,可分為高、中、低分化,以非角化型較多見,多為低分化。本組低分化39例,中分化2例。2例合并B3型胸腺瘤,文獻報道其還可與AB型胸腺瘤混合[10]。多發性胸腺鱗狀細胞癌少見,Jin等[11]的研究結果提示多結節可能為胸腺內轉移而來。胸腺鱗狀細胞癌表達鱗狀細胞癌標志物CK、CK5/6、p63、p40,還特異性表達CD5、CD117以及PAX8[12]。
鑒別診斷:(1)B3型胸腺瘤:EZH2、C-Kit、CD205組合使用可輔助鑒別,其敏感性和特異性可達96.3%和100%。EZH2在胸腺鱗狀細胞癌中的表達顯著高于B3型胸腺瘤,CD205在B3型胸腺瘤中強陽性,在胸腺鱗狀細胞癌中弱陽性或陰性。CD117和CD5在胸腺鱗狀細胞癌中的表達顯著高于B3型胸腺瘤[13]。(2)轉移性鱗狀細胞癌:有其它部位鱗狀細胞癌病史,文獻報道胸腺鱗狀細胞癌中CD117、CD5、PAX8的陽性率分別為84%、53%、69.2%,而肺鱗狀細胞癌中CD117、CD5、PAX8的陽性率分別為26.6%、0、5.8%,胸腺鱗狀細胞癌可不同比例表達以上指標的兩兩組合,而肺鱗狀細胞癌無以上指標雙陽性組合。因此CD5、CD117以及PAX8聯合使用可以鑒別胸腺鱗狀細胞癌和肺鱗狀細胞癌[12,14]。
治療首選手術切除,完整切除者總生存期好,術后無瘤生存時間長[7]。腫瘤分期為Ⅰ、Ⅱ期,并且手術切緣干凈者預后好。還可輔以放、化療、分子靶向治療[3]。大部分患者診斷時處于Masaoka分期Ⅲ/Ⅳ期,中位生存時間為59個月,5年總生存率為49%[4]。可轉移至淋巴結、肺、胸壁、骨、腦、腎臟、肝臟、甲狀腺及小腸[3,6,15]。本組患者5年生存率(21.4%)低于文獻報道,差異性可能與病例數量較少有關。
多個研究顯示PD-L1在胸腺癌中有較高的陽性率,并且顯著高于其他類型胸腺瘤[2,16-17]。最近Chen等[18]的Meta分析顯示180例胸腺癌中PD-L1陽性率為56.6%。本組PD-L1陽性率為82.9%,顯著高于肺鱗狀細胞癌(60.9%,P<0.05)。PD-L1表達還與背景淋巴細胞以及腫瘤大小相關(P<0.05),因此對于背景富于淋巴細胞以及腫瘤最大徑>6.0 cm的胸腺癌患者,可推薦行PD-L1檢測以指導治療。目前關于胸腺鱗狀細胞癌抗PD-L1治療的研究較少,相關文獻[19-20]報道顯示,抗PD-L1治療效果明顯且不良反應小。因此,對于胸腺癌尤其是進展期、無法行手術切除的患者,抗PD-1治療是一個新的、可行的治療方法,PD-L1的檢測可以篩選出對抗PD-1治療有效的患者。
胸腺鱗狀細胞癌為胸腺最常見的原發惡性腫瘤,具有較高的轉移率和病死率,預后差。治療首選手術切除,可輔以放療、化療。本組胸腺鱗狀細胞癌中PD-L1陽性率高,可為臨床免疫治療提供依據,但仍需積累更多病例進一步驗證。

