血清GDF-15、BNP水平與慢性阻塞性肺疾病急性加重期患者肺動脈高壓的相關性*
熊小平,張紅麗,席建宏,拜合提尼沙·吐爾地
新疆醫科大學第一附屬醫院RICU,新疆烏魯木齊 830000
氣道慢性炎癥是慢性阻塞性肺疾病(COPD)的重要病因,據報道,COPD多發生于中老年群體,近年發病率有所升高[1]。隨著COPD的病情進展,肺組織出現持續損傷,可導致急性加重,發展為COPD急性加重期(AECOPD)。AECOPD患者病情嚴重,部分患者外周氣道阻塞、肺實質損壞、肺血管持續痙攣等使肺氣體交換能力下降,可導致肺血管廣泛收縮,引起肺動脈高壓(PH)[2]。一旦發生PH,COPD患者可能會產生慢性肺源性心臟病,增加心力衰竭的風險,預后不佳[3]。因此,尋求可早期預測AECOPD患者PH發生風險的指標十分必要。以往臨床常以右心漂浮導管法作為檢查PH的主要手段,雖然診斷準確率高,但創傷大,患者接受度低,且無法早期預測PH發生風險,應用受限[4]。生長分化因子-15(GDF-15)是一種具有免疫調節作用的細胞因子,正常情況下,機體支氣管內GDF-15水平較低,在炎癥或損傷等狀態下,血清GDF-15表達水平明顯升高,并參與炎癥[5]。腦鈉肽(BNP)主要來源于心室,具有利尿、排鈉及舒張血管等作用,被廣泛用于評估心血管疾病[6]。但近年有研究發現,血清BNP與肺微循環血管阻力有一定關系,BNP可減少氧自由基分泌,減輕炎癥程度,緩解肺血管重構[7]。因炎癥是AECOPD的發病基礎,推測血清GDF-15、BNP可能與AECOPD患者PH發生有關,但目前此類研究較少,基于此,本研究旨在觀察血清GDF-15、BNP在AECOPD患者中的表達水平,并分析二者與PH發生的關系,現報道如下。
1 資料與方法
1.1一般資料 選取2018年3月至2020年3月在本院確診并接受治療的93例AECOPD患者作為研究對象,本研究實施獲得本院醫學倫理委員會批準,患者及家屬對本研究相關情況知情并簽署知情同意書。93例患者中男49例,女44例;年齡45~73歲,平均(60.52±3.85)歲;COPD病程:<5年32例,5~10年47例,>10年14例;肺功能分級[8]:Ⅰ級30例,Ⅱ級46例,Ⅲ級17例;合并基礎疾病(主要包括高血壓、糖尿病、血脂異常)31例。
1.2納入和排除標準
1.2.1納入標準 (1)AECOPD符合《慢性阻塞性肺疾病急性加重(AECOPD)診治中國專家共識(2017年更新版)》[9]中診斷標準:患者呼吸困難加重,咳嗽、喘息及胸悶等癥狀加劇,痰液量增多,痰液呈膿性;且經CT、X線片及實驗室等檢查確診。(2)參照上述診治指南為患者實施合理治療,如吸氧、糖皮質激素及支氣管擴張劑等藥物干預。(3)患者依從性好,能夠配合相關人員接受檢查,完成本調查研究。(4)患者精神正常。
1.2.2排除標準 (1)合并肺結核、哮喘等其他呼吸系統疾病;(2)合并肝衰竭或腎衰竭等重要臟器疾病;(3)合并肺癌、胃癌等惡性腫瘤;(4)伴慢性心力衰竭、腦梗死等影響血清GDF-15水平的疾病;(5)伴急性心肌梗死、冠狀動脈綜合征等影響血清BNP水平的疾病。
1.3方法
1.3.1AECOPD患者PH評估及分組方法 患者入院48 h內進行右心導管檢查,參照《肺動脈高壓篩查診斷與治療專家共識》[10]中標準評估AECOPD患者PH狀況,若出現下述情況即可判斷為發生PH:患者出現活動后氣短、乏力,可伴胸痛、眩暈、咯血等癥狀;于海平面狀態下,患者靜息時,右心導管檢查肺動脈收縮壓超過30 mm Hg(1 mm Hg=0.133 kPa)或平均肺動脈壓超過25 mm Hg,或運動時平均肺動脈壓超過30 mm Hg。將發生PH患者納入PH組,反之納入無PH組。
1.3.2實驗室指標檢測方法 于患者入院時采集清晨空腹外周靜脈血5 mL,室溫下靜置1 h,以3 000 r/min離心10~15 min(山東梁嘉機械設備有限公司提供的TG16-X型離心機),取上清液,置于-80 ℃環境下保存待檢;采用酶聯免疫吸附試驗檢測血清GDF-15、BNP、Toll樣受體4(TLR4)水平,試劑盒均由美國R&D公司提供;采用免疫散射比濁法測定血清C反應蛋白(CRP)水平,試劑盒由上海恒遠生物科技有限公司提供。所有操作嚴格按照試劑盒說明書進行。
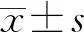
2 結 果
2.1AECOPD患者PH發生情況 93例AECOPD患者中有34例患者發生PH,發生率為36.56%。
2.2兩組患者基線資料及實驗指標比較 PH組患者血清CRP、TLR4、GDF-15、BNP水平均高于無PH組,差異均有統計學意義(P<0.05);兩組其他基線資料比較,差異均無統計學意義(P>0.05)。見表1。

表1 兩組患者基線資料及實驗指標比較
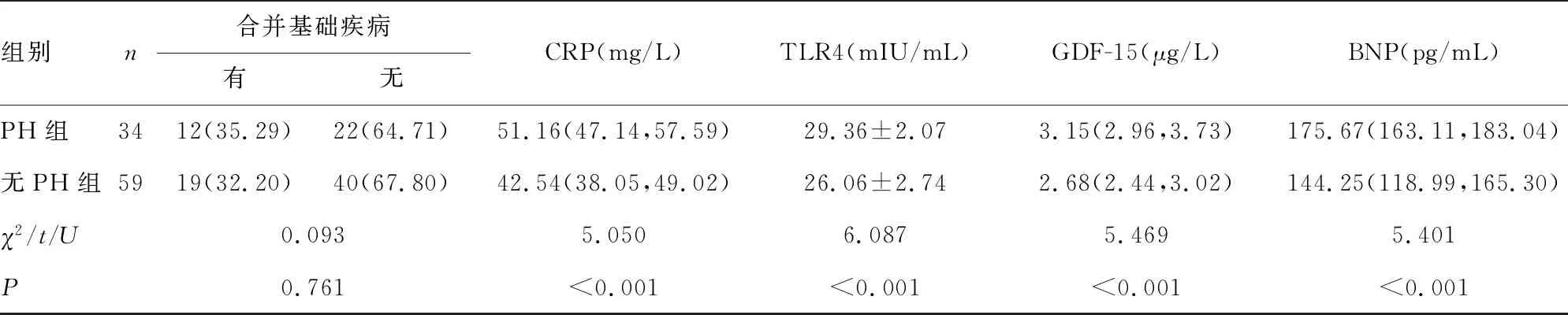
組別n合并基礎疾病有無CRP(mg/L)TLR4(mIU/mL)GDF-15(μg/L)BNP(pg/mL)PH組3412(35.29)22(64.71)51.16(47.14,57.59)29.36±2.073.15(2.96,3.73)175.67(163.11,183.04)無PH組5919(32.20)40(67.80)42.54(38.05,49.02)26.06±2.742.68(2.44,3.02)144.25(118.99,165.30)χ2/t/U0.0935.0506.0875.4695.401P0.761<0.001<0.001<0.001<0.001
2.3各項主要指標與AECOPD患者PH發生關系的回歸分析 將2.2中比較差異有統計學意義的變量作為自變量(均為連續變量),并將AECOPD患者PH發生情況作為因變量(1=發生,0=未發生),經Logistic回歸分析發現,CRP、TLR4、GDF-15、BNP過表達與AECOPD患者PH發生有關(OR>1,P<0.05),后建立多元回歸模型,結果顯示,CRP、TLR4、GDF-15、BNP過表達與AECOPD患者PH發生有關,可能是AECOPD患者PH發生的風險因子(OR>1,P<0.05)。見表2。

表2 各項主要指標與AECOPD患者PH發生關系的回歸分析
2.4入院時血清GDF-15、BNP單獨及聯合檢測預測AECOPD患者PH發生風險的價值分析 將AECOPD患者PH發生情況作為狀態變量(1=發生,0=未發生),并將血清GDF-15、BNP水平作為檢驗變量,繪制ROC曲線(圖1),結果顯示,當血清GDF-15、BNP的cut off值分別取2.86 μg/L、151.53 pg/mL時,提示AECOPD患者PH發生風險高,且此時GDF-15、BNP單獨及聯合檢測預測AECOPD患者PH發生的AUC分別為0.842、0.837、0.845,均有一定預測價值。見表3。

圖1 入院時血清GDF-15、BNP單獨及聯合檢測預測AECOPD患者PH發生風險價值的ROC曲線
2.5血清GDF-15、BNP水平之間的關系 經雙變量Spearman直線相關檢驗結果顯示,血清GDF-15、BNP水平之間呈正相關(r=0.152,P=0.040)。散點圖見圖2。

表3 入院時血清GDF-15、BNP單獨及聯合檢測預測AECOPD患者PH發生風險價值分析結果

圖2 血清GDF-15、BNP水平之間相關性散點圖
3 討 論
PH是AECOPD常見的并發癥,傳統觀點認為缺氧是導致PH發生的主要機制,但經氧療干預無法糾正,PH發生風險仍較高[11]。林沛茹等[12]研究發現,AECOPD患者發生PH的風險較高,全身炎癥在PH中發揮重要作用。本研究中93例AECOPD患者經評估發現,有34例患者發生PH,發生率為36.56%,證實了上述研究結論。因此,尋求可早期預測AECOPD患者PH發生的指標至關重要。
COPD的病理基礎主要為慢性炎癥導致的呼吸道阻塞及氣流受限,這種長期存在的呼吸道阻塞及氣流受限可使患者出現慢性缺氧狀態,長期慢性缺氧將誘發PH[13],可見炎癥在PH中發揮重要作用。CRP屬于一種急性時相反應蛋白,一旦機體發生感染或炎癥時,CRP水平急劇升高,被認為是評估急性炎癥的關鍵指標[14]。有研究顯示,CRP在COPD發生和發展中發揮重要作用,動態監測血清CRP水平對評估患者病情發展有一定價值[15]。但CRP是一項非特異性炎癥指標,容易受較多因素干擾,如年齡、合并基礎疾病等,用于評估AECOPD患者PH發生存在不足,因此,本研究未將其作為主要研究指標。TLR4是參與機體免疫的重要炎癥因子,已被證實可促進白細胞介素-3、白細胞介素-10等可溶性細胞因子合成,這些細胞因子可促進機體免疫應答;此外,TLR4還可誘導促炎因子釋放,在氣道炎性損害中發揮重要作用[16]。本研究發現,PH組患者血清CRP、TLR4水平均高于無PH組,且經Logistic回歸分析顯示,血清CRP、TLR4過表達與AECOPD患者PH發生有關,可能是PH發生的風險因子,但需要注意的是,血清CRP、TLR4對AECOPD患者PH的影響風險系數值較GDF-15、BNP低。因此,本研究未將CRP、TLR4等常規炎癥指標作為主要炎癥因子過多闡述。
GDF-15是轉化生長因子-β超家族重要成員,其水平與肺功能損傷有關,GDF-15水平越高,肺功能損害越重,這與血清GDF-15水平異常升高會造成氣道上皮細胞防御功能損傷、氣道黏液分泌增加、氣道阻力增大、不利于肺通氣有關[17-18],提示GDF-15參與COPD的發生及發展。BNP是由心室肌細胞快速分泌的一種心臟神經激素,心肌缺血、損傷及壞死等心肌結構或功能變化均可促進BNP合成,且在低氧血癥及炎癥中BNP水平也異常升高[19]。據報道,BNP可減輕炎癥引起的氧化應激反應,在COPD發生和發展中發揮重要作用,與PH有一定關系[20]。
本研究結果顯示,PH組患者血清BNP、GDF-15水平均高于無PH組,經Logistic回歸分析顯示,血清BNP、GDF-15過表達可能是AECOPD患者PH發生的風險因子,提示BNP、GDF-15過表達與AECOPD患者的PH發生有關,可能是PH發生的風險因子及預測因子。分析可能原因為,GDF-15可參與細胞生長及炎癥等過程,GDF-15可通過誘導激活磷脂酰肌醇-3-激酶/蛋白激酶B信號通路,促進黏蛋白5AC在氣道上皮細胞表達,進而增加痰液量,加重氣道阻塞;此外,GDF-15過表達會激活炎癥,增加氣道中性粒細胞數量,進而激活炎癥細胞因子,擴大炎癥,加劇AECOPD患者病情惡化,增加PH發生的風險[21]。BNP增加AECOPD患者PH發生風險的機制可能為,BNP高表達可誘導局部自身免疫性損傷加劇,促進肺泡上皮過氧化損傷及修復機制障礙等,BNP可促進AECOPD進展過程中小氣道重塑、平滑肌增生等,進而增加肺通氣阻力,導致AECOPD病情惡化,增加PH發生的風險[22]。
為進一步明確GDF-15、BNP是否可預測AECOPD患者發生PH,本研究進一步繪制ROC曲線,結果顯示,患者入院時血清GDF-15、BNP單獨及聯合檢測預測AECOPD患者PH發生風險均有一定價值,且當二者的cut off值分別取2.86 μg/L、151.53 pg/mL時可獲得最佳預測價值,提示早期監測AECOPD患者血清GDF-15、BNP水平對預測PH發生風險有重要意義,未來可考慮動態監測AECOPD患者血清GDF-15、BNP表達水平,若發現二者表達水平異常升高,可采取合理干預措施,如及時抗感染治療,以降低PH發生的風險。此外,本研究還觀察了血清GDF-15、BNP之間的關系,發現二者呈正相關,提示GDF-15、BNP可能相互作用,共同參與AECOPD的發生及發展,但二者相互作用具體機制尚未闡明。本研究還存在一定的局限,如僅觀察CRP、TLR4、GDF-15、BNP與PH發生的關系,其他可能的相關指標并未納入,仍有待進一步觀察其他血清炎癥指標與AECOPD患者PH發生的關系;此外,本研究未深入探究主要血清指標與AECOPD患者PH程度的關系,具體情況還需進一步研究證實。
綜上所述,AECOPD患者入院時血清GDF-15、BNP水平異常表達與PH發生有一定關系,二者過表達可能是PH發生的風險因子,早期監測患者血清GDF-15、BNP表達水平,對預測AECOPD患者PH的發生有一定價值。

