基于網絡藥理學結合細胞和分子實驗探究地榆皂苷Ⅱ抗鼻咽癌的潛在靶點和作用機制*
郭興喆,白先愚,楊萌哲,成南南,徐 寧,周守常,覃柳潔,黃建春,焦愛軍△
(廣西醫(yī)科大學 1.生命科學研究院;2.生物化學與分子生物學教研室;3.藥學院,南寧 530021)
鼻咽癌是一種好發(fā)于鼻咽側壁和頂部、在我國南方地區(qū)發(fā)病率較高的惡性腫瘤之一[1],在全世界范圍內,超過半數的鼻咽癌病例都是發(fā)生在中國[2]。我國南部地區(qū)平均發(fā)病率約為3/10 000[3-4]。在鼻咽癌的治療中,遠處轉移和局部浸潤是治療難處之所在[5],需要使用放療化療相聯合的綜合治療策略[6]。現階段,需研發(fā)新的化療輔助藥物,以降低治療期間的不良反應[7]。
近幾年來,國家政策大力扶持中醫(yī)藥事業(yè),但目前多以復方研究為主,因成分復雜,機制較難探索,限制了其臨床應用及推廣[8]。因此,中藥單體的研發(fā)無疑為抗腫瘤中藥提供了新的出路。大量文獻表明,中藥單體在抗癌作用上有顯著的表現,很大程度上填補了傳統(tǒng)中醫(yī)藥復方的短板。郭良芬等[9]的研究顯示,采用中藥單體治療鼻咽癌,能顯著減輕放化療的急性毒副反應等不良反應,提高患者生存質量。因此,探尋潛在的抗癌中藥,對改善臨床療效和提高患者生存質量具有重大意義。
地榆皂苷Ⅱ是一種三萜皂苷類化合物,化學式為C35H56O8,分子量為604.82,外文名稱為Ziyuglycoside Ⅱ,提純于中藥地榆。中藥地榆記載于著作《神農本草經》,具有收縮脈管、抗真菌、活血化瘀等作用,在臨床上用于燙傷,炎癥等疾病的治療[10]。有文獻表明,在乳腺癌細胞MDA-MB-435及胃癌細胞BGC-823中,地榆皂苷Ⅱ可以通過激活線粒體凋亡通路,抑制癌細胞的增殖,促進細胞凋亡,從而達到抗癌目的[11-12]。在MDA-MB-231 和MCF-7 乳腺癌細胞株中,地榆皂苷Ⅱ能通過上調活性氧(ROS),引起細胞周期阻滯,并通過激活JNK及其相關下游凋亡通路,誘導細胞凋亡[13]。以上研究表明,地榆皂苷Ⅱ是良好的抗癌中藥單體,但目前在抗鼻咽癌的效果和作用機制上尚未見報道。因此,本研究運用網絡藥理學的分析方法來預測地榆皂苷Ⅱ對鼻咽癌的潛在靶點及相關通路信息,再通過細胞和分子實驗驗證,從而為臨床研究和應用提供理論依據。
1 材料與方法
1.1 網絡藥理學分析預測
1.1.1 鼻咽癌靶點篩選
通過Pubchem 數據庫(http://pubchem.ncbi.nlm.nih.gov/)搜索關鍵詞“Ziyuglycoside Ⅱ”得到其3D機構,再導入Swisstarget 平臺(http://www.swisstargetprediction.ch/),可得到相關預測靶點。再通過GeneCards 數據庫(http://www.genecards.org/)搜索關鍵詞“鼻咽癌”,得到其相關靶點。通過韋恩圖繪制在線平臺(http://bioinformatics.psb.ugent.be/webtools/Venn/)繪制鼻咽癌與Ziyuglycoside Ⅱ的靶點交集圖。
1.1.2 PPI(protein-protein interaction)的網絡可視化構建及分析
通過String數據庫(https://string-db.org/)將韋恩圖取交集得到的基因數據輸入到String 數據庫,通過相關繪圖軟件繪制PPI網絡圖。
1.1.3 GO功能富集分析和KEGG pathway通路
通過David 數據庫(https://david.ncifcrf.gov/)對鼻咽癌與Ziyuglycoside Ⅱ靶點交集進行京都基因與基因組百科全書(Kyotoencyclopedia of genes and genomes,KEGG)通路富集分析和基因本體(gene ontology,GO)功能富集分析,得到相關靶點功能和通路分析。
1.1.4 化合物—靶點—通路網絡圖
收集地榆皂苷Ⅱ抗鼻咽癌的交集靶點和KEGG通路富集分析結果,并導入Cytoscape 3.7.2 軟件構建制作“化合物—疾病—靶點—通路”關系網絡圖。
1.2 實驗驗證
1.2.1 CCK-8 法驗證地榆皂苷Ⅱ對鼻咽癌細胞增殖的抑制作用
采用CCK-8 法測定地榆皂苷Ⅱ對5-8F 細胞增殖抑制作用,取狀態(tài)較好處于對數生長期的5-8F細胞,用含0.25%EDTA的胰酶消化,重懸為單細胞懸液,按照5 000/孔的細胞密度接種于96孔培養(yǎng)板中,在5%CO2的恒溫培養(yǎng)箱中貼壁12 h,小心地吸出培養(yǎng)液,分別加入含地榆皂苷Ⅱ的培養(yǎng)基100 μL,濃度設為4 umol/L,每組設3 個復孔。在5%CO2的恒溫培養(yǎng)箱中分別培養(yǎng)24 h、48 h、72 h 后,吸出含地榆皂苷Ⅱ的培養(yǎng)基,用PBS清洗2遍,按照CCK-8使用說明書,每孔加入100 μL RPMI-1640 培養(yǎng)基和10 μL CCK-8,于5% CO2的恒溫培養(yǎng)箱中孵育80 min。用酶標儀檢測在450 nm波長下各孔的光密度(A),計算地榆皂苷Ⅱ對細胞的抑制率并繪制細胞抑制率曲線。實驗重復3次。
細胞生存率=(A 地榆皂苷Ⅱ-A 空白)/(A 對照-A 空白)
1.2.2 Western blotting檢測蛋白表達
取處于對數生長期的5-8F細胞,將細胞密度調整為5×105/mL 接種于6 孔板,體積為每孔1.5 mL,置于培養(yǎng)箱內培養(yǎng)24 h,4 umol/L 濃度藥物處理細胞結束后,收集各組細胞,用PBS 緩沖液清洗3 次,再加入細胞裂解液裂解細胞30 min,之后用超聲粉碎細胞;再將細胞液放置于低溫離心機離心15 min,轉移上清液于新的EP 管中,并用BCA 蛋白試劑盒測定具體蛋白濃度。一定量的蛋白樣品與上樣緩沖液按比例混合后煮沸5 min,SDS-PAGE電泳150 V恒壓70 min,WB濕轉(0.45 μm的PVDF膜)270 mA恒流65 h,5%脫脂奶粉室溫封閉1 h,TBST漂洗3次后分別加入相應一抗(1∶1 000)4 ℃孵育過夜,TBST漂洗3 次,室溫二抗(1∶5 000)反應1 h。用凝膠成像分析系統(tǒng)分析電泳條帶,內參作為對照,計算各處理組目的蛋白的相對表達情況。
1.3 統(tǒng)計學方法
采用SPSS 22.0 統(tǒng)計軟件進行數據分析,計量資料以均數±標準差()表示,兩樣本均數比較采用t檢驗,多組間均數比較采用單因素方差分析。以P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 網絡藥理學機制預測
2.1.1 地榆皂苷Ⅱ潛在靶點預測
通過PubChem分子庫獲得地榆皂苷Ⅱ的3D結構,見圖1。將3D 結構導入至Swisstarget 平臺中篩得地榆皂苷Ⅱ靶點,按照Probability排序,選取前10個基因名稱和靶點,見表1。
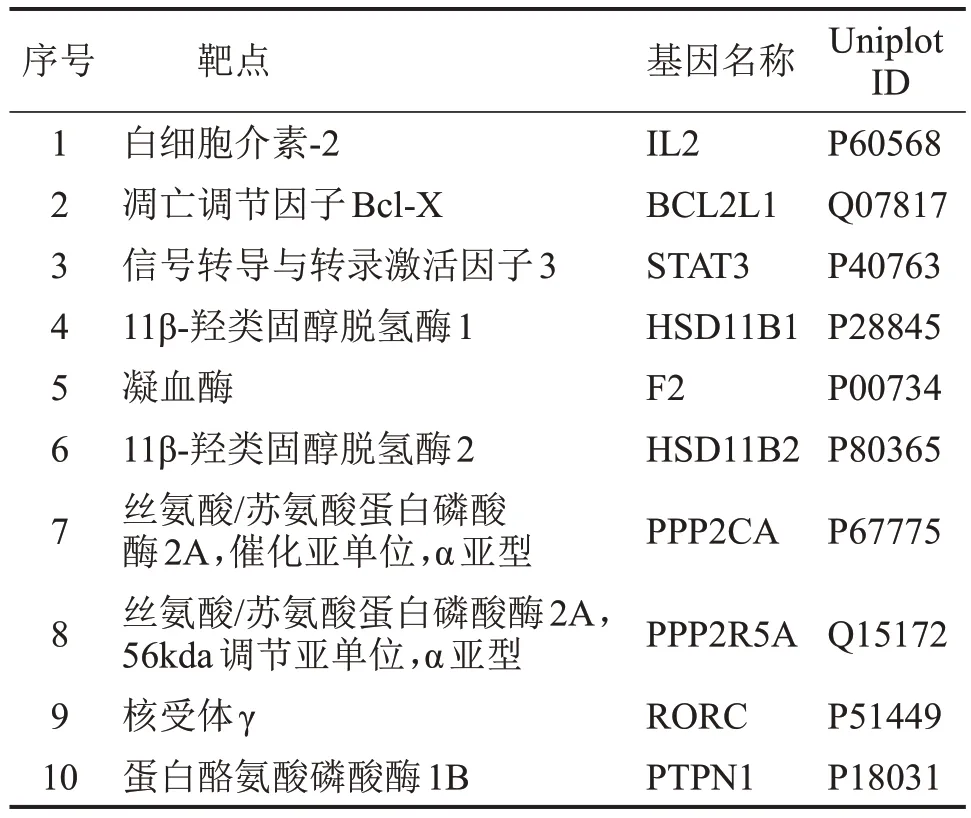
表1 地榆皂苷Ⅱ排名前10的潛在靶點
圖1 地榆皂苷Ⅱ的3D結構
2.1.2 地榆皂苷Ⅱ與鼻咽癌相關的共同靶點
從GeneCards數據庫中獲得與鼻咽癌相關的基因靶點共有1 942個。100個藥物靶點基因與1 942個鼻咽癌相關基因篩選出共同交集靶點基因38個,為地榆皂苷Ⅱ抗鼻咽癌的潛在靶點基因,見圖2。
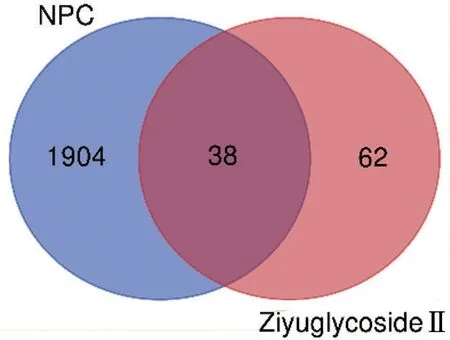
圖2 地榆皂苷Ⅱ抗鼻咽癌的潛在靶點
2.1.3 地榆皂苷Ⅱ與鼻咽癌相關靶點的PPI網絡
PPI網絡為復雜疾病構建多種蛋白質的多因素功能的可視化圖,因此,構建了地榆皂苷Ⅱ與鼻咽癌相關靶點的PPI 網絡圖。將38 個交集靶點導入STRING 數據庫,獲得地榆皂苷Ⅱ-鼻咽癌靶點PPI網絡圖,見圖3。

圖3 地榆皂苷Ⅱ抗鼻咽癌PPI網絡圖
2.1.4 GO功能富集注釋
將疾病和藥物交集的38 個共同靶點通過DAVID數據庫進行GO功能富集分析,根據P≤0.01,共篩選出233 個GO 條目。按照P值升序排列結果前10條顯著富集的條目,見圖4。結果表明,涉及內肽酶活性、相同蛋白質結合等分子功能;涉及多項生物調控機制,包括凋亡過程的負調控、蛋白質水解、RNA聚合酶Ⅱ啟動子轉錄的正調控、內皮細胞增殖的正調控等生物過程;涉及核質、細胞質、線粒體等細胞組成。推測地榆皂苷Ⅱ治療鼻咽癌可能與內肽酶活性、激酶活性、金屬內肽酶活性、RNA聚合酶Ⅱ啟動子轉錄的正調控、蛋白質磷酸化的正調控等生物過程。
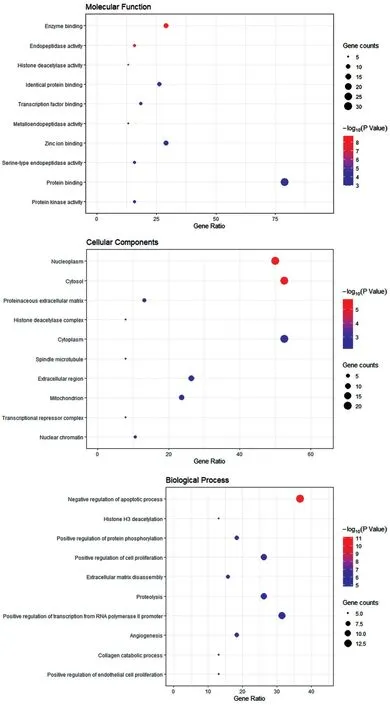
圖4 地榆皂苷Ⅱ抗鼻咽癌GO功能富集分析
2.1.5 KEGG通路富集分析
通過DAVID數據庫進行KEGG通路富集分析,共富集得到77條通路。根據P值排序,篩選出與鼻咽癌相關度最高的前19 條通路,見表2。富集結果顯示在癌癥信號通路(Pathways in cancer)、PI3KAkt 信號通路(PI3K-Akt signaling pathway)等通路上富集較多。
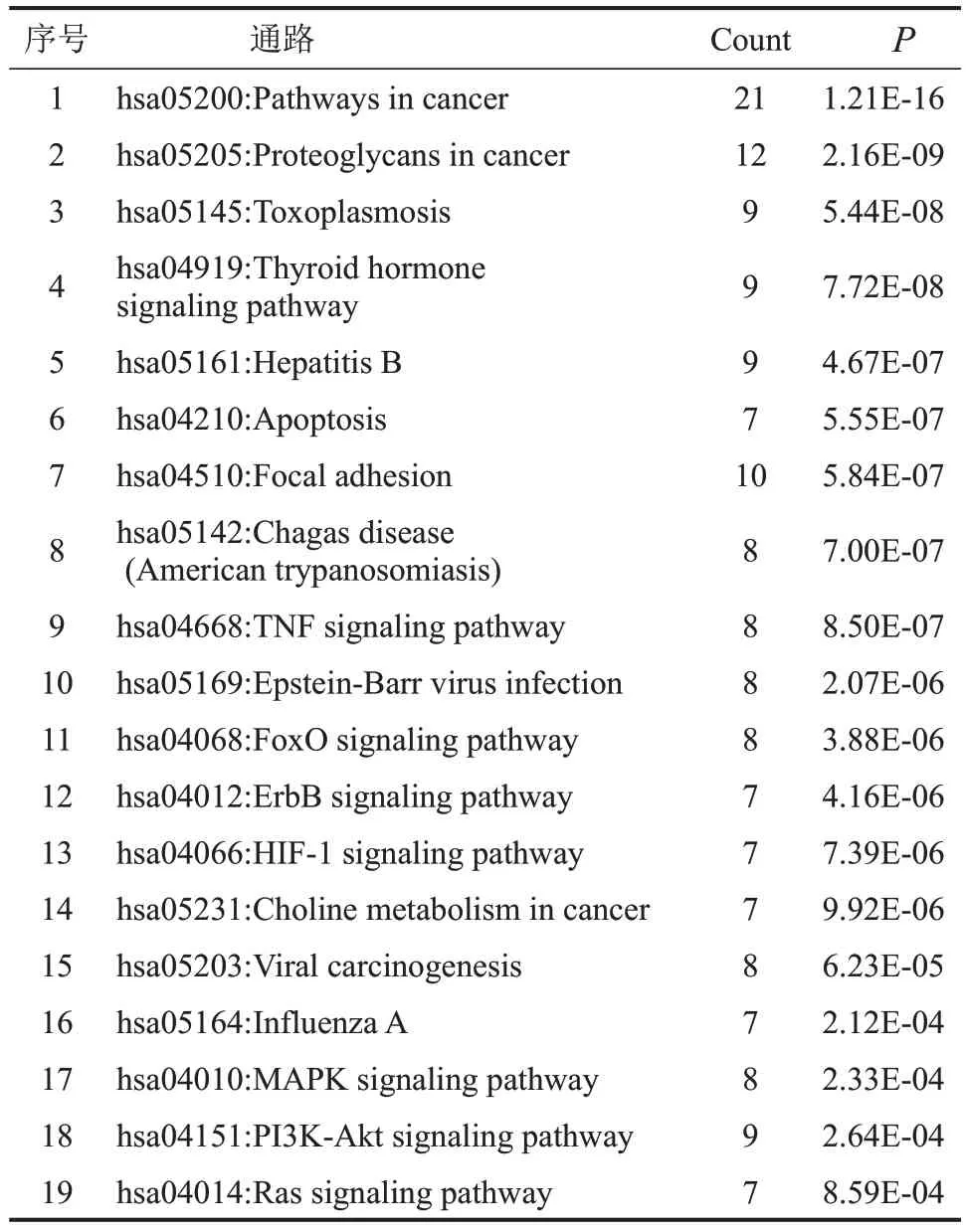
表2 地榆皂苷Ⅱ抗鼻咽癌KEGG富集結果
2.1.6 構建地榆皂苷Ⅱ抗鼻咽癌的“藥物—靶點—疾病—通路”網絡模型
通過構建“藥物—靶點—疾病—通路”網絡模型圖,可直觀展示地榆皂苷Ⅱ與鼻咽癌交集靶點及通路之間的相互作用關系及關聯程度,見圖5。圖中左側38 個黃色節(jié)點代表地榆皂苷Ⅱ抗鼻咽癌交集的靶點,根據節(jié)點的度值按順時針從大到小的梯度進行排列,右側19個綠色節(jié)點則對應了KEGG富集結果中的19條通路,節(jié)點間的連線顯示了通路和靶點間的相互作用關系,涉及的關鍵基因包括:AKT1、AKT2、MAPK10、PRKCA、GRB2、JUN、STAT3、MAPK14等。
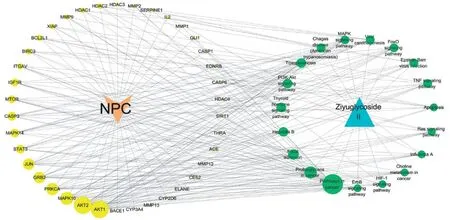
圖5 “藥物—靶點—疾病—通路”網絡圖
2.2 實驗驗證
2.2.1 CCK8細胞毒性實驗
結果如圖6所示,與對照組相比較,隨著地榆皂苷Ⅱ濃度的升高及作用時間的延長,其對5-8F細胞增殖抑制率明顯升高,作用時長為24 h、48 h、72 h的半抑制濃度(IC50)分別為34.47 μmol/L、33.68 μmol/L、19.89 μmol/L。
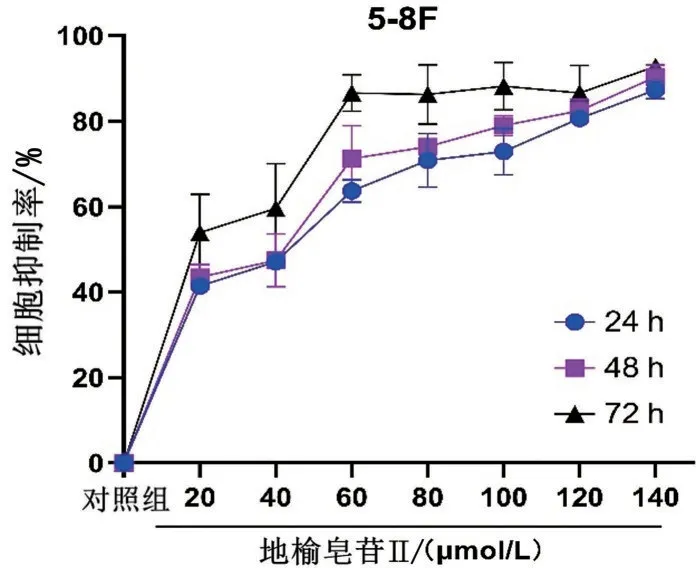
圖6 地榆皂苷Ⅱ對鼻咽癌5-8F細胞增殖的影響
2.2.2 Western blotting 實驗檢測地榆皂苷Ⅱ對PI3K和AKT蛋白表達的影響
Western blotting 實驗檢測結果顯示,與對照組相比較,100 μmol/L 地榆皂苷Ⅱ實驗組的AKT 和PI3K蛋白表達量顯著低于空白對照組(P<0.01),見圖7。
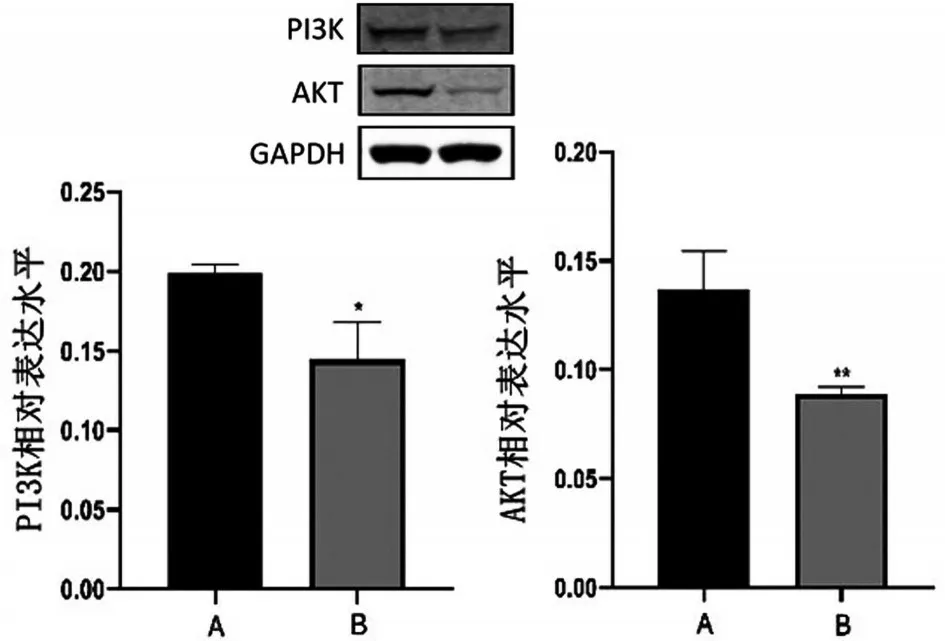
圖7 地榆皂苷Ⅱ對5-8F細胞PI3K/AKT信號通路蛋白的影響
3 討論
鼻咽癌是一種起病隱逸、前期癥狀不明顯、較難診斷和確診的疾病,雖然放療能大大提高患者生存率,但其帶來的副反應也深深地折磨著患者,臨床數據顯示,多數患者在化療后出現口舌干燥、口腔潰瘍、吞咽困難、腦脊髓損傷等諸多副反應[14]。因此,這些治療方式具有一定的局限性。
基于中藥單體在腫瘤治療中突出的療效,近些年來對于中藥單體治療腫瘤的研究顯著增加[15],尋找能有效治療腫瘤的中藥單體,成為目前的研究熱點和未來的發(fā)展方向。王振龍等[16]相關研究表示,中藥單體地榆皂苷Ⅱ可激活細胞凋亡途徑來抑制腫瘤細胞的增殖,促進腫瘤細胞的凋亡,吳澤承等[17]也通過相關實驗驗證了地榆皂苷Ⅱ可有效抑制人舌鱗癌細胞CAL27細胞株的增殖。
本研究分析了地榆皂苷Ⅱ“藥物—靶點—疾病—通路”網絡模型,結果顯示,AKT1、AKT2、MAPK10、PRKCA、GRB2 等度值較高,是地榆皂苷Ⅱ治療鼻咽癌的關鍵潛在靶點基因。再結合KEGG通路富集分析,結果顯示,在相關信號通路中,PI3KAKT 信號通路是地榆皂苷Ⅱ作用于鼻咽癌度值最高的關鍵通路。在PI3K-AKT 途徑當中,PIP3 的3位磷酸基團可同時招募AKT 和PDK1 蛋白到細胞膜上,使PDK1 蛋白將AKT 蛋白上308 號位的蘇氨酸(T308)磷酸化,致使AKT 蛋白部分活化,從而被活化的AKT 進一步調控激活下游通路。郭金蘭等[18]的研究表明,miR-17-5p 可通過下調PIK3R1 基因從而靶向激活PI3K/AKT信號通路抑制皮膚鱗狀細胞癌細胞凋亡,促進細胞增殖,說明PI3K/AKT信號通路對癌細胞的增殖和凋亡有重要影響;朱文潔等[19]的研究則表明MiR-1268b 可以靶向下調ERBB2-PI3K-Akt 通路從而抑制乳腺癌化療的耐藥性,從另一個角度證實了可通過下調PI3K/AKT 信號通路相關關鍵蛋白的表達,達到干預癌細胞的增殖,促進癌細胞凋亡;而朱振華等[20]則發(fā)現KIF20A與細胞周期、凋亡等功能密切相關,通過在腦膠質瘤中下調KIF20A高表達后,PI3K/AKT信號通路被明顯抑制,從而引起細胞周期阻滯和細胞凋亡。
本研究通過網絡藥理學預測結合細胞實驗、分子實驗等對地榆皂苷Ⅱ治療鼻咽癌進行了多維度多層次的研究和比較分析,預測了地榆皂苷Ⅱ對鼻咽癌的作用通路并驗證了其作用機制,本研究為未來鼻咽癌的臨床治療及實驗研究提供了參考依據。

