臍血移植治療難治復發急性白血病的臨床分析
朱 平 禹 環 符麗梅 廖 欣 熊暮珺 雷阿明 祝平安 梁欣荃
(湖南省郴州市第一人民醫院血液內科,湖南郴州 423000)
時至今日,難治復發急性白血病(relapsed/refractory acute leukemia,R/R-AL)仍然對患者的生命健康構成巨大威脅,目前對這類疾病最重要的根治手段是造血干細胞移植,而這項治療中的干細胞來源是關鍵所在。在同胞全合、親緣單倍體、骨髓庫和臍血庫等供者來源中,同胞全合在多數情況下被認為是最佳供者來源。相對于某一同胞供者而言,人類白細胞抗原(human leukocyte antigen,HLA)全合的概率只有1/4,而在獨生子女、少子化等現實情況下,這種同胞全合的供者常常成為稀缺。隨著移植技術在近年來不斷發展成熟,全球范圍內親緣單倍體和非親緣骨髓庫、臍血庫供者的移植數量已經超過同胞全合供者的移植數量,而且這些替代供者移植的療效也已經接近甚至超過同胞全合供者的移植[1]。其中臍血作為一種同時具備來源易得、移植物抗白血病(graft-versus-leukemia,GVL)作用強、排斥反應輕等優點的替代供者而在造血干細胞移植領域備受關注[2-3]。
湖南省郴州市第一人民醫院血液內科自2016年1月開始開展臍血移植,至2020年12月共采用臍血移植(umbilical cord blood transplantation, UCBT)方法治療難治復發急性白血病R/R-AL 22例,本文對這組病例的臨床特點、預處理方案、移植相關并發癥、臨床療效等情況作一回顧性分析,報道如下。
1 對象與方法
1.1 研究對象
本研究納入2016年1月至2020年12月在本院運用UCBT治療的R/R-AL患者共22例。患者中位年齡33(16,52)歲;病例包括難治復發急性髓系細胞白血病(relapsed/refractory acute myelocytic leukemia,R/R-AML)18例、難治復發急性淋巴細胞白血病(relapsed/refractory acute lymphocytic leukemia, R/R-ALL)4例。患者基線資料詳見表1。
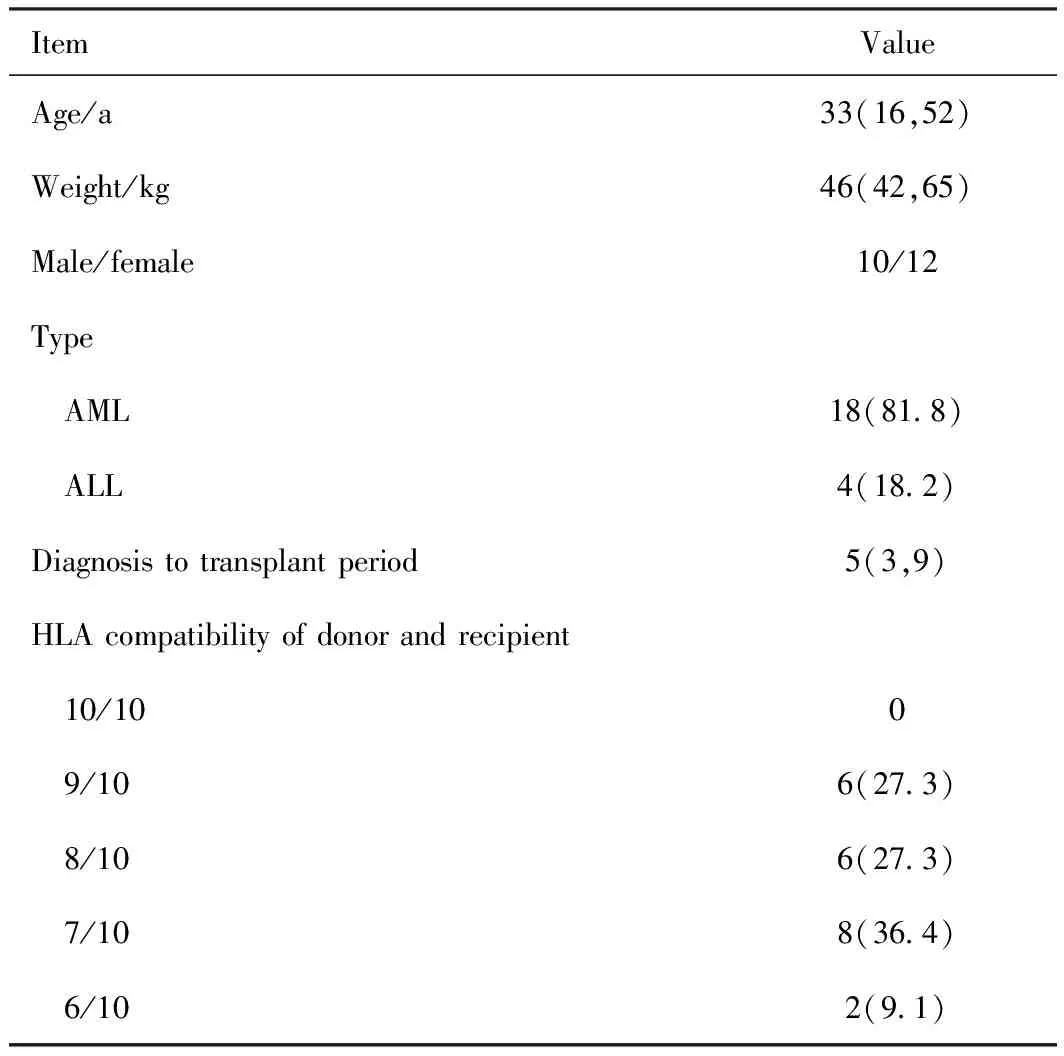
表1 患者血液病基線及移植相關資料Tab.1 Patients’ blood disease baseline and transplantation-related data [M(P25, P75), n (%)]
1.2 供者來源
本研究中所用臍血均來自國內相關部門驗收合格并批準設立的公共臍帶血造血干細胞庫。移植前進行HLA-A、B、C和DRB1、DQB1 5對基因10個位點的高分辨配型。22例患者中,9/10相合6例、8/10相合6例、7/10相合8例、6/10相合2例(表1)。
1.3 預處理
本研究所有患者移植前預處理均采用純化學藥物治療(以下簡稱化療)方案:白消安(Bu)/環磷酰胺(Cy)/氟達拉濱(Flu)方案。Bu:12.8 mg·kg-1·d-1,分4 d,-7~-4 d;Cy:120 mg·kg-1·d-1,分2 d,-3~-2 d;Flu:120 mg/m2,分4 d,-9~-6 d。全部病例-7 d一次口服司莫司汀250 mg;R/R-AML患者在上述預處理前加用地西他濱20 mg·kg-1·d-1,5 d。
1.4 移植物抗宿主病(graft versus host disease,GVHD)預防
本研究全部病例均使用以環孢霉素A(cyclosporin,CsA)/霉酚酸酯(mycophenolatemofetil,MMF)為基礎的GVHD預防方案。CsA 2.5~3.0 mg·kg-1·d-1,-1 d開始,持續靜脈滴注,血濃度要求維持為200~250 mmol/L;腸道功能恢復之后CsA改口服,每天量分2次,口服前谷濃度要求為150~200 mmol/L;根據是否出現GVHD、病毒感染或是否存在高危復發等情況,CsA在移植后2個月左右開始減量,移植后半年左右停藥。MMF在+1 d開始口服,劑量為20~30 mg·kg-1·d-1、分次口服,如果沒有出現GVHD, +20 d起開始減量,2~3個月停藥。本方案GVHD的預防沒有使用甲氨蝶呤(methotrexate, MTX)和兔抗人胸腺細胞球蛋白(rabbit anti-human thymocyte globulin,rATG)。慢性GVHD的分度參考2015年美國國立衛生研究院指南[4]。
1.5 支持及對癥處理
肝靜脈閉塞癥(veno-occlusive disease, VOD) 預防:預處理當天開始使用低分子肝素0.2 mL每日1次,前列地爾10 μg 每8 h 1次,均用至造血恢復時。病毒防治:+1 d開始阿昔洛韋250 mg,靜脈滴注,一日二次,造血和胃腸功能恢復后阿昔洛韋改口服,0.2 g/次,一日3次,隔周服1周,至移植后4~5年。粒系造血恢復后每周1~2次巨細胞病毒(cytomegalovirus, CMV)-DNA檢測,當血CMV-DNA≥103copy/mL時,靜脈滴注更昔洛韋,加或不加膦甲酸鈉搶先治療至病毒轉陰。卡氏囊蟲肺炎預防:復方新諾明從移植前2周左右開始口服至-2 d之前,造血恢復后再恢復口服,維持1年。造血生長因子的使用:+6 d開始皮下注射粒細胞刺激因子300 μg,一日1次,至髓系穩定植入。本組病例未使用紅系和巨核系刺激因子。血制品輸注前均經25 Gy X線照射或經紅細胞濾器或血小板濾器濾除可能存在的獻血者干細胞。
1.6 隨訪
通過門診隨訪或者電話溝通,安排隨訪的最后一天為2021年5月31日。無病生存(disease-free survival, DFS)時間:從輸入造血干細胞到復發或死亡,最晚不超過2021年5月31日。總生存(overall survival, OS)時間:從輸入造血干細胞到病例死亡或到2021年5月31日。無GVHD、無復發生存(GVHD-free and relapse-free survival,GRFS)率:指患者無急慢性排異、無疾病復發生存。
1.7 統計學方法
采用SPSS 19.0統計軟件對數據進行處理及統計分析。符合正態分布的計量資料,兩組間比較采用獨立樣本t檢驗,不符合正態分布數據采用Mann-whitneyU檢驗。采用Kaplan-Meier法繪制生存曲線,并采用Log-rank檢驗患者的粒細胞植入率、血小板植入率、GVHD發生率、移植相關病死率(transplantation related mortality,TRM)、復發率等差異是否有統計學意義。所有檢驗結果均以P<0.05為差異具有統計學意義。
2 結果
2.1 重建造血功能
①粒系造血重建:本組病例+42 d中性粒細胞100.0%植入,植入時間的中位數為17.5(11,31) d。②巨核系造血重建:本組病例有1病例+62 d死亡,此時血小板并未見植入,因此本組病例共有21個病例可評估,+100 d血小板植入率達到了90.5%(19/21),時間中位數為39(15,96) d,血小板未植入病例中+100 d死亡者1例,+117 d血小板植入1例。
2.2 GVHD發生情況
本組病例+100 d內,發生Ⅱ~Ⅳ度急性GVHD(acute GVHD,aGVHD)的患者10例,占45.5%(10/22),發生Ⅲ~Ⅳ度aGVHD的患者8例,占36.4%(8/22)。至隨訪截止,發生慢性GVHD(chronic GVHD,cGVHD)的患者4例,發生重度cGVHD的患者2例,占比分別為21.1%(4/19)和10.5%(2/19)。
2.3 并發癥發生情況
本組病例CMV血癥發生率77.3%(17/22);出現出血性膀胱炎的比率31.8%(7/22)。本組病例移植后,血流感染6例,肺部感染6例,有病原學結果的4例(分別為鮑曼不動桿菌、綠膿假單胞各1例, 肺部曲霉菌2例);另外后期出現帶狀皰疹3例。沒有發現因為臍血移植后粒系造血恢復遲緩而岀現增加致死性感染的情況。
2.4 生存分析
本組病例的隨訪時間中位數為26(2,59)個月。180 d TRM為24.3%,3年累積復發率為3.2%。OS率為71.4%,DFS率為70.9%; GRFS率為58.6%。至隨訪截止,本組病例共有6例患者死亡,中位生存期78(52,275)d,死亡原因:Ⅳ度aGVHD 2例,肺部感染3例,中樞神經系統病毒感染1例。
3 討論
異基因造血干細胞移植常常是R/R-AL患者唯一的根治手段。本文通過觀察患者接受治療后的造血恢復、相關并發癥以及療效等情況,重點探討臍血移植技術的特點及優劣性。
總的來說,與國內3篇文獻[5-7]比較,本組患者在降低cGVHD的發生、減少復發、增加GRFS方面均表現出一定的優勢。全球超過30年臍血移植的實踐證實,臍血移植具有如下兩大優勢:①UCBT后的患者cGVHD常常很輕,很少出現重度cGVHD的患者,因此臍血移植的患者生活質量好。這一點很重要,因為非臍血來源的造血干細胞移植后常常因為嚴重的cGVHD而影響患者的生活質量。② 接受UCBT后的惡性血液病患者的復發率明顯下降,一些高復發風險的患者在UCBT之后存活[8]。針對上述兩大優勢的基礎研究一刻也沒有停止。①為什么UCBT之后cGVHD發生率降低而且程度減輕?Fatobene等[9]的研究將非血緣UCBT與7/8 HLA相合的非血緣非臍血來源的造血干細胞移植做了對比,UCBT對cGVHD相關的器官損害程度明顯減輕,導致殘疾的病癥如皮膚硬化、干燥性角結膜炎發生率明顯下降、嚴重程度明顯減輕。CDl9+CD24hiCD38hi調節性B細胞(regulatory B cell,Breg)產生的白細胞介素-10(interleukin-10,IL-10)對移植排異過程的影響很大,Sarvaria等[10]的研究顯示,臍血細胞中至少半數為Breg,而成人外周血細胞中只有4%左右的Breg,兩者數量相差懸殊。UCBT治療之后,Breg細胞生成大量的IL-10, 而IL-10傳導的是負向免疫應答信息,這樣在導致GVHD的發生率下降的同時,GVHD造成的器官損害程度也會減輕[10]。②相比于非臍血來源的造血干細胞移植,UCBT后的惡性血液病的復發率為什么會明顯降低?很多學者亦做了研究,其中Hiwarkar等[11]研究了臍血和成人外周血中的T淋巴細胞,發現臍血中CD8+T淋巴細胞比例明顯高于外周血,CD8+T淋巴細胞能夠誘導同種異體反應產生強烈的移植物抗白血病作用。他們將臍血和成人外周血淋巴細胞分別接種至荷瘤小鼠的腫瘤組織中,前者分化出的CD8+T淋巴細胞數目更多、CD8+T淋巴細胞表達出大量的腫瘤壞死因子(tumor necrosis factor,TNF),誘發強烈的腫瘤殺傷效應,這一反應對徹底清除腫瘤細胞、防止腫瘤復發發揮了關鍵作用。本研究中,沒有使用rATG預防GVHD,從而保留了前述臍血中的T淋巴細胞及其功能,這項措施對減少復發應具有關鍵作用。
臍血細胞數量少,因此為了確保造血植入,臍血細胞數量備受關注。盡管臨床上尚未能發現獲得成功植入所需要的最低細胞數(閾值),但國際上仍然有標準作為參考。Eapen等[12]推薦的標準是有核細胞數量(冷凍前)要達到≥3.0×107/kg (受者體質量)。但與有核細胞數量相比,目前臍血移植專家認為CD34+細胞數量更為重要,這方面有代表性的專家之一Nakasone[13]認為足夠高數量的CD34+細胞才是臍血成功植入的關鍵。目前美國國家骨髓捐獻項目(National Marrow Donor Program,NMDP)有關臍血移植的指南[14]建議是CD34+細胞數量(冷凍前) ≥1.5×105個(受者體質量)。不過實際情況更讓人樂觀,因為臨床上更低數量的細胞數仍然可能不影響植入。本研究中有患者有核細胞數量低至1.96×107/kg(受者體質量),還有患者CD34+細胞低至0.75×105/kg(受者體質量),但并未觀察到影響造血植入的情況。與單倍體移植比較,盡管UCBT后中性粒細胞和血小板的植入都明顯要慢,但并未觀察到因此而增加患者死亡的情況。
近年來造血移植領域中供者特異性抗體(donor-specific antibody,DSA)這一指標倍受關注。在替代供者(非同胞全合供者)移植中,釆用DSA陽性供者被認為是植入失敗的重要原因[15],這一影響在臍血移植中尤甚。本研究中避免選擇DSA陽性臍血。
安徽省立醫院朱江等[16]觀察到,UCBT與同胞全合造血干細胞移植治療難治性白血病比較,UCBT后的cGVHD發生率更低,重癥cGVHD發生率也更低。UCBT治療之后,GRFS率對比MSD-HSCT組要高得多,本文觀察到與上述文獻一致的結果。
至隨訪截止,本組沒有復發病例,分析原因除UCBT后復發率低的因素外,與入組病例AML占了絕大多數(18例,81.8%)亦有關,因為AML不論移植或非移植治療的復發率都比ALL要低。無GVHD、無GRFS是造血干細胞移植后患者追求的最佳生存狀態,UCBT治療后重度cGVHD發生率低、復發率低正好趨同于上述目標。本研究表明,臍血是缺乏HLA全合親緣供者造血干細胞移植的替代供者,優于親緣單倍體和非親緣骨髓庫供者。

