黑龍江省馬鈴薯晚疫病菌線粒體DNA單倍型分析
郭 梅,楊 帥*,王文重,魏 琪,董學志,毛彥芝,王 玲,李學敏,李學峰,劉雅萍,刁 琢,閔凡祥
(1.黑龍江省農業科學院馬鈴薯研究所,黑龍江 哈爾濱 150086;2.黑龍江省農業科學院耕作栽培研究所,黑龍江 哈爾濱 150086;3.牙克石森峰薯業有限責任公司,內蒙古 牙克石 022150;4.大興安嶺地區農業林業科學研究院,黑龍江 加格達奇 165000)
由致病疫霉菌(Phytophthora infestans)引起的馬鈴薯晚疫病是馬鈴薯生產上最具威脅的毀滅性病害[1],其病原菌可通過游動孢子對馬鈴薯實施侵染,引起生長季植株葉片出現水浸狀軟化進而萎蔫、枯死,同時還能傳導至薯塊并潛存其中引起腐爛,成為下一年馬鈴薯晚疫病大發生的主要初侵染源[2]。自1845年馬鈴薯晚疫病在愛爾蘭引起駭人聽聞的“大饑荒”事件至今,該病始終威脅著全球馬鈴薯健康生產,并造成巨大的經濟損失[3]。馬鈴薯晚疫病菌群體結構變化直接影響著病害的發生與流行[4]。近年來,隨著晚疫病菌表現型和基因型研究的更加深入,國內外學者認為A2交配型的存在是該病能在世界范圍內頻繁發生和流行的主要原因[5],這一發現也再次引起了國際社會的極大關注[6]。
相比于核基因組,線粒體基因組的結構簡單、單親遺傳以及無組織特異性等特點,使其在監測晚疫病菌遷移、流行及群體遺傳結構動態變化的研究中發揮重要作用[7]。目前,國內外在線粒體DNA 多態性的研究方面主要采用PCR-RFLP法[8]。Griffith 和 Shaw[8]利用改進的 PCR-RFLP 方法將線粒體單倍型分為Ia,IIa,Ib 和IIb 四種單倍型。四種單倍型在世界的不同國家和地區的分布情況不盡相同,但普遍認為Ib 為舊群體,其他三種單倍型為新群體。目前國內外主要是采用這種方法進行晚疫病菌線粒體DNA 單倍型的檢測。
中國是世界馬鈴薯生產第一大國,種植面積和總產量均居世界第一位[9]。黑龍江省因兼具極佳的地理位置和得天獨厚的冷涼氣候,成為中國重要的馬鈴薯種薯及商品薯主產區之一[10]。然而,由于近幾年黑龍江省馬鈴薯生長季節持續出現降雨量大且周期長等特殊天氣,馬鈴薯晚疫病在哈爾濱、綏化、克山等主要種植區發生十分嚴重。因此,本試驗通過系統分析近年來黑龍江省主產區及哈爾濱地區晚疫病菌線粒體DNA 單倍型情況,以期更好地了解黑龍江省晚疫病菌遺傳結構組成,監測群體變化動態,從而為晚疫病的深入研究奠定基礎,進而為制定符合黑龍江省馬鈴薯生產的晚疫病防控策略提供指導。
1 材料與方法
1.1 供試菌株
供試晚疫病菌分別于2015~2020 年采自黑龍江省哈爾濱、齊齊哈爾、綏化、鶴崗、伊春、黑河和大興安嶺7 個馬鈴薯生產區,所選帶病植株均帶有明顯晚疫病癥狀。采用常規組織分離法將帶病組織接于新鮮的薯塊上,18℃下恒溫培養約一周時間,至薯塊上長滿白色菌絲后,用無菌接種針挑取菌絲至黑麥培養基上,18℃下培養以獲取純化的晚疫病菌,實驗室保存、備用。
1.2 菌株基因組DNA 的提取
采用基因組DNA提取試劑盒提取經分離、純化培養后獲得的晚疫病菌DNA。提取DNA后,利用微量核酸蛋白濃度測定儀檢測DNA 純度,當OD260/OD280值大于1.8時,DNA符合后續試驗要求。
1.3 線粒體DNA 單倍型分析
采用 Griffith 和 Shaw[8]的 PCR-RFLP 方法進行線粒體DNA 單倍型分析,引物信息見表1。PCR擴增反應采用商品化PCR Mix 的20 μL 體系進行。PCR 反應體系為:94℃預變性5 min;94℃變性30 s,54℃退火 30 s,72℃延伸1 min,34 個循環;72℃下延伸5 min,4℃保存。之后利用內切酶 Msp I 和 EcoR I 對 5 μL 的 PCR 產物于 37℃條件下進行酶切。酶切產物于1.5%瓊脂糖凝膠中電泳,利用凝膠成像儀在紫外光下檢測并拍照。
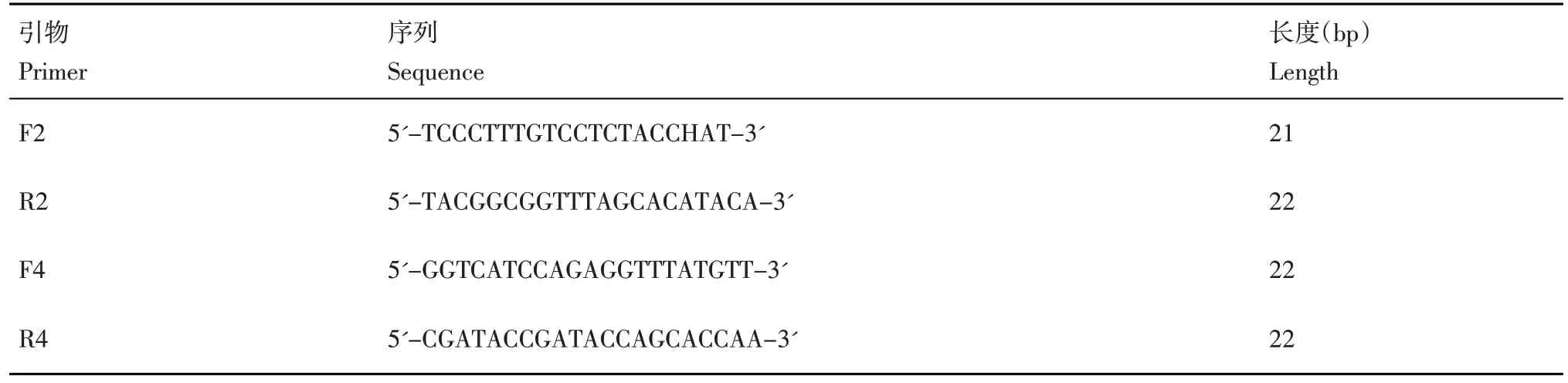
表1 線粒體DNA 單倍型測定引物Table 1 Primers for detection of mtDNA haplotype
1.4 線粒體單倍型的鑒定原則
馬鈴薯晚疫病菌mtDNA 單倍型劃分標準參照Griffith 和Shaw[8],根據相應條帶在對應位置上的有無,判斷菌株的單倍型類型,具體見表2。
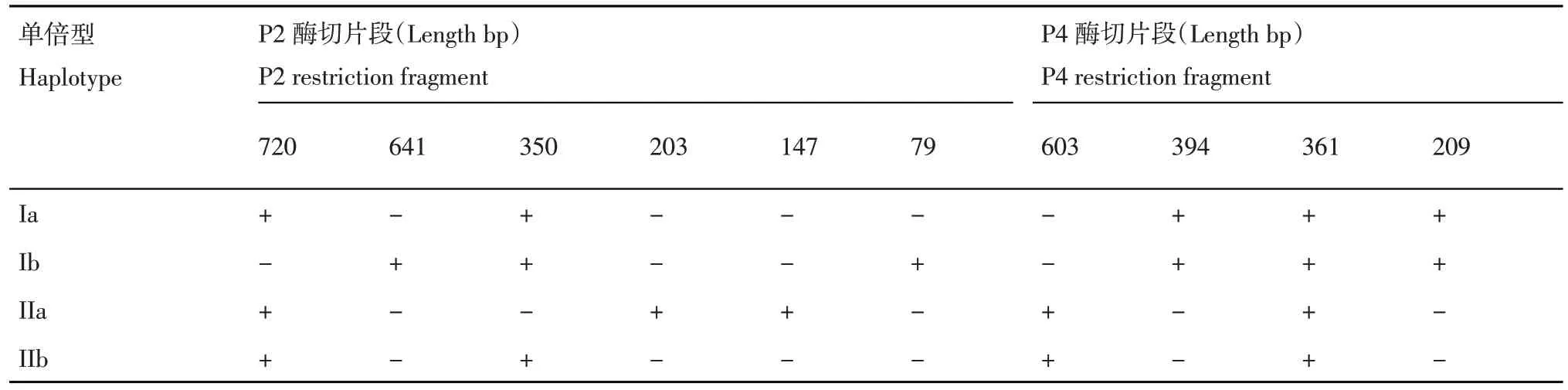
表2 依據酶切片段劃分致病疫霉mtDNA 單倍型的標準Table 2 Classification standard of mtDNA haplotypes of P. infestans by restriction fragment
2 結果與分析
2.1 馬鈴薯晚疫病菌樣品采集及分離
2015~2020 年在黑龍江省哈爾濱、齊齊哈爾、綏化、鶴崗、伊春、黑河和大興安嶺7 個馬鈴薯主產區共采集分離了193 份馬鈴薯晚疫病菌菌株樣品,具體信息如表3 所示。

表3 2015~2020 年黑龍江省晚疫病菌樣品采集信息Table 3 Information of P. infestans isolates collected from 2015 to 2020 in Heilongjiang Province
2.2 線粒體DNA 單倍型鑒定分析
由圖1 可知,P2 擴增片段可以被MspI 酶切為720 和 350 bp 兩個片段,或是 720,203 和 147 bp三個片段,或者是641,350 和79 bp 三個片段,分別對應 的 mtDNA 單倍型為 Ia 或 IIb 和 Ib 及 IIa。P4擴增片段可以被EcoRI酶切為609和361 bp兩個片段,或者是394,361 和209 bp 三個片段,分別對應的 mtDNA 單倍型為 IIa 或 IIb 和 Ia 或 Ib。當 P2擴增片段經MspI 酶切為720 和350 bp 兩個片段時,使用EcoRI 酶切P4 擴增片段進行驗證,當得到609 和361 bp 兩個片段時,該樣品的單倍型為IIb,當得到394,361 和209 bp 三個片段時,該樣品的單倍型為Ia。

圖1 線粒體DNA 單倍型檢測結果判斷電泳圖Figure 1 Electrophoresis for detection of mtDNA haplotypes
根據判定標準,2015~2020年黑龍江省7個馬鈴薯種植區的193份樣品中共發現3個基因型,分別為Ia、IIa 和 Ib。其中,172 份晚疫病樣品為 IIa 單倍型,占比89.12%,為優勢線粒體DNA 單倍型;19份晚疫病樣品為Ia 單倍型,占比9.84%;2 份晚疫病樣品為Ib 單倍型,占比1.04%;所有樣品中未發現IIb 單倍型。從采集地點分析(表4),哈爾濱地區發現3 種mtDNA 單倍型,齊齊哈爾地區除發現Ia 和IIa 兩種單倍型,其他地區樣品均為IIa 單倍型。說明哈爾濱和齊齊哈爾地區馬鈴薯mtDNA單倍型類型復雜,其他地區馬鈴薯晚疫病菌mtDNA 單倍型結構單一。從采集年份分析,哈爾濱地區5 年來mtDNA 單倍型變化見圖2,除2017年Ia 單倍型占優勢外,其他年份基本都是以IIa 單倍型為主,同時2019 年檢測發現Ib 單倍型的存在,說明哈爾濱地區年際間晚疫病菌的遺傳結構存在動態變化。
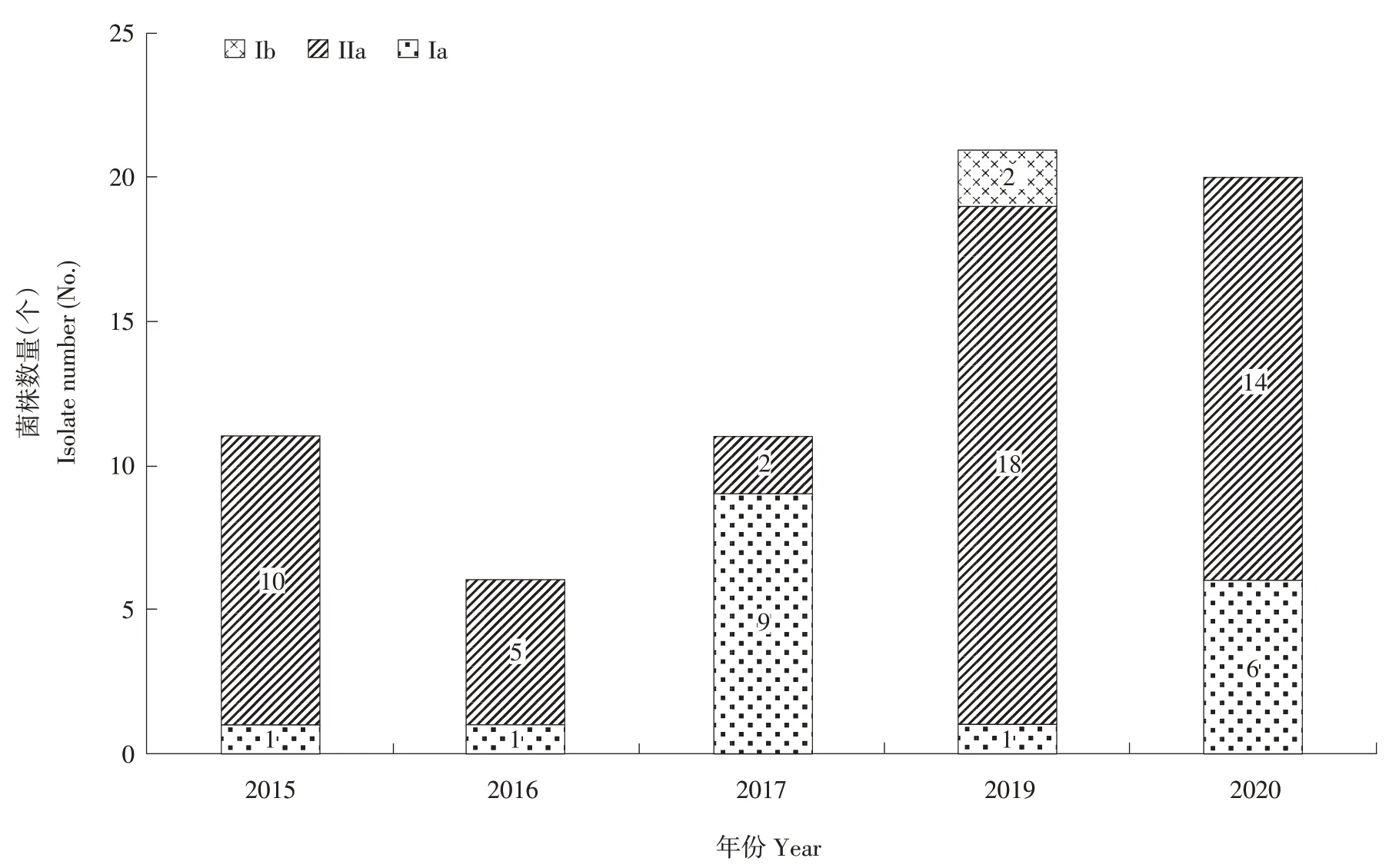
圖2 哈爾濱地區晚疫病菌線粒體DNA 單倍型年度變化Figure 2 mtDNA haplotypes of P. infestans isolates collected from Harbin City
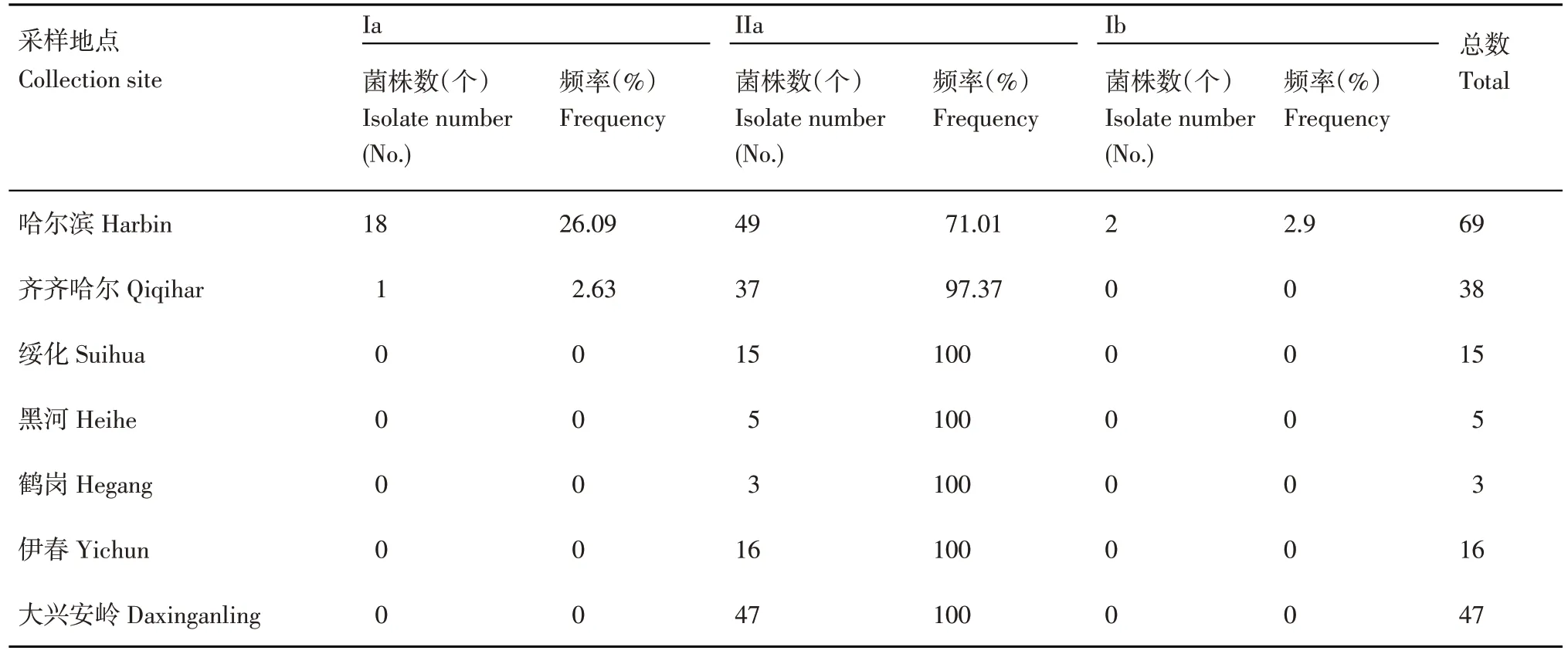
表4 黑龍江省晚疫病菌mtDNA 單倍型及其分布Table 4 mtDNA haplotypes and distribution of P. infestans isolates collected in Heilongjiang Province
3 討 論
基于線粒體DNA(mtDNA)的基因型研究是分析微生物地理來源方面的一個很有利的工具,利用此標記可以追溯某些微生物的起源與演變路線[11]。由于致病疫霉線粒體DNA 結構相對簡單且穩定性良好,因此被廣泛用于致病疫霉菌的群體起源和演化研究[12]。2000 年以來,國內學者對于線粒體DNA 多態性的研究主要是采用PCR-RFLP 方法[8],對中國各省份馬鈴薯主產區的晚疫病菌的mtDNA基因型多樣性進行了持續的研究與探討。趙志堅等[12]監測2001 年云南省晚疫病菌mtDNA 單倍型發現群體主要以Ia 型為主;郭軍等[13]鑒定了內蒙古地區晚疫病菌群體mtDNA 的單倍型,結果均為IIa 型;韓麗麗等[14]分析了 2010~2012 年 3 年間福建省晚疫病群體的mtDNA 單倍型類型和頻率分布,檢測結果為存在Ia、IIa 和IIb 三種單倍型,其中Ia 為優勢基因型。
在黑龍江省馬鈴薯晚疫病菌mtDNA 研究方面,前人對黑龍江省致病疫霉mtDNA 單倍型進行了持續的報道,發現Ia、IIa、Ib 和IIb 四種線粒體單倍型[12,15-17]在黑龍江省均有存在,雖然不同時期檢測的結果有所差別,但均得出IIa 為優勢基因型的結論。本研究分別對黑龍江省多地的馬鈴薯晚疫病菌菌株和哈爾濱地區連續多年的晚疫病菌群體進行了線粒體DNA 單倍型測定分析,其中,哈爾濱、齊齊哈爾、綏化、伊春和大興安嶺地區均
采集到了較為充足的樣品用于mtDNA 的檢測,但黑河和鶴崗兩地受到當地天氣、種植地塊以及田間防治水平的影響,只采集到較少的樣品用于本次檢測,其在代表性上相對不足,因此,也將在后續年份進行持續的關注和報道。本研究結果表明哈爾濱地區有Ia、Ib、IIa 三種單倍型,齊齊哈爾有Ia、IIa 兩種單倍型,其他地區mtDNA 多態性單一,均為IIa 單倍型,所有地區均未檢測到IIb單倍型的存在。這一結果和前人對黑龍江省晚疫病菌群體的測定結果基本一致。已有研究報道認為Ib 單倍型是致病疫霉菌全球遷移之前的“舊”群體,而其他三種類型則為后期衍生出來的“新”群體。多年來黑龍江省晚疫病菌mtDNA 單倍型分析結果表明,黑龍江省已基本完成馬鈴薯晚疫病菌群體的新舊群體演變過程,但受到氣候和環境變化的影響,在馬鈴薯生產過程中Ib 單倍型仍然可能發生,因此,對晚疫病菌群體變化開展科學、精準、有效的監測,對更好地進行馬鈴薯晚疫病防控具有重要意義。

