靶向鐵死亡信號通路抗腫瘤天然產物的研究進展
馮嘉潤,詹 盛,許煥麗
(首都醫科大學 基礎醫學院,北京 100069)
鐵死亡是一種鐵依賴性的細胞中脂質活性氧異常累積造成的細胞程序性死亡。鐵死亡有別于凋亡、自噬及壞死等經典的細胞死亡方式,其無法被凋亡抑制劑所抑制,卻能被鐵螯合劑或攝入的鐵抑制劑所阻斷。鐵死亡參與了多種腫瘤的發生及耐藥性產生。大量研究證明,通過誘導腫瘤細胞鐵死亡可有效抑制腫瘤生長,為新的抗腫瘤藥物的開發及克服腫瘤耐藥帶來希望[1]。
許多化療藥物均可通過多種途徑介導細胞凋亡來殺死腫瘤細胞,然而,由于腫瘤細胞對凋亡獲得性的、內在的抵抗,僅通過誘導凋亡抗腫瘤的效果有限。因此,通過誘導其他形式的非凋亡性的細胞死亡方式來殺傷腫瘤細胞、抵抗腫瘤耐藥有望成為腫瘤治療的新的有效手段。天然產物是發現抗腫瘤藥物先導化合物的重要資源。近年研究表明,許多天然藥物可通過調控腫瘤細胞鐵死亡發揮抗腫瘤作用。因此,本文重點對鐵死亡通路上的相關靶點及天然產物對其干預的機制進行綜述,為其進一步研究、開發和臨床應用提供理論參考。
1 鐵死亡信號通路與腫瘤的治療
鐵死亡是由于細胞抗氧化能力降低,二價鐵離子以類似芬頓反應的方式氧化脂質產生大量活性氧簇,達到一定程度所引起的細胞氧化性死亡。細胞抗氧化能力降低主要是由于谷胱甘肽過氧化物酶4(glutathione peroxidase 4,GPX4)失活導致的。在還原型谷胱甘肽(GSH)存在的情況下,GPX4將過氧化氫和有毒的脂質過氧化物分解成水或相應的無毒脂質醇。位于細胞膜上的胱氨酸-谷氨酸反向轉運體(System Xc-)可以1:1的比例轉出谷氨酸,同時轉入胱氨酸,在氨基酸的轉運中起十分重要的作用。胱氨酸在攝入后迅速被還原為半胱氨酸,然后參與GSH的合成,維持細胞的氧化還原穩態[2]。因此,GPX4活性是調控鐵死亡的樞紐與核心。
二價鐵離子的存在也是鐵死亡的必要條件。膜蛋白轉鐵蛋白受體1(transferrin receptor 1,TFR1)可轉運Fe3+進入細胞,在二價金屬轉運蛋白1(divalent metal transporter 1,DMT1)作用下轉為Fe2+。鐵反應元件結合蛋白2(iron responsive element binding protein 2,IREB2)、核因子紅細胞2相關因子2(nuclear factor-E2 related factor 2,Nrf2)可調控細胞內Fe2+[2]。鐵死亡受到細胞中多種代謝的嚴密調控,如氨基酸代謝、脂質代謝、鐵代謝等。針對以上途徑進行調控可誘導或抑制鐵死亡的發生。
近年越來越多的研究表明,誘導腫瘤細胞鐵死亡與抑制腫瘤的生長、轉移及耐藥密切相關[3-4],誘導鐵死亡從而有效地靶向癌細胞已成為當今藥物開發的熱點。
2 靶向System Xc- 的天然產物
System Xc-由兩個亞基組成,包括輕鏈亞基SLC7A11和重鏈亞基SLC3A2[5]。SLC7A11負責System Xc-的主要活性,而SLC3A2主要發揮輔助協調作用,目前關于鐵死亡的研究主要集中于對SLC7A11的調控方面。研究表明[6-7],許多惡性腫瘤如肝細胞癌、非小細胞肺癌細胞膜上的SLC7A11的表達量明顯上調,以維持高水平的GSH含量,應對氧化還原應激狀態。GSH是GPX4激活的必要輔因子,因此通過抑制System Xc-間接抑制GPX4的活性已被證明是有效的誘導腫瘤細胞鐵死亡的方法[8-9]。
丹參酮IIA是從中藥丹參中提取的具有抗腫瘤活性的脂溶性菲醌化合物[10]。Guan等[11]研究發現,丹參酮IIA可誘導BGC-823和NCI-H87胃癌細胞中p53蛋白的表達上調,而p53蛋白可結合SLC7A11的啟動子區,抑制其轉錄,進而誘發鐵死亡,抑制胃癌細胞的增殖。
3 靶向GPX4的天然產物
GPX4可去除細胞中的脂質活性氧(reactive oxygen species,ROS),是鐵死亡中的關鍵調節因子。典型的鐵死亡誘導劑ras選擇性致死化合物(ras selective lethal compound 3,RSL3)就是通過共價結合GPX4中硒代半胱氨酸的活性位點,抑制GPX4的活性,造成細胞內脂質過氧化物積累和鐵死亡[12]。靶向GPX4誘導鐵死亡已成為抗腫瘤藥物開發的重要策略。
沒食子酸(gallic acid,GA)是從植物中分離得到的天然酚類化合物,可有效治療胃癌、宮頸癌、乳腺癌和黑色素瘤等癌癥[13]。Khorsandi等[14]研究發現,低水平激光聯合GA可通過細胞凋亡和鐵死亡機制誘導乳腺癌MDA-MB-231細胞死亡。單獨GA處理的乳腺癌MDA-MB-231細胞增殖活性無顯著降低,而GA聯合低水平激光處理的MDAMB-231細胞內ROS水平升高,GPX4及細胞增殖活性降低。
異硫氧酸鹽是來源于十字花科植物中的一類具有抗腫瘤活性的有機化合物,其中苯乙基異硫氧酸鹽(phenethyl isothiocyanate,PEITC)是一種ROS誘導劑[15-16],有望發展為抗腫瘤治療藥物。大多數研究報道PEITC能誘導多種腫瘤凋亡[17-18],而Lv等指出PEITC在人骨肉瘤細胞中可誘導多種方式的細胞死亡,包括鐵死亡[19]。PEITC降低了GSH/氧化型谷胱甘肽(oxidized glutathione,GSSG)比值,同時抑制GPX4的表達,導致ROS的積累,細胞發生鐵死亡。該研究還檢測到TFR1的高表達,鐵蛋白重鏈(ferritin heavy chain 1,FTH1)和膜鐵轉運蛋白(ferroportin,FPN)的表達下降,導致細胞內鐵含量升高,誘導鐵死亡的發生[19]。
澳洲茄堿是一種提取自龍葵的生物堿,具有多重藥理作用,如促進神經發生、促進氧化活性、抑制真菌感染等[20],亦有抑制腫瘤細胞生長的作用[21-22]。Jin等[23]研究發現,澳洲茄堿可誘導谷胱甘肽氧化還原系統破壞,促進肝癌細胞HepG2細胞的鐵死亡作用。澳洲茄堿通過抑制谷胱甘肽合成酶(glutathione synthetase,GSS),間接抑制了GPX4的活性,提高了HepG2細胞脂質ROS水平,參與了肝細胞癌HepG2細胞的鐵死亡過程。
另外,丹參活性成分隱丹參酮能劑量依賴性抑制肺癌A549細胞的增殖,其機制與增加熱休克蛋白B1(heat shock protein B 1,HSPB1)和GPX4的mRNA表達水平,進而誘導鐵死亡有關[24]。
4 靶向GSH的合成或消耗的天然產物
GSH在維持和調控細胞內氧化還原環境中發揮著重要作用。除了System Xc-和GPX4可影響GSH合成外,谷胱甘肽的合成與消耗還受其他因素,如谷氨酰胺分解抑制、半胱氨酸利用率降低和胞外高濃度的谷氨酸等的影響[2]。一些天然產物可作用于GSH的合成或消耗從而誘導鐵死亡。
青蒿素是從中藥青蒿(Artemisia annuaL.)中提取的一種天然化合物,青蒿素及其衍生物包括青蒿琥酯、雙氫青蒿素、蒿甲醚和蒿醚,已被用于多藥耐藥瘧疾的治療[25]。近年,青蒿素及其衍生物作為鐵死亡誘導劑的相關研究日益增加,它們主要通過消耗GSH、增加ROS水平,并影響鐵的代謝等多個方面來調控鐵死亡的發生。
青蒿琥酯是一種水溶性的青蒿素衍生物,除抗瘧作用外,還具有抗癌活性[26]。Eling等[27]檢測到青蒿琥酯作用下胰腺導管腺癌(PDAC)細胞ROS水平上升,并證實青蒿琥酯可誘導PDAC細胞發生鐵死亡。Greenshields等[28]發現,青蒿琥酯對卵巢癌細胞的細胞毒性效果是依賴于ROS的,且外源性鐵的使用可提高青蒿琥酯治療卵巢癌的有效性,青蒿琥酯可誘導卵巢癌細胞鐵死亡。
雙氫青蒿素是一種青蒿素活性產物,除了具有傳統的抗瘧疾作用外,還對多種癌癥顯示出良好的抗腫瘤效果[29-30]。李艷純等[31]檢測到雙氫青蒿素處理后肝癌細胞內ROS水平上升,同時伴隨細胞內GSH水平下降及GPX4蛋白表達的下調。因此雙氫青蒿素對肝癌細胞的增殖抑制作用機制可能不僅局限于之前發現的細胞凋亡,鐵死亡可能在其中也發揮了作用。亦有研究發現,雙氫青蒿素可降低DNA引物酶M2(DNA primase M2,PRIM2)的表達。PRIM2是DNA引物酶的亞基,參與調控DNA復制。PRIM2的缺失可導致SLC7A11表達的下調,誘發鐵死亡,抑制肺癌細胞的增殖[32]。Lin等發現雙氫青蒿素可誘導頭頸部癌(HNC)細胞鐵死亡和凋亡[33]。因此,通過雙氫青蒿素誘導鐵死亡可能成為多種癌癥治療的一種新方法。
5 靶向脂質ROS堆積的天然產物
脂質過氧化代謝紊亂導致的ROS堆積為鐵死亡的另一個重要影響因素。細胞膜中脂質中的多不飽和脂肪酸(polyunsaturated fatty acid,PUFA)經一系列反應產生的過氧化物是ROS的來源,積累的ROS可進一步參與生物膜的氧化過程。這些自由基可從鄰近的PUFA中轉移質子,引發新一輪的脂質氧化,使氧化損傷擴散,進而加速ROS的產生。過多的ROS積累會導致鐵死亡的發生[3]。脂質的過氧化過程通過增加脂質毒性在誘導鐵死亡中發揮重要作用,所以通過調節脂質代謝增加ROS的水平也為誘導細胞鐵死亡提供了思路。
蓽茇是胡椒科胡椒屬植物蓽茇的干燥未成熟或成熟果穗,有效成分包括酰胺類、萜類、甾醇類、揮發油類等,其中蓽茇酰胺為主要特征性成分。最新的研究表明蓽茇酰胺有抗腫瘤、降脂、抗菌和抗氧化等方面的功效[34]。蓽茇酰胺直接結合并抑制細胞中的抗氧化酶谷胱甘肽S-轉移酶P1(glutathione S-transferase P1,GSTP1),導致腫瘤細胞內ROS水平升高,但對正常細胞沒有毒性[35]。Yamaguchi等[36]研究發現,蓽茇酰胺可誘發胰腺癌細胞內GSH水平下降,ROS水平升高,進而發生鐵死亡。同時研究提示子葉列寧a(cotylenin A,CNA)、柳氮磺胺吡啶(sulfasalazine,SSZ)與蓽茇酰胺聯合使用可增加細胞中ROS的產生,3種藥物聯合治療胰腺癌療效顯著。亦有研究發現,蓽茇酰胺對胃癌細胞增殖有抑制作用,其機制與蓽茇酰胺可誘導胃癌細胞中ROS的形成有關。蓽茇酰胺下調鐵死亡關鍵蛋白GPX4、System Xc-的表達,進而誘導鐵死亡的發生[37]。因此,蓽茇酰胺是一種很有潛力應用于癌癥治療的藥物。
6 靶向Nrf2的天然產物
Nrf2是調控細胞氧化應激的核心轉錄因子,具有強大的抗氧化/抗凋亡作用,是腫瘤細胞耐藥的重要機制。在氧化應激時,Nrf2會與Kelch樣ECH關聯蛋白1(Kelchlike ECH associated protein 1,KEAP1)解離,轉位進入細胞核,與受其調控的抗氧化酶基因的抗氧化反應元件結合,Nrf2的靶基因表達產物包括血紅素加氧酶1(hemeoxygenase-1,HMOX1),SLC7A11和GPX4 等。
葫蘆巴堿是一種大量存在于咖啡和葫蘆巴種子的生物堿,具有多重藥理作用[38]。研究表明,葫蘆巴堿在體外和體內都可逆轉RSL3誘導的頭頸癌細胞(HNC)對鐵死亡的抗性[39]。其機制與抑制Nrf2的轉錄活性有關。葫蘆巴堿可通過抑制Nrf2下調HMOX1和FTH1基因水平,從而改變鐵代謝和脂質過氧化作用,獲得鐵死亡抗性。另一方面,葫蘆巴堿還阻斷了金屬硫蛋白 1G(metallothionein-1G,MT-1G)的表達,使GSH含量降低,進而誘導鐵死亡。此外,葫蘆巴堿還可通過克服鐵死亡抗性,增強胰腺癌對依托泊苷的敏感性[40]及肝癌對索拉菲尼的敏感性[41]。
然而,在另一項研究中Nrf2及HMOX1的上調被證明抑制了鐵死亡的發生。醉茄素A是從南非醉茄中分離的甾體內脂,具有抗炎、抗腫瘤等功效。其在中劑量下可靶向作用于KEAP1,激活Nrf2,上調HMOX1的表達,進而誘導神經母細胞瘤的鐵死亡。這一現象可由HMOX1水平對細胞毒性的兩面性解釋:中等水平的HMOX1對細胞具有保護作用;而HMOX1的過表達可導致細胞中不穩定Fe2+增加,誘導鐵死亡。因此,使HMOX1過量表達或抑制HMOX1的表達均可誘導鐵死亡的發生。此外,醉茄素A在高劑量下,可直接使GPX4失活,從而使細胞對鐵死亡敏感[42-43]。
7 靶向鐵離子積累
鐵死亡中鐵的存在是必要的。細胞內鐵離子濃度的上升可促進鐵死亡的發生[44],而使用鐵螯合劑如去鐵胺則可抑制細胞的鐵死亡[45]。然而,鐵在鐵死亡中發揮的具體作用仍存在爭議。一種可能的解釋為鐵可向氧化物提供電子,促進ROS的形成,而鐵螯合劑阻斷鐵死亡的機制是它們阻止了鐵提供電子[46]。
魯斯可皂苷元是一種從生長在地中海地區的假葉樹(Ruscus aculeatusL.)中分離得到的一種甾體皂苷元,也是常用中藥麥冬中的主要皂苷元[47]。魯斯可皂苷元具有多種藥理活性,用于治療多種炎癥、心血管疾病及癌癥[47-48]。Song等研究了魯斯可皂苷元在胰腺癌中的作用,發現魯斯可皂苷元能顯著抑制胰腺癌細胞的存活。魯斯可皂苷元通過上調轉鐵蛋白(transferrin,TF)表達和下調FPN表達增加了細胞內鐵離子的濃度,同時增加了ROS的產生,促進了胰腺癌細胞的鐵死亡[49]。
β-欖香烯是從姜黃中分離出的一種生物活性化合物,具有抗癌作用,可用于多種癌癥治療[50]。Chen等[51]首次證實了KRAS突變型結直腸癌細胞對β-欖香烯和西妥昔單抗聯合治療敏感,二者聯合誘導KRAS突變結直腸癌細胞HCT116鐵死亡。β-欖香烯聯合西妥昔單抗處理后,HMOX1和TF的表達明顯升高,而使用去鐵胺幾乎可完全逆轉細胞的死亡。HMOX1是細胞內鐵離子的重要來源,該研究證明β-欖香烯通過調節胞內鐵的濃度促進了鐵死亡的發生。同時,鐵死亡負調控蛋白,包括SLC7A11、GPX4、FTH1、谷氨酰胺酶和SLC40A1的表達顯著降低。該研究表明,β-欖香烯和西妥昔單抗可聯合誘導鐵死亡,有望為KRAS突變的結直腸癌患者提供一種治療策略。
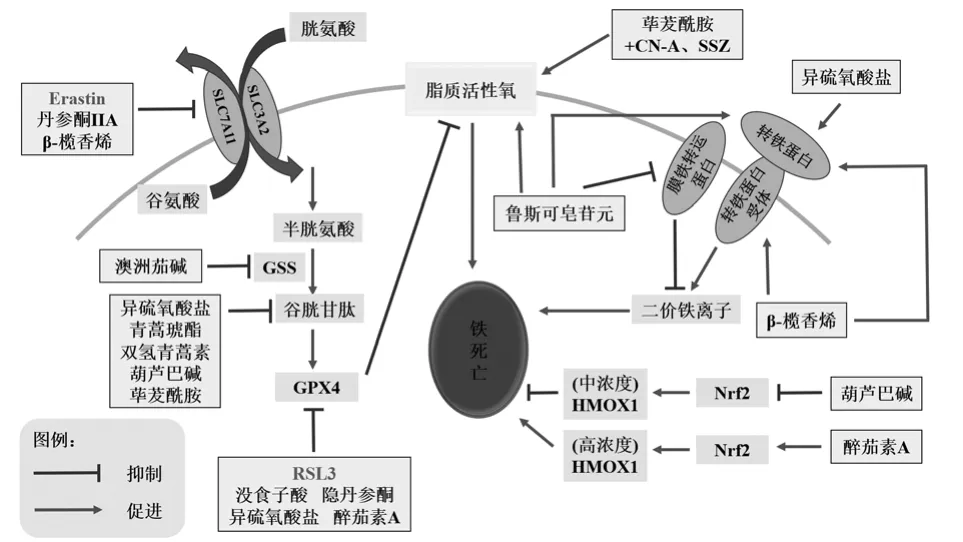
圖1 天然藥物調控腫瘤細胞鐵死亡機制
8 總結與展望
鐵死亡是一種區別于凋亡的新型細胞死亡方式。已有多個證據表明鐵死亡在腫瘤細胞的生長調控和耐藥等方面發揮著重要作用,可作為新的抗腫瘤靶標。鐵死亡調控主要通過3種代謝途徑實現:氨基酸代謝,包括胱氨酸轉入,GSH合成,最終影響GPX4的活性;脂質代謝,包括從PUFA到脂質ROS的氧化途徑;鐵代謝,如FPN,TFR1,HMOX1等調節細胞內二價鐵離子濃度。本文所涉及的天然藥物主要從上述方面調控了鐵死亡。在應用方面,誘導鐵死亡能提高化療藥物的療效,如文中所述葫蘆巴堿聯合依托泊苷治療胰腺癌等。另外,利用鐵死亡對抗一些癌癥細胞產生的化療耐藥性也是研究關注的一個焦點[4]。
越來越多的研究表明,具有抗腫瘤作用的天然產物除了參與細胞凋亡、壞死、自噬等細胞死亡方式外,還可誘導鐵死亡。這些藥物通過不同的細胞死亡機制發揮抗腫瘤作用,但是它們所誘導的凋亡、壞死、自噬和鐵死亡之間的具體聯系還有待探究。研究藥物調控不同細胞死亡方式之間的關系可能對聯合用藥及更好地發揮藥物作用有所幫助。目前,鐵死亡中很多具體機制是不明確的,進一步研究鐵死亡的具體機制會更有助于誘導鐵死亡新藥的研發。
天然來源的化合物是抗腫瘤藥物的重要來源。我國中藥資源豐富,其中含多種調節鐵死亡的活性成分,且與經典鐵死亡誘導劑或抑制劑相比,具有價廉、來源廣、療效可靠等優勢,進一步發掘可誘導鐵死亡的天然藥物具有重要意義。

