血清LncRNA PVT1、LncRNA H19表達與前列腺癌患者術后復發轉移的關系
陳金玉,張平,孫穎昕,潘敏杰,周珊
(1.南京醫科大學附屬常州市第二人民醫院1.檢驗科,2.泌尿外科,江蘇常州 213000)
前列腺癌是一種嚴重危害男性生命的惡性腫瘤,隨著我國人口老齡化的加劇,前列腺癌患病率逐年上升,已成為我國男性第6 大常見惡性腫瘤[1]。術后復發轉移是導致前列腺癌患者生命質量降低和生存期縮短的主要原因,前列腺特異抗原(prostate specific antigen, PSA)是前列腺癌一種腫瘤標志物,但其檢測結果易受藥物、炎癥及良性前列腺病變影響,不能預測前列腺癌復發轉移,缺乏相關生物標志物[2]。長鏈非編碼RNA(long noncoding RNA, LncRNA)是一類不編碼蛋白質的RNA,可作為癌基因或抑癌基因參與多種腫瘤發生、發展[3]。 漿細胞瘤可變易位基因1(plasmacytoma variant translocation 1, PVT1)和H19 是LncRNA 家族成員。有研究報道,兩者在胃癌、卵巢癌、肺癌等惡性腫瘤中異常表達,與腫瘤細胞的增長、侵襲、遷移和凋亡等密切相關[4-7]。已有研究報道LncRNA PVT1、LncRNA H19 在前列腺癌組織中表達上調[8-9]。但關于兩者與前列腺癌術后復發轉移的關系尚無研究報道。本研究就檢測前列腺癌患者血清LncRNA PVT1、LncRNA H19 表達,分析兩者與前列腺癌患者術后復發轉移的關系。
1 資料與方法
1.1 一般資料
選取2016年5月—2018年5月南京醫科大學附屬常州市第二人民醫院收治的前列腺癌患者169 例作為前列腺癌組。患者年齡42~82 歲,平均(64.57±7.87)歲;病理類型:腺癌141 例,其他類型28 例;根據李志國等[10]研究的分類標準,以腫瘤直徑3 cm作為分界點:>3 cm 84例,≤3 cm 85 例;分化程度:低分化36 例,中高分化133 例;TNM分期:Ⅰ、Ⅱ期104 例,Ⅲ期65 例;國際泌尿病理學會修訂的Gleason 評分[11]:≥7 分47 例,<7 分122 例; PSA 為11.89~88.32 ng/ml, 平均49.23(35.64,66.72)ng/ml。納入標準:①經病理檢查確診為前列腺癌;②初次確診,未接受任何治療;③TNM 分期Ⅰ~Ⅲ期;④接受根治性或姑息性手術切除;⑤臨床病理資料完整;⑥患者及家屬均知情研究,可接受隨訪。排除標準:①合并其他部位腫瘤者;②嚴重心、肝、腎等臟器疾病者;③全身感染性疾病者;④血液系統疾病者。另選取同期本院健康體檢者74 例作為對照組。研究者年齡27~85 歲,平均(63.87±8.02)歲。兩組一般資料比較,差異無統計學意義(P>0.05),具有可比性。
1.2 方法
采集前列腺癌組入院次日清晨和對照組體檢時空腹靜脈血3 ml,以3 000 r/min 離心10 min,取上清液,置入-80℃冰箱冷凍保存。Trizol 試劑提取總RNA,NanoDrop 2000C 超微量分光光度計驗證RNA 濃度和純度(OD260/OD280 為1.8~2.0),TaKaRa 逆轉錄試劑盒合成cDNA,進行qRT-PCR 擴增。LncRNA PVT1 正向引物:5'-TTGGCACATACAG CCATCAT-3',反向引物5'-GCAGTAAAAGGGGAAC ACCA-3',長度分別為18 bp 和20 bp;LncRNA H19正向引物5'-TACAACCACTGCACTACCTG-3',反向引物5'-TGGAATGCTTGAAGGCTGCT-3',長度分別為16 bp、19 bp;內參GAPDH 正向引物5'-GAAGG TGAAGGTCGGAGTC-3',反向引物5'-GAAGATGGT GATGGGATTTC-3',長度分別為20、24 bp。反應體系:5.0 μl SYBR Premix Ex Taq,0.2 μl 引物,0.2 μl ROX Reference Dye, 1.0 μl cDNA 模板, 3.4 μl RNase-free ddH2。反應條件:95℃預變性10 min,95℃變性15 s、60℃退火60 s、72℃拉伸60 s,循環45 次,2-ΔΔCt法計算血清LncRNA PVT1、LncRNA H19 相對表達量。
1.3 隨訪
前列腺癌患者入院后接受根治性或姑息性手術切除,術后定期行MRI 或組織病理學檢查,以電話或門診方式隨訪3年,以出現復發轉移或末次隨訪為截止期,截止2021年5月。根據是否復發轉移分為復發轉移組和未復發轉移組,分別有66 例和103 例。
1.4 統計學方法
數據分析采用SPSS 26.0 統計軟件。正態分布計量資料以均數±標準差(±s)表示,比較用t檢驗;偏態分布計量資料以中位數和四分位數[M(P25,P75)]表示,比較用Z檢驗;計數資料以率(%)表示,比較用χ2檢驗;多因素Cox 回歸分析前列腺癌患者術后復發轉移影響因素;受試者工作特征(receiver operating characteristic curve, ROC)曲線分析血清LncRNA PVT1、LncRNA H19 表達對前列腺癌患者術后復發轉移的預測價值,并繪制曲線下面積(area under the curve, AUC)。P<0.05 為差異有統計學意義。
2 結果
2.1 兩組血清LncRNA PVT1、LncRNA H19 相對表達量比較
兩組血清LncRNA PVT1、LncRNA H19 相對表達量比較,差異有統計學意義(P<0.05),前列腺癌組高于對照組。見表1。
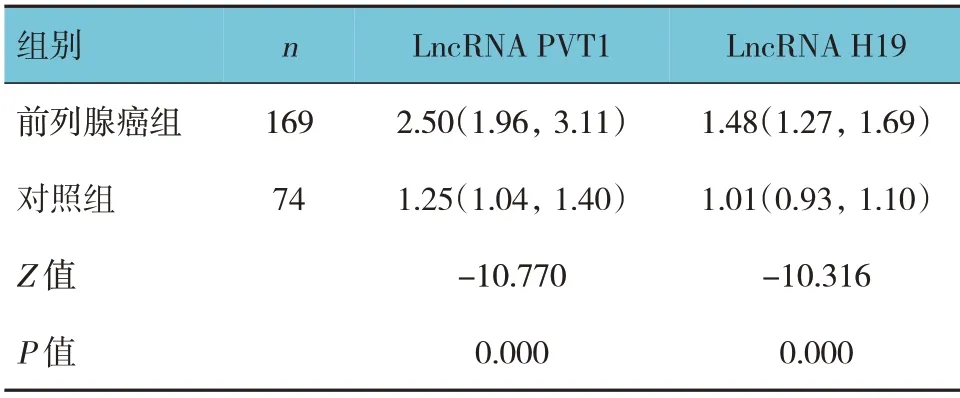
表1 兩組血清LncRNA PVT1、LncRNA H19相對表達量比較 M(P25,P75)
2.2 復發轉移組與未復發轉移組臨床資料比較
前列腺癌患者術后隨訪3~36 個月,中位時間22 個月。169 例結腸癌患者截止末次隨訪術后復發轉移66 例,局部復發23 例、遠處轉移43 例。遠處轉移患者中骨骼轉移27 例、肝轉移5 例、肺轉移5 例、腦轉移2 例、其他部位單發或多發轉移4 例。單因素分析顯示,復發轉移組與未復發轉移組TNM 分期、Gleason 評分、PSA、LncRNA PVT1、LncRNA H19 表達比較,差異有統計學意義(P<0.05),兩組年齡、病理類型、腫瘤直徑、分化程度比較,差異無統計學意義(P>0.05)。見表2。
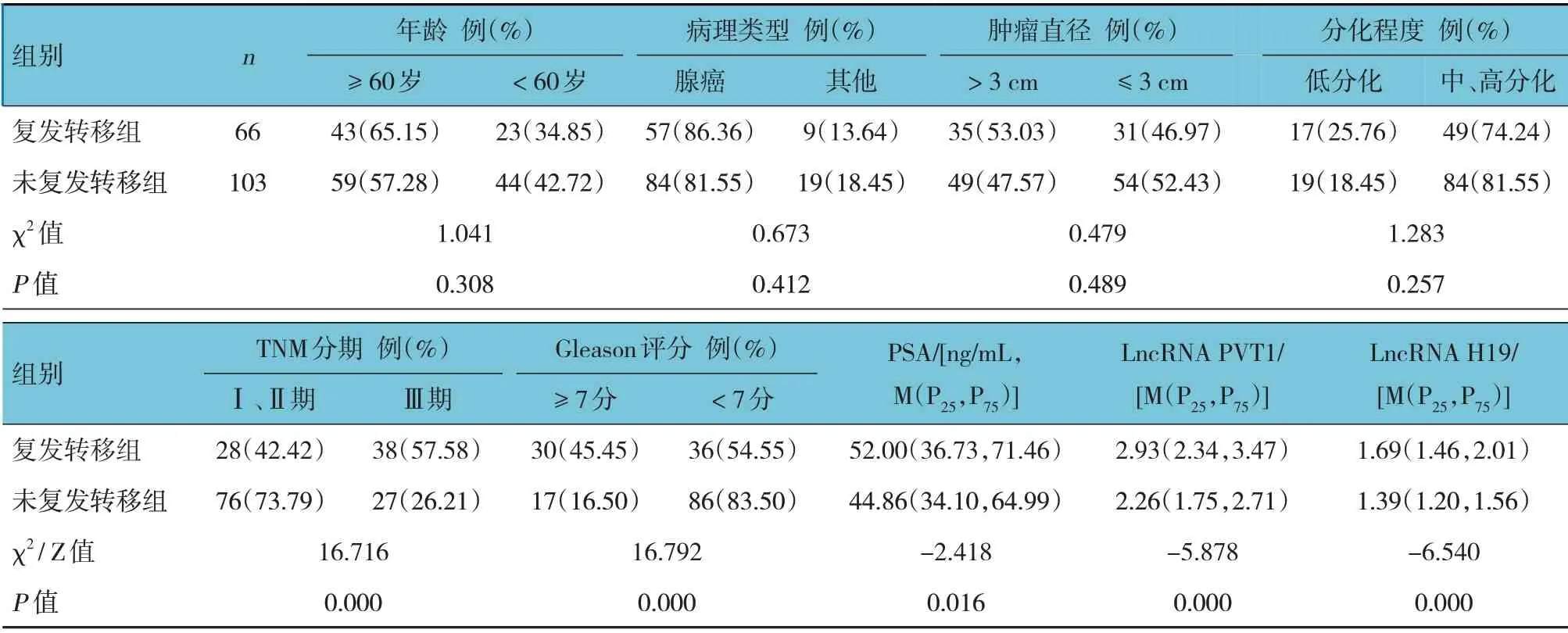
表2 復發轉移組與未復發轉移組臨床資料比較
2.3 前列腺癌患者術后復發轉移的多因素Cox 回歸分析
以隨訪時間作為時間變量,TNM 分期(Ⅲ期=1,Ⅰ、Ⅱ期=0)、Gleason 評分(≥7 分=1,<7 分=0)、PSA、LncRNA PVT1、LncRNA H19 作為自變量,術后是否復發轉移作為因變量(是=1,否=0),進行多因素Cox 回歸分析,結果顯示,TNM 分期Ⅲ期[=3.722(95% CI:1.416,7.784)]、Gleason 評分≥7 分[=4.626(95% CI:1.670,9.815)]、LncRNA PVT1 [=1.982(95 CI:1.521,2.584)]、LncRNA H19[=1.868(95% CI:1.327,2.630)]是前列腺癌患者術后復發轉移的獨立危險因素(P<0.05)。見表3。
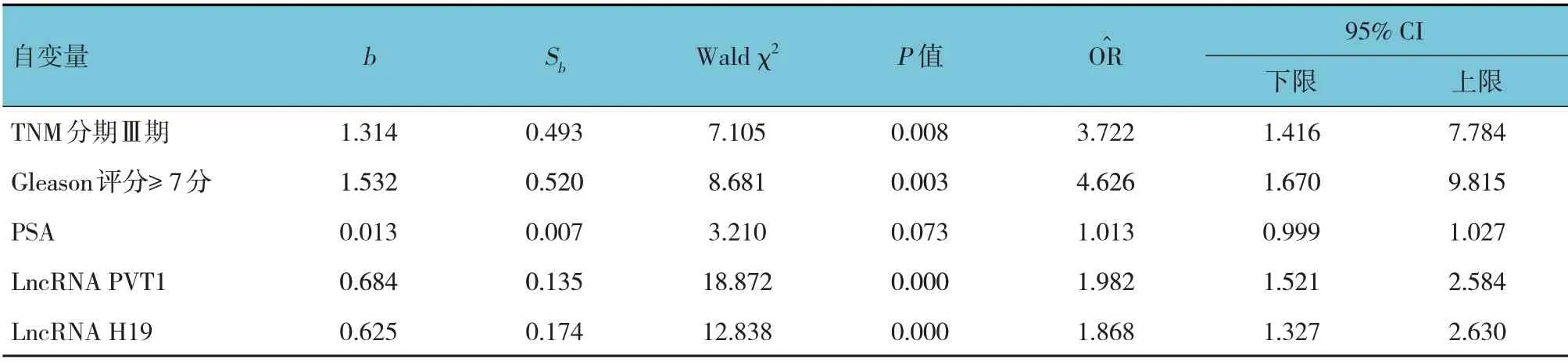
表3 前列腺癌患者術后復發轉移的多因素Cox回歸分析參數
2.4 血清LncRNA PVT1、LncRNA H19 表達單獨和聯合預測前列腺癌患者術后復發轉移的價值
ROC 曲線顯示,血清LncRNA PVT1、LncRNA H19 表達分別單獨和聯合預測前列腺癌患者術后復發轉移的AUC 為0.768 (95% CI: 0.697,0.830)、0.799 (95% CI: 0.730, 0.856)、0.892(95% CI:0.835,0.934),聯合預測AUC 大于單獨預測。LncRNA PVT1 單獨檢測的敏感性最高,LncRNA H19 單獨檢測的特異性最高,聯合檢測的Youden 指數最高。見表4和圖1。
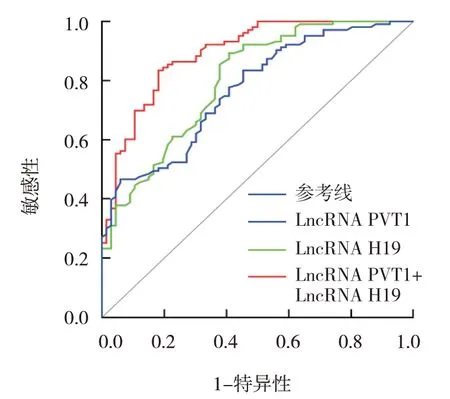
圖1 ROC曲線
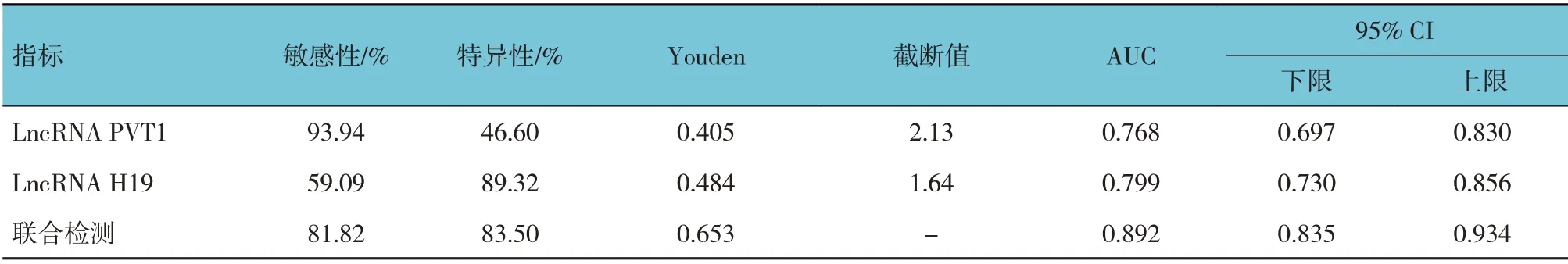
表4 血清LncRNA PVT1、LncRNA H19表達單獨和聯合預測前列腺癌患者術后復發轉移的價值
3 討論
前列腺癌是男性泌尿生殖系統常見的惡性腫瘤,2020年全球前列腺癌發病106.6 萬例,死亡37.5萬例,在48 個國家男性腫瘤致死病因中排第1 位[1]。前列腺癌起病隱匿,早期缺乏典型癥狀,隨著病情進展,可出現尿頻、尿不盡、尿不出、尿液或精液帶血等癥狀,往往確診時已達中晚期,手術切除是前列腺癌主要治療方式,但大多患者分期較晚,即使經過手術切除,仍有部分患者會出現復發或轉移,危害其生命安全。目前臨床主要通過臨床隨訪和影像學依據評估前列腺癌術后復發轉移,Gleason 評分雖然能較好評估前列腺癌預后,但需要通過穿刺或病理檢查進行評價,因此研究列腺癌術后復發轉移相關標志物對早期預測復發轉移和指導后續治療具有重要意義。LncRNA 是一類轉錄本>200 個核苷酸的非編碼RNA,占所有非編碼80%,其調控細胞生長、增殖、分化、凋亡等生物學過程,參與腫瘤發生、發展、轉移[3]。如LncRNA 同源盒A11 反義RNA 能調節整合素,促進前列腺癌細胞骨轉移[12]。
LncRNA PVT1 定位于人染色體8q24.1,進化上高度保守,因人染色體8q24 區是DNA 拷貝數擴增的最高靶點,異常擴增往往與腫瘤發生有關,因此近年來大量研究報道了LncRNA PVT1 與腫瘤的關系。LIU 等[13]研究顯示,LncRNA PVT1 在宮頸癌組織中高表達,能通過海綿miR-503 靶向ADP 核糖基化因子樣蛋白2 促進宮頸癌細胞增殖、遷移和侵襲。HU 等[14]研究顯示,LncRNA PVT1 在食管癌組織中高表達,能通過海綿miR-128 靶向下調鋅指E盒結合同源框1 促進食管癌細胞增殖、遷移和侵襲。本研究結果顯示,前列腺癌組血清LncRNA PVT1 表達顯著升高,提示LncRNA PVT1 作為癌基因可能參與前列腺癌的發生,與既往研究報道一致[8]。本研究結果還顯示,術后復發轉移的前列腺癌患者血清LncRNA PVT1 表達更高,提示LncRNA PVT1 高表達可能與前列腺癌術后復發轉移有關。通過Cox 回歸也證實了這一點,血清LncRNA PVT1表達每升高1 個單位,術后復發轉移幾率將增加1.982 倍,其機制可能與LncRNA PVT1 能通過海綿miR-186-5p 靶向上調TWIST 家族bHLH 轉錄因子1促進前列腺癌上皮細胞-間充質轉化有關。上皮細胞-間充質轉化是癌細胞增殖、侵襲、轉移的重要過程,TWIST 家族bHLH 轉錄因子1 能通過調控核因子-κB、信號轉導和轉錄激活因子等多種信號通路誘導上皮細胞-間充質轉化[15]。CHANG 等[16]研究發現,LncRNA PVT1 能通過海綿miR-186-5p 靶向上調TWIST 家族bHLH 轉錄因子1 表達,調節上皮細胞-間充質轉化,促進前列腺癌細胞增殖、侵襲和轉移。
LncRNA H19 定位于人染色體11p15.5,作為一種印跡基因,其印跡異常參與了多種腫瘤發生、發展。如SUN 等[17]研究顯示,LncRNA H19 在胃癌組織中高表達,能通過調節miR-519d-3p/乳酸脫氫酶A 軸促進胃癌細胞增殖、有氧糖酵解和免疫逃逸。LAN 等[18]研究顯示,LncRNA H19 在甲狀腺乳頭狀癌組織中低表達,能通過抑制腫瘤壞死因子受體2 抑制甲狀腺乳頭狀癌細胞增殖和遷移。上述研究提示LncRNA H19 在不同腫瘤中發揮癌基因或抑癌基因作用。本研究結果顯示,前列腺癌組血清LncRNA H19 表達顯著升高,提示LncRNA H19作為癌基因參與前列腺癌發生。本研究結果還顯示,術后復發轉移的前列腺癌患者血清LncRNA H19 表達更高,提示LncRNA H19 高表達可能與前列腺癌術后復發轉移有關。通過Cox 回歸分析表明,LncRNA H19 高表達為術后復發轉移獨立危險因素,意味著血清LncRNA H19 表達越高術后復發轉移幾率也就越高,與既往研究報道一致[19]。其機制可能與LncRNA H19 能靶向miR-130-5p 調控人類白細胞抗原G 抑制自然殺傷細胞作用有關。自然殺傷細胞是細胞免疫的主要效應細胞,其殺傷作用降低是腫瘤免疫逃逸后增殖、增殖、侵襲和轉移的重要原因[20]。人類白細胞抗原G 能結合自然殺傷細胞抑制其殺傷作用,有研究報道LncRNA H19 能靶向miR-130-5p 上調人類白細胞抗原G 表達,抑制自然殺傷細胞對前列腺癌細胞的殺傷作用[21]。
綜上所述,前列腺癌患者血清LncRNA PVT1、LncRNA H19 高表達,為術后復發轉移的獨立危險因素,可作為前列腺癌患者術后復發轉移預測指標。但本研究樣本量較少,隨訪時間較短,關于LncRNA PVT1、LncRNA H19 在前列腺癌患者術后復發轉移中的調控機制還需進一步研究。

