基于LC-MS/MS分析不同蛋白酶酶解奶牛胎盤產物差異及其抗氧化活性預測
張 鉞 尤留超 朱潁琨 莘 余 呂尚揆 裴淼毓 傅宏慶 沈留紅*
(1.四川農業大學 動物醫學院/動物疫病與人類健康四川省重點實驗室/奶牛疾病研究中心,成都 611130;2.江蘇農牧科技職業學院,江蘇 泰州 225300)
奶牛胎盤是奶牛養殖中的副產物,未得到有效利用,且處理不當易造成環境污染和生物安全風險。而胎盤含大量肽類、多糖類、激素、脂質和礦物質等生物活性物質[1],多肽類物質可能是其主要活性成分,具有促免疫、抗氧化、促進組織恢復和抗腫瘤等作用[2-4]。因此,從奶牛胎盤中提取活性多肽成分有利于新型肽類藥物開發,進而促進奶牛胎盤合理利用,減少因胎盤丟棄造成環境污染。
目前從動植物成分中制備活性多肽的方法主要有直接分離法、超聲波破碎法和酶解法等。直接分離法要求嚴格、成本高,常用于確定的單個或幾個多肽研究[5],無法對大量多肽樣本進行篩選;超聲破碎法操作簡便、省時省力、提取率高[6],但其主要提取胎盤組織中可溶性蛋白和多肽,無法提取組織中不溶性蛋白,而胎盤不溶性蛋白質亦可產生具有生物活性的多肽;而酶解法是制備成分種類單一、作用方式較為確定的胎盤生物活性多肽有效方法,具有條件溫和、過程可控、成本較低等優點[7],能夠將不溶性蛋白酶解為小和分子量易于吸收的多肽,更利于對其活性成分研究。目前酶解動植物組織制備多肽的酶有胰蛋白酶、胃蛋白酶和木瓜蛋白酶等[8],不同蛋白酶酶解產物生物活性存在差異[9]。常采用1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-trinitrophenylhydrazine,DPPH)法、普魯士藍法和菲啰嗪法等測定多肽抗氧化活性,但上述方法與生物體內活性氧產生和猝滅并無直接關聯,因此生物相關性低,只能評估體外抗氧化活性,不能進一步分析抗氧化活性多肽序列。而液相色譜-串聯質譜(Liquid chromatography-tandem mass spectrometry,LC-MS/M)被廣泛用于功能性蛋白和多肽研究,如檢測紅酒中致敏蛋白[10]、大麥麥芽評估[11]及魚類鑒定[12]等,可從原料中鑒定和分析大量蛋白及多肽序列,利用生物信息學數據庫進一步研究多肽序列[13]。此外,LC-MS/MS技術識別的肽段數量,可決定蛋白質組學敏感性和特異性[14]。目前尚未見奶牛胎盤抗氧化活性多肽序列及其制備抗氧化活性多肽蛋白酶選擇的相關研究。
因此,本研究旨在胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解奶牛胎盤獲得具有最優還原活性和提取率多肽的基礎上[15-16],利用LC-MS/M技術對酶解產物定性和定量分析,探究奶牛胎盤各種酶酶解產物間差異及對蛋白組學影響,并通過BIOPEP數據庫(http:∥www.uwm.edu.pl/biochemia/biopep/start_biopep.php)預測不同酶解產物抗氧化活性,發掘具有潛在抗氧化活性多肽,為奶牛胎盤蛋白組學研究對酶的選擇和奶牛胎盤抗氧化活性多肽的開發利用提供理論依據。
1 材料與方法
1.1 試驗材料
選擇某規模化奶牛場半封閉統一舍飼、2~4胎、體況良好、妊娠足月、自然分娩脫落的健康中國荷斯坦奶牛新鮮胎盤組織,其自然脫落后立即用生理鹽水清洗,除去胎盤內殘留血液及污物,至胎盤子葉呈粉紅色后,于-20 ℃冷凍保存。
1.2 主要試劑和儀器
胰蛋白酶(Trypsin,250 U/mg,批號920T041),胃蛋白酶(Pepsin,250 U/mg,批號810H021),木瓜蛋白酶(Papain,800 U/mg,批號621G025),北京索萊寶科技有限公司生物;0.1%甲酸水溶液、0.1%甲酸乙腈水溶液(乙腈84%)、自配。上樣柱(Thermo Scientific Acclaim PepMap100,100 μm×2 cm,nanoViper C18),分析柱(Thermo scientific EASY column,10 cm,ID 75 μm,3 μm,C18-A2),LYOQUEST 冷凍干燥機(阿自倍爾泰事達);SorvallTMLegendTMXT冷凍離心機(Thermo scientific)。
1.3 試驗方法
1.3.1樣品制備和分組
參照胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解奶牛胎盤制備酶解產物最優條件[15-16]:胰蛋白酶、木瓜蛋白酶和胃蛋白酶的反應時間分別為5.80、4.70和5.49 h,底物體積分數分別為34.96%、34.03%和35.74%,酶底比分別為3.33%、3.66%和3.92%,每種蛋白酶重復3次,分別記為胰蛋白酶組(Trypsin)、胃蛋白酶組(Pepsin)和木瓜蛋白酶組(Papain)。
1.3.2LC-MS/MS分析
采用納升流速的HPLC液相系統Easy nLC進行樣品分離。緩沖液A液為0.1%甲酸水溶液,B液為0.1%甲酸乙腈水溶液(乙腈為84%)。色譜柱以95%的A液平衡,樣品由自動進樣器進入上樣柱,經過分析柱分離,流速為300 nL/min。
樣品經色譜分離后用Q-Exactive質譜儀進行質譜分析。檢測方式為正離子,母離子掃描范圍300~1 800 m/z,一級質譜分辨率70 000 at 200 m/z,AGC target為1e6,Maximum IT為50 ms,動態排除時間為60 s。多肽和多肽碎片質量電荷比按下列方法采集:每次全掃描后采集20個碎片圖譜(MS2 scan),MS2 Activation Type為HCD,Isolation window為2 m/z,二級質譜分辨率17 500 at 200 m/z,Normalized Collision Energy為30 eV,Underfill為0.1%。
1.3.3蛋白質和肽段鑒定及定量分析
將質譜分析原始數據導入Max Quant軟件,基于Uniprot_Bos_taurus數據庫(https:∥www.uniprot.org)進行蛋白質和肽段鑒定及定量分析。部分相關參數設定:裂解酶,Trypsin/Papain/Pepsin;允許的最大漏切位點數,2;可信肽段的篩選標準(Peptide false discovery rate,Peptide FDR),≤0.01;一級離子質量容差,6 ppm;二級離子質量容差,20 ppm;固定修飾,脲甲基化;可變修飾,氧化。
1.4 數據處理
采用SPSS 26.0軟件進行數據分析,單因素方差分析和鄧肯多極差檢驗組間差異,P<0.01為差異極顯著,P<0.05為差異顯著。使用GraphPad Prism 8.0繪圖。
2 結果與分析
2.1 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解產物質譜及蛋白鑒定分析
質譜分析顯示胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解產物鑒定多肽的峰值均出現在質荷比(m/z)400以下,且波形相似,最大峰值在303~305 m/z,表明此質譜分析準確和生物學重復均一。
胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解產物蛋白鑒定結果見圖1,去除重復后,三組蛋白酶分別鑒定出541、136和86個蛋白。胰蛋白酶酶解產物鑒定蛋白數極顯著高于其余2種酶(P<0.01),胃蛋白酶顯著高于木瓜蛋白酶(P<0.05)。
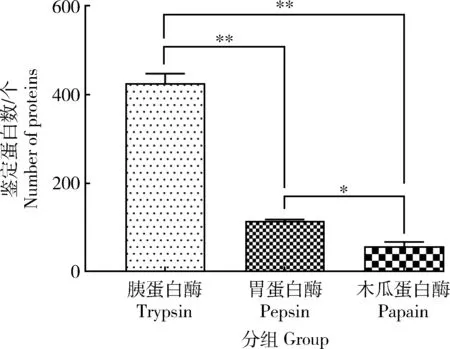
**P<0.01表示差異極顯著,*P<0.05表示差異顯著。下同。**P<0.01 indicates extremely significant differences,*P<0.05 indicates significant difference. The same below.圖1 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解產物鑒定蛋白數量Fig.1 Numbers of identified proteins in trypsin, pepsin and papain hydrolysates
胰蛋白酶酶解產物鑒定蛋白中330種蛋白(61.11%)的分子量在10~60 ku,85種蛋白(15.74%)分子量超過100 ku(圖2(a));大多數蛋白(471個,87.22%)由從1~10個多肽鑒定出,平均值為5.98個多肽(圖2(b));序列覆蓋率大于25%的蛋白有103個(19.07%),247個(45.74%)大于10%(圖2(c))。胃蛋白酶酶解產物分子量在10~60 ku的蛋白共92種(67.65%),27種蛋白(21.26%)分子量超過100 ku(21.26%)(圖2(d));92個蛋白67.65%)由從1~10個多肽鑒定出,平均值為14.46個多肽(圖2(e));序列覆蓋率大于25%的蛋白有45個(32.85%),86個(62.77%)大于10%(圖2(f))。木瓜蛋白酶酶解產物蛋白質的相對分子量、肽段數量、和序列覆蓋分布見圖2:48種蛋白(55.81%)分子量在10~60 ku,15種蛋白(17.44%)分子量超過100 ku(圖2(g));74個蛋白(86.05%)由從1~10個多肽鑒定出,平均值為 8.88 個多肽(圖2(h));序列覆蓋率大于25%的蛋白有17個(19.77%),36個(41.86%)大于10%(圖2(i))。
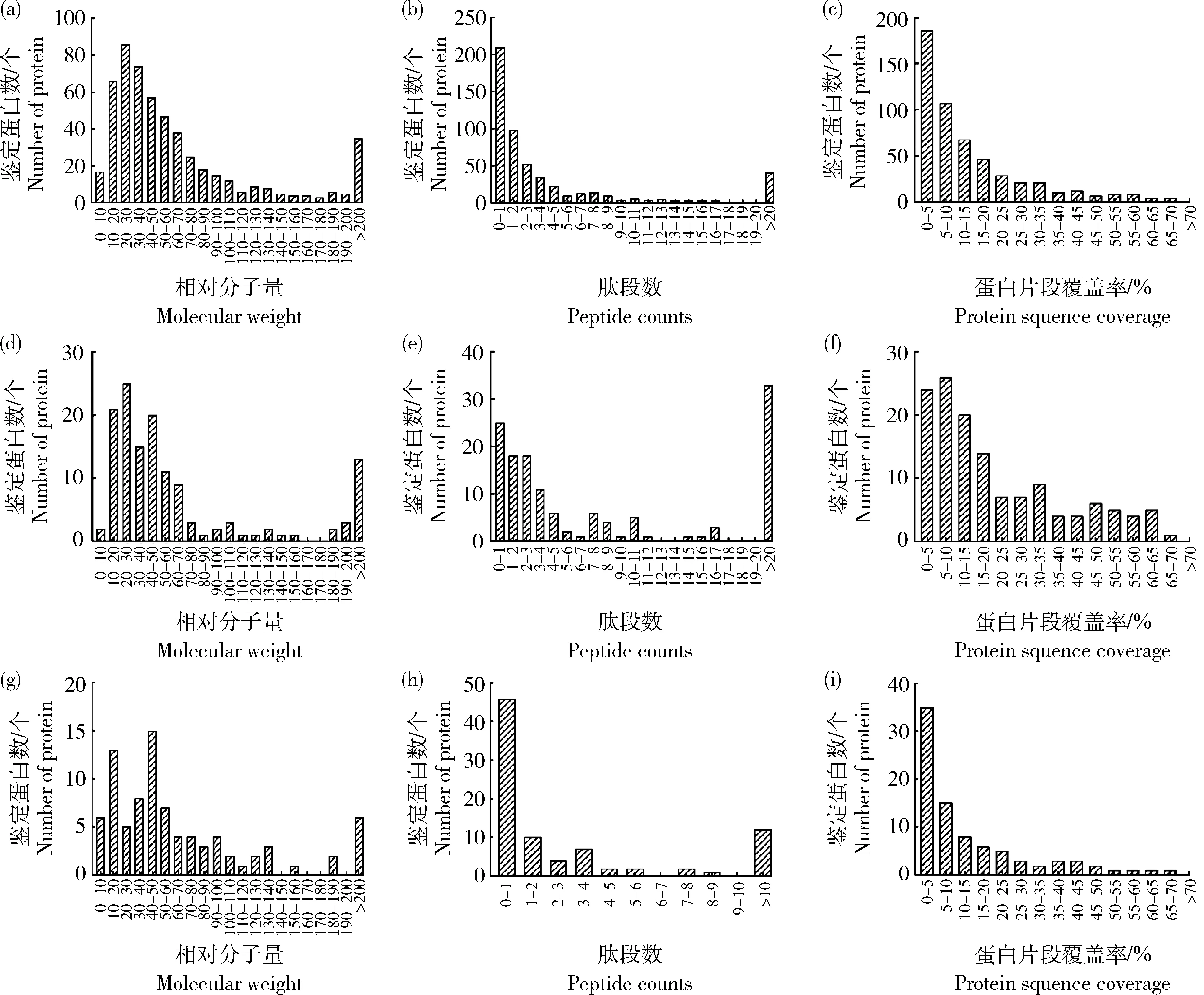
(a)~(c)胰蛋白酶;(d)~(f)胃蛋白酶;(g)~(i)木瓜蛋白酶(a)-(c) Trypsin; (d)-(f) Pepsin; (g)-(i) Papain圖2 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解蛋白的相對分子量、肽段組成和蛋白片段覆蓋率Fig.2 Molecular weight, peptide counts and protein sequence coverage of identified proteins in trypsin, pepsin and papain hydrolysates
2.2 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解產物肽段鑒定及分析
胰蛋白酶,胃蛋白酶和木瓜蛋白酶酶解產物蛋白鑒定結果見圖3,去除重復共鑒定出2 766、1 170和128個肽段。胰蛋白酶鑒定肽段數極顯著高于其余2種酶(P<0.01),胃蛋白顯著高于木瓜蛋白酶(P<0.05)。
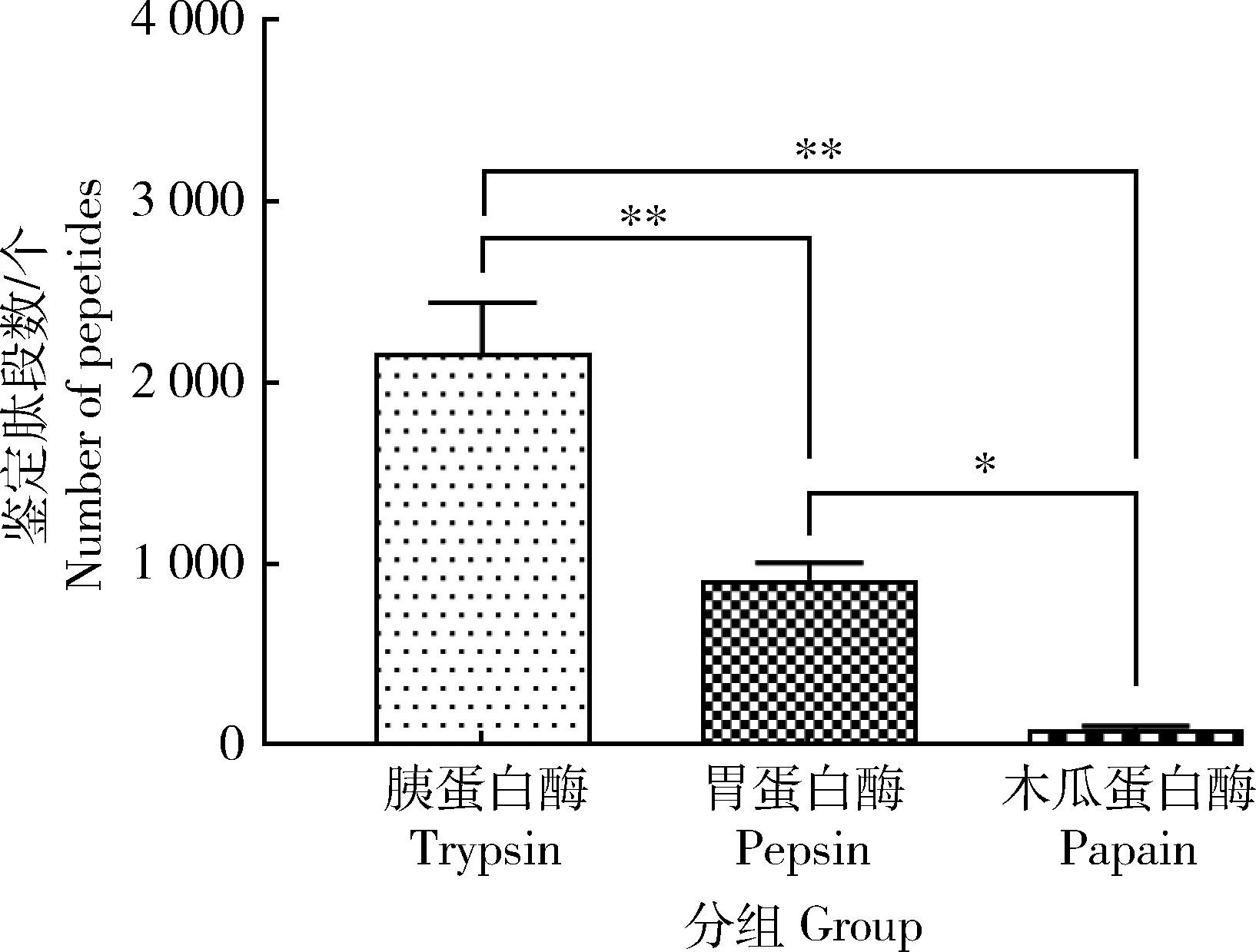
圖3 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解產物鑒定肽段數Fig.3 Numbers of identified peptides in trypsin, pepsin and papain hydrolysates
胰蛋白酶酶解產物2 463種(89.05%)肽段相對分子量小于3 000 u,257種肽段相對分子量小于1 000 u(圖4(a)),其中255種長度在十肽及以下;肽段長度在十肽及以下有654種(圖4(d))。胃蛋白酶酶解產物所有肽段對分子量均在3 000 u以下,106種肽段相對分子量小于1000 u(圖4(b)),其中95種長度在十肽及以下;肽段長度在十肽及以下有247種(圖4(e))。木瓜蛋白酶酶解產物所有肽段對分子量均在3 000 u以下,相對分子量小于1 000 u 有10種(圖4(c)),且其長度均在十肽及以下;有30種肽段長度在十肽及以下(圖4(f))。
2.3 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解產物鑒定肽段的抗氧化活性預測
胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解產物鑒定肽段利用BIO-PEP數據庫進行匹配,未發現數據庫內含的抗氧化活性多肽。相對分子質量小于3 000 u 的肽段具有較強抗氧化作用[17],而小于1 000 u 的抗氧化多肽往往活性最強[18],胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解產物鑒定多肽相對分子質量小于1 000 u分別有257種、106種和10種,而這些肽段絕大部分(255種、95種、10種)長度小于或等于10個多肽,因此,使用BIO-PEP數據庫可對十肽及以下多肽進行抗氧化活性預測。
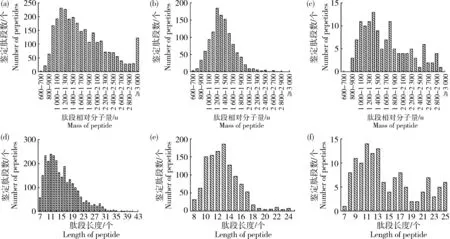
(a)(d)胰蛋白酶;(b)(e)胃蛋白酶;(c)(f)木瓜蛋白酶(a)(d) Trypsin; (b)(e) Pepsin; (c) (f)Papain圖4 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解產物鑒定肽段的相對分子質量((a)~(c))和肽段長度((d)~(f))Fig.4 Mass of peptide and length of peptide of identified peptides in trypsin, pepsin and papain hydrolysates
胰蛋白酶酶解產物共有16種七肽,57種八肽,82種九肽和101種十肽具有潛在抗氧化活性,共256種,占十肽及以下肽段(654種)的39.14%(圖5)。其共同特征為:具有谷氨酸-亮氨酸(Glutamic-Leucine,EL)、亮氨酸-酪氨酸(Leucine-Tyrosine,LY)、甲硫氨酸-甲硫氨酸(Methionine-Methionine,MM)、亮氨酸-賴氨酸(Leucine-Lysine,LK)、異亮氨酸-精氨酸(Isoleucine-Arginine,IR)、甲硫氨酸-酪氨酸(Methionine-Tyrosine,MY)或纈氨酸-酪氨酸(Valine-Tyrosine,VY)殘基等結構。胃蛋白酶酶解產物共有8種八肽,15種九肽和58種十肽具有潛在抗氧化活性,共81種,占十肽及以下肽段(247種)的32.80%(圖5)。其共同特征為:具有組氨酸-亮氨酸(Histidine-Leucine,HL)、LK、蘇氨酸-酪氨酸(Threonine-Tyrosine,TY)、組氨酸-組氨酸(Histidine- Histidine,HH)或EL殘基等結構。木瓜蛋白酶酶解產物共有6種八肽,4種九肽和6種十肽具有潛在抗氧化活性,共16種,占十肽及以下肽段(30種)的53.33%(圖5)。其共同特征為:具有LK、IR或EL等結構。
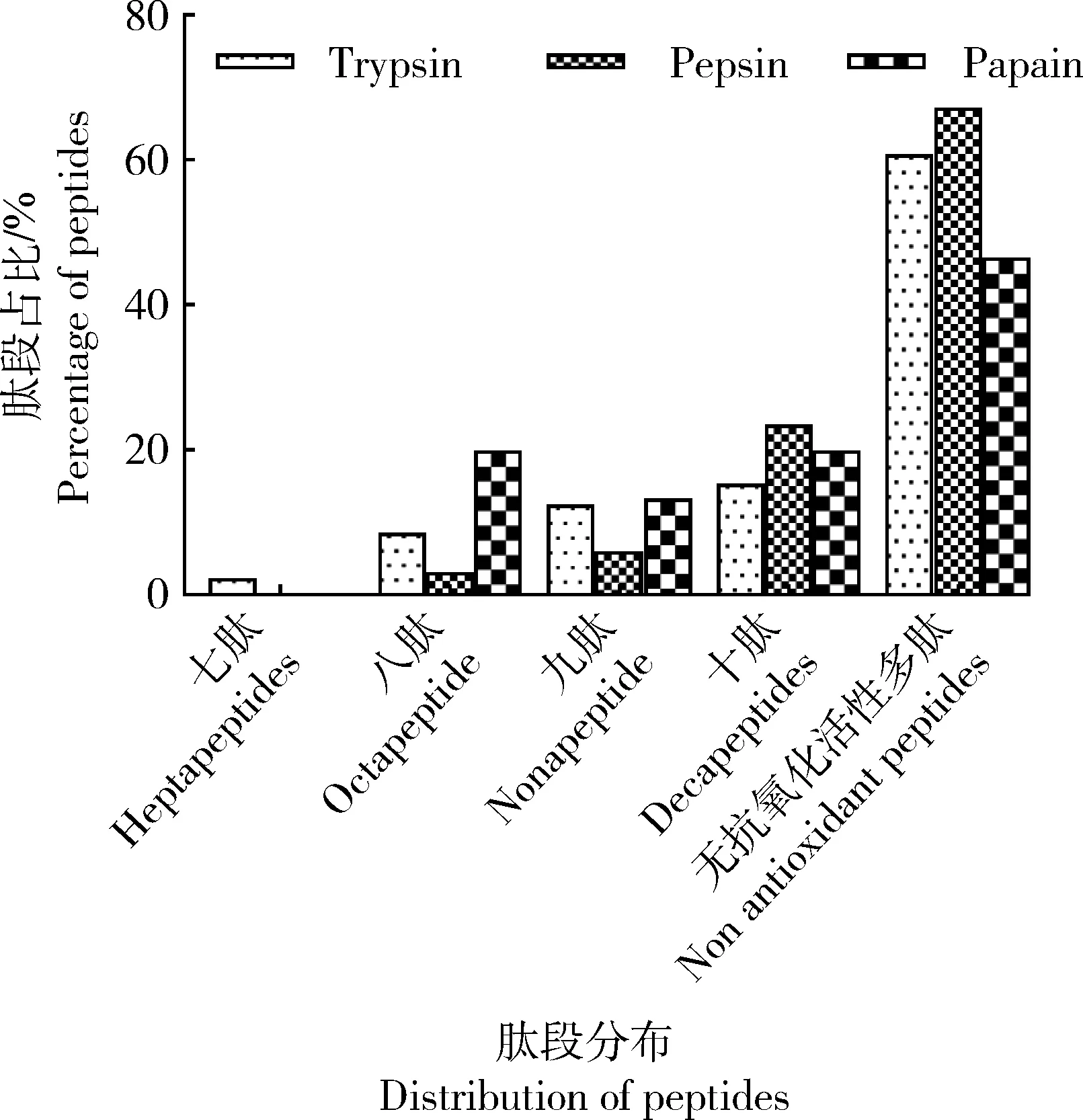
“十肽”表示肽段長度為10個氨基酸且具有抗氧化活性的多肽,縱坐標表示“十肽”及以下肽段比例,以此類推。“Decapeptide” refers to a peptide with length of 10 amino acids and antioxidant activity. Y axis indicates the proportion of “ten decapeptide” and below, and so on.圖5 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解產物十肽及以下肽段抗氧化活性預測Fig.5 Antioxidant activity prediction of decapeptides and below in trypsin, pepsin and papain hydrolysates
3 討 論
3.1 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解產物中蛋白和肽段差異分析
獲得多肽水平上的信息在蛋白組學中需追溯到原始蛋白質,單一蛋白質時比較容易,但在蛋白組成復雜時會變得困難。有研究指出,因分析中肽段太短或太長而丟失,不同蛋白質共有肽段的出現阻礙了蛋白質推斷,導致一組蛋白質的鑒定,而不是單一蛋白質的鑒定[23],因而會阻礙蛋白的鑒定和定量。而工作酶(即消化蛋白所用水解酶)不同是造成肽段信息不同的主要原因之一,也是影響蛋白組學結果重要因素。胰蛋白酶是目前蛋白組學研究中最常用工作酶之一,具有高度特異性,酶解位點為堿性氨基酸精氨酸和賴氨酸-COOH端[24],但缺乏精氨酸和賴氨酸殘基的蛋白不能被胰蛋白酶水解,此外其最適pH接近中性,部分蛋白在此pH下溶解度小,也不能被水解。因此,胰蛋白酶存在一定局限性。胃蛋白酶特異性水解位點可以是芳香族氨基酸,也可是其他疏水性氨基酸NH2端和COOH端[25],特異性不高,但其在酸性環境中活性最強,而部分蛋白在酸性環境的溶解度較大,利于胃蛋白酶消化。木瓜蛋白酶具有廣泛特異性,廣泛應用于活性多肽制備[26],酶解位點為賴氨酸、精氨酸和甘氨酸NH2端和COOH端。上述3種蛋白酶不同特點造成酶解產物間差異。Zhang等[27]使用胰蛋白酶酶解對蝦獲得575種蛋白和2 677個肽段;Wen等[28]對比單獨使用胃蛋白酶或胃蛋白酶后分析發現,使用胰蛋白酶對豬肉、牛肉、雞肉和魚肉勻漿酶解產物差異,發現經胃蛋白酶酶解后從豬肉、牛肉、雞肉和魚肉分別鑒定出101、140、175和32種多肽,經胃蛋白酶和胰蛋白酶酶解后分別鑒定出72、59、92和28種多肽,表明經胰蛋白酶進一步消化后各物種酶解產物蛋白數量差異不顯著,胃蛋白酶對肉類的酶解能力較強。Ha等[29]使用木瓜蛋白酶從脫脂奶粉中提取分離出308個多肽,其中56個具有潛在抗氧化活性,結果表明木瓜蛋白酶可應用于抗氧化活性多肽研究。Jung等[30]認為胰蛋白酶和胃蛋白酶對豬胎盤具有良好水解效率,而牛胎盤酶解產物研究相關信息較少。
本研究使用胰蛋白酶、胃蛋白酶和木瓜蛋白酶研究奶牛胎盤酶解產物差異,獲取相關信息,鑒定蛋白中獨特多肽數量胰蛋白酶最多,胃蛋白酶次之,木瓜蛋白酶最少,結果表明胰蛋白酶是鑒定蛋白最可靠的蛋白酶。且胰蛋白酶酶解產物鑒定肽段中81.52% 相對分子量在1 000~3 000 u,83.84%長度在20個氨基酸以內,大部分肽段能與蛋白準確對應,胃蛋白酶和木瓜蛋白酶鑒定肽段均在3 000 u以內,分別有97.35%和80.47%長度在20個氨基酸內,均符合蛋白組學鑒定要求。蛋白質檢測的可靠性隨蛋白質組中獨特多肽數量增加而提高[31],然而,鑒定蛋白覆蓋率越廣則檢測準確率越高[31],本研究中胰蛋白酶和木瓜蛋白酶鑒定蛋白覆蓋率要明顯優于木瓜蛋白酶,且木瓜蛋白酶鑒定蛋白質量分布較差,在140~200 ku間存在缺失,說明木瓜蛋白酶用于蛋白質組學準確率較差。可能原因是木瓜蛋白酶特異性低,酶切位點廣泛,酶解胎盤所獲肽段長度小于5個氨基酸,而5個氨基酸以下組成的多肽分子量高和電荷高,LC-MS/MS質譜技術檢出率極低[32],但肽段長度較短的多肽往往活性較高,因此木瓜蛋白酶可用于研究小分子活性多肽。
3.2 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解產物抗氧化活性差異分析
肽的抗氧化活性與序列中氨基酸組成、排列順序、分子量大小、肽鍵及肽的空間結構有關[33]。通常認為具有供氫或供電子能力的氨基酸殘基(如Tyr、Trp、Cys、Met和His等)具有清除自由基的能力[27,34],疏水性氨基酸殘基可增強肽抑制脂質過氧化能力[35],而酸性和堿性氨基酸殘基具有螯合金屬離子的能力[36]。此外,Gly和Pro等氨基酸也對肽的抗氧化活性具有一定作用。而天然抗氧化活性多肽生物學作用較多且來源廣泛,但從奶牛胎盤中提取抗氧化活性多肽鮮見報道。本研究通過BIO-PEP數據庫匹配和測算,分析了不同蛋白酶酶解奶牛胎盤產物的抗氧化活性:胰蛋白酶組中GVVGPQGAR強度最高,由牛和小鼠膠原蛋白α-2(I)鏈的P02465蛋白水解產生,與豬膠原蛋白酶解物具有較高相似性,其QGAR殘基使其產生抗氧化活性[18];NDEELNK強度次高,由構成組蛋白H2A的F2Z4 J1蛋白水解產生,其中EL殘基為其抗氧化活性來源[19];強度第三位的GPSGPQGIR同樣來源于P02465蛋白,其IR使其可能具有抗氧化活性[20]。胃蛋白酶酶解產物中YYAPFDGILG強度最高,來源于組成牛胃蛋白酶A的A0A3Q1LZC9蛋白,其YYA殘基為抗氧化活性來源[21];EKIWHHSF強度次高,來源于組成肌動蛋白的G8 JKX4蛋白,其WHH殘基為抗氧化活性來源;強度第三位的PARHQTHGSL由組成硫酸乙酰肝素蛋白聚糖2的F1MER7蛋白水解產生,其RHQ殘基使其具有抗氧化活性[19]。木瓜蛋白酶酶解產物中REEYLLLK強度最高,由包含GTPase活化蛋白2的IQ模體(IQGAP2)的F1MTR1蛋白水解產生,其活性來源為YLL殘基[22]和LK殘基[20];KGNYLILK次高,來源于血小板內皮細胞粘附分子的A0A3Q1MHJ9蛋白,其活性來源為LK殘基[19];RNDEELNK強度第三,為組成組蛋白H2AFJ的Q3ZBX9蛋白水解產物,其活性來源為EL殘基。
胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解奶牛胎盤組織有潛在抗氧化活性多肽共同特征分別是含有EL、LY、MM、LK、IR、MY、VY等殘基,HL、LK、TY、HH、EL等殘基和LK、IR、EL等殘基,上述殘基中含有Y、M、H和K等具有自由基清除能力的氨基酸,L、I和V等疏水性氨基酸,酸性氨基酸E和堿性氨基酸K、R、H。上述氨基酸殘基與資料研究報道一致[34-36],可能是奶牛胎盤酶解產物抗氧化活性的來源。另外,本研究表明,胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解產物十肽及以下具有潛在抗氧化能力的肽段分別占十肽及以下肽段總量39.14%、32.80%和53.33%,木瓜蛋白酶酶解產物的潛在抗氧化能力最強,結果進一步說明了木瓜蛋白酶具有廣泛特異性[26],更適用于奶牛胎盤活性多肽制備。
4 結 論
通過利用LC-MS/M技術對酶解產物定性和定量分析,胰蛋白酶在蛋白質組學中可靠性和準確率均高于胃蛋白酶,而木瓜蛋白酶最差;木瓜蛋白酶對奶牛胎盤酶解更徹底,其酶解產物十肽以下具有潛在抗氧化能力肽段占比最高,潛在抗氧化活性最強;奶牛胎盤酶解產物抗氧化活性多來源于EL、LY、MM、LK、IR、MY、VY、HL、TY、HH等氨基酸殘基。研究結果為奶牛胎盤蛋白組學選擇蛋白酶和提取奶牛胎盤抗氧化活性多肽提供理論基礎,促進奶牛胎盤開發利用。

