鱘鰉魚網箱養殖環境微生物菌群結構及潛在病原菌分析
黃 薇 周華書 劉蘭英 羅土炎 宋永康
(1. 福建省農業科學院農業質量標準與檢測技術研究所, 福建省農產品質量安全重點實驗室, 福州 350003;2. 周寧縣水產技術站, 周寧 355400)
鱘鰉魚是地球上現存最古老的脊椎動物, 包括鱘屬Acipenser和鰉屬Huso, 共2屬21種, 其中我國擁有8種,是鱘鰉魚分布較多的國家[1]。目前, 鱘鰉魚的所有屬種均被列入世界珍稀瀕危物種, 如何妥善保護與開發利用這些珍稀瀕危物種, 已成為全世界亟不可待的研究課題[1,2]。近年來, 隨著養殖環境的不斷惡化鱘鰉魚細菌性疾病發生率不斷增加, 給這一珍貴物種造成了不可彌補的巨大損失[3]。
魚類的健康狀況與其生活的水環境密切相關[4]。水環境中生存著大量的已知和未知的細菌菌群, 在水質調控、物質代謝、生態系統穩定及疾病的發生與控制等方面都發揮著重要的作用[5]。崔丙健等[6]認為, 盡管在養殖水環境中病原菌的豐度較低, 但也可能在特定條件下大量增殖, 從而導致水產病害暴發。同時研究顯示, 養殖環境中病原菌的數量和種類與魚類疾病的發生幾率及發病類型呈顯著正相關[7]。因此, 為了更好的保護和培育鱘鰉魚這一珍貴物種, 闡明其養殖環境的菌群結構組成是有必要的, 理解養殖環境中的微生物種類和數量將有助于調控養殖環境的微生態平衡、疾病防控及病原菌的快速診斷。
隨著高通量測序技術的快速發展, 國內外學者在部分魚類養殖水環境中的微生物結構組成方面的研究已經取得了初步進展, 包括大黃魚(Larimichthys crocea)[8]、羅非魚(Tilapia larvae)[9]、縊蟶(Sinonovacula constricta)[10]和淡水蝦[11]等。然而對鱘鰉魚養殖環境中菌群結構組成研究尚未見到報道。因此, 本文采用高通量測序技術和實時熒光定量PCR等技術手段對福建省周寧縣中華鱘保種中心穩定養殖的4個鱘鰉魚品種的網箱養殖水體細菌群落結構及潛在病原菌存在情況進行了分析, 為該中心鱘鰉魚養殖過程中的水質調控及疾病預防提供理論基礎。
1 材料與方法
1.1 樣品采集
試驗樣品來源于福建省周寧縣中華鱘保種中心(北緯27°11′, 東經119°20′), 該中心的鱘鰉魚為水庫網箱養殖, 養殖區平均海拔700 m, 網箱6 m深水溫為13—23℃, 晝夜溫差不超過2℃, pH為6.8—7.2,網箱養殖密度約200尾/網箱, 養殖所用餌料為人工配合飼料, 每天早晚投喂1次, 日投喂率為魚體體重的0.5%。樣品于2019年9月12日采集, 隨機選取中心穩定養殖的4個鱘鰉魚品種(中華鱘A. sinensis、施氏鱘A. schrenckii、達氏鰉H. dauricus和大雜交鱘A. schrenckii♂×H. dauricus♀)養殖網箱各3個, 在每個網箱的四角各設1個采樣站位, 利用500 mL的含0.4 mg硫代硫酸鈉的無菌水樣采集袋采集水深5 m處(網箱水深6 m)的水樣, 將各網箱采集的水樣混合均勻后裝于滅菌容器, 4℃運輸和保存, 樣品相關指標的測定和DNA提取在24h內完成。樣品命名: 中華鱘網箱養殖水體樣品編號為Z1、Z2和Z3,施氏鱘網箱養殖水體樣品編號為S1、S2和S3, 達氏鰉網箱養殖水體樣品編號為H1、H2和H3, 大雜交鱘網箱養殖水體樣品編號為D1、D2和D3。
1.2 水質測定
水溫、pH和溶解氧(DO)均在現場進行測定,采用便攜式多參數測試儀SG68-ELK-ISM(MettlerToledo, Zurich, Switzerland)進行測定, 儀器使用前均已校正。實驗室測定指標包括氨氮N)、總磷(TP)、高錳酸鹽指數(CODMn)和五日生化需氧量(BOD5), 分析方法如下:N采用納氏試劑分光光度法(HJ 535-2009)、TP采用鉬酸銨分光光度法(GB 11893-1989)、CODMn采用酸式滴定法(GB11892-1989)和BOD5采用稀釋與接種法(HJ05-2009)。
1.3 基因組DNA提取
取各網箱養殖水體1 L, 首先利用5.0 μm濾膜濾去浮游動植物和大顆粒物; 再利用0.22 μm濾膜截留微生物。獲得的濾膜樣品利用強力水樣微生物總DNA提取試劑盒(MOBIO, Carlsbad, CA, USA)提取DNA, 用Qubit 2.0 熒光定量儀(Invitrogen, Carlsbad, CA, USA)進行定量, 提取的DNA樣品放置在-80℃冰箱中保存備用。
1.4 PCR擴增和Illumina測序
PCR擴增采用16S rRNA基因V3—V4區的通用引物341F和805R。PCR反應體系總體積 30 μL, 含模板DNA 20 ng。PCR擴增程序為: 94℃, 3min;(94℃, 30s; 45℃, 20s; 65℃, 30s)×5; (94℃, 20s;55℃, 20s; 72℃,30 s)×20; 72℃, 5min。得到的PCR產物經QIAquick PCR 純化試劑盒(Qiagen,Düsseldorf, Germany)純化后, 送生工生物工程(上海)股份有限公司Illumina MiSeq平臺進行高通量測序, 測序得到的原始數據提交到NCBI的 SRA數據庫, 序列登錄號為SRP251784。
1.5 高通量數據處理
Illumina MiSeq測序得到的原始數據, 首先使用FLASH軟件[12]根據序列間的overlap關系將成對的序列拼接成一條序列; 再運用Cutadapt軟件[13]去除測序時加入的引物和接頭序列, 按照barcode標簽序列識別并區分樣品; 然后使用Prinseq軟件[14]對各樣品數據質量進行質控過濾; 所得各樣本的有效數據再經過Usearch軟件[15]去除嵌合體以及進行Operational Taxonomic Units (OTUs)聚類分析; 對OTU代表序列利用Ribosomal Database Project (RDP)classifier比對RDP數據庫進行物種注釋[16]; 利用Mothur軟件對單樣品的微生物多樣性(alpha多樣性)進行分析[17]; 采用QIIME軟件計算兩兩樣本間的weighted UniFrac距離, 用于beta多樣性分析[18]。
1.6 熒光定量PCR標準曲線構建及定量PCR
參考文獻中報道的鱘鰉魚典型致病菌16S rRNA序列設計的特異性引物序列, 經過多重比對驗證試驗后, 篩選出3對PCR引物(表 1)。以所提樣品DNA為模板進行常規PCR擴增, 擴增后的PCR產物經過純化后, 與pMD18-T載體接連轉化至大腸桿菌DH5α中, 挑取轉化后的陽性克隆子利用QIAGEN Plasmid Mini Kit(Qiagen, Düsseldorf,Germany)提取質粒DNA, 送測序公司驗證插入的基因片段是否正確, 驗證正確后測定質粒濃度并繪制標準曲線。

表1 用于實時熒光定量 PCR 檢測的引物Tab. 1 RT-PCR primers sequences used in assay
將已知拷貝數的質粒作為標準模板, 采用LightCycler480 II型熒光定量PCR儀(Roche,Rotkreuz, Switzerland)進行實時熒光定量PCR擴增。熒光定量PCR反應體系總體積 10 μL, 含2×SG Fast qPCR Master Mix 5 μL, 模板DNA 10 ng。熒光定量PCR擴增程序為: 95℃, 3min; (95℃, 5s;55/60℃, 30s; 72℃, 45s)× 45; 72℃, 10min。熔解曲線條件: 95℃, 1min; 55℃, 30s; 95℃, 30s。所有反應均設置3個重復, 每輪反應均以無菌 ddH2O 代替模板DNA作為陰性對照。
1.7 數據統計分析
在本研究中, 平均值和標準偏差采用Excel軟件計算;P-values采用SPSS軟件計算, 單因素方差分析運用Least Significant Difference (LSD法); PCoA圖、柱狀圖、熱圖和韋恩圖采用R軟件繪制。
2 結果
2.1 鱘鰉魚養殖水體水質分析
從表 2可以看出, 中華鱘保種中心水庫水質良好, 水溫適合鱘魚生長, pH呈中性, 網箱養殖水體中的DO、和CODMn達到Ⅱ類水質標準,BOD5和TP達到Ⅲ類水質標準。中華鱘及其他鱘鰉魚網箱養殖水體的水質指標含量基本一致, 除BOD5外, 不同品種鱘鰉魚網箱養殖水體的水質指標含量不存在顯著差異(P≥0.05)。
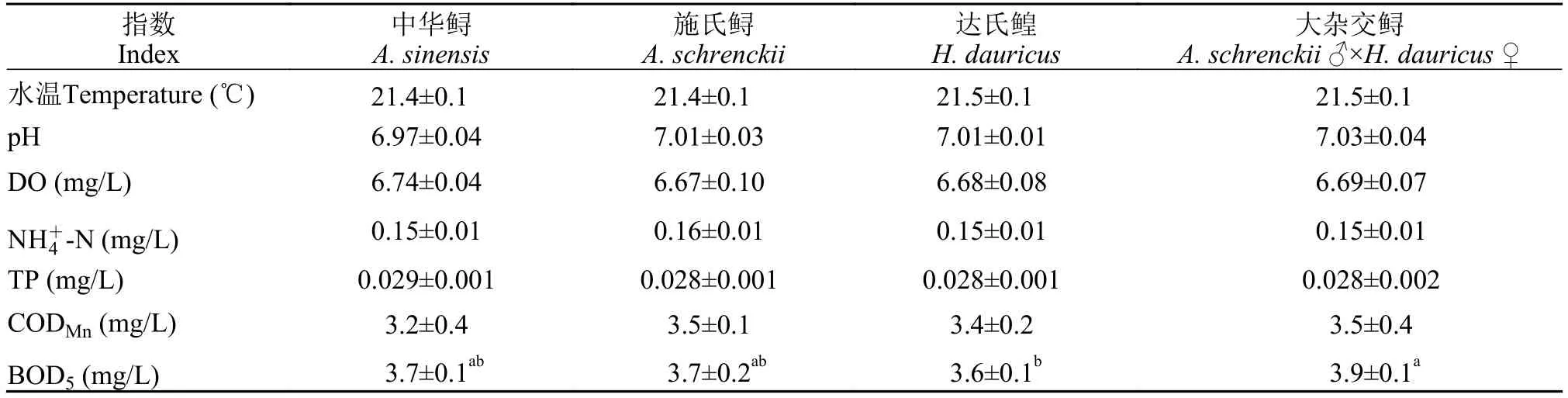
表2 四種鱘鰉魚網箱養殖水體水質分析Tab. 2 The characteristics of water quality in four sturgeon species cage culture environments (mean±SEM, n=3)
2.2 鱘鰉魚養殖水體細菌群落結構特征分析
從表 3可知, 中華鱘、施氏鱘、達氏鰉和大雜交鱘養殖水環境樣品中分別獲得有效16S rRNA序列數為51537±3709、66785±13726、56344±19476和58587±7538 條, 平均每個樣品獲得OTUs為1163個。根據各樣品的Good’s coverage指數>99%,可知本研究的測序結果可以代表樣本的真實情況。Alpha多樣性分析結果表明, 大雜交鱘養殖水體的OTUs及ACE要顯著高于其他品種, 表明大雜交鱘養殖水體中的物種總數較高。一般來說,BOD5值越高, 水質有機物濃度越高, 細菌的物種數也會越豐富。除此之外, 其余Alpha多樣性指數(Chaol、Shannon和Simpson)無顯著性差異(P≥0.05), 表明各樣品間的微生物結構組成基本一致。根據weighted Unifrac距離進行PCoA分析, 從分析結果可知(圖 1), PCoA圖的前3個主坐標可以代表83.1%的變量信息, 除其中一個中華鱘網箱養殖水體樣品外, 其余樣品均聚在一起, 表明這些鱘鰉魚養殖水體中的微生物結構和組成十分相似。
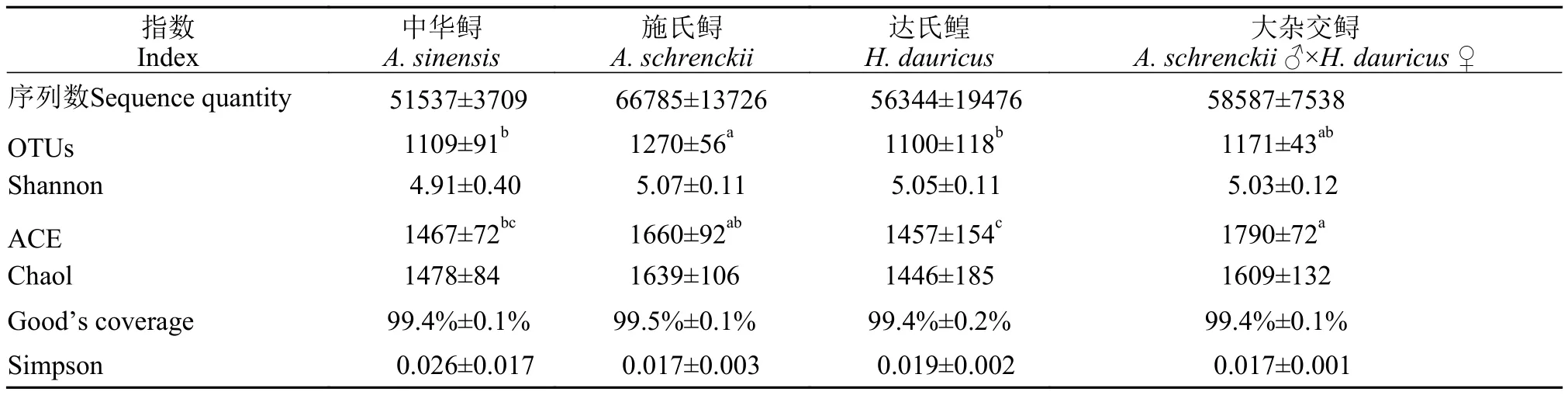
表3 Illumina測序數據統計分析Tab. 3 Statistical indexes calculated based on the Illumina sequencing data (mean±SEM, n=3)
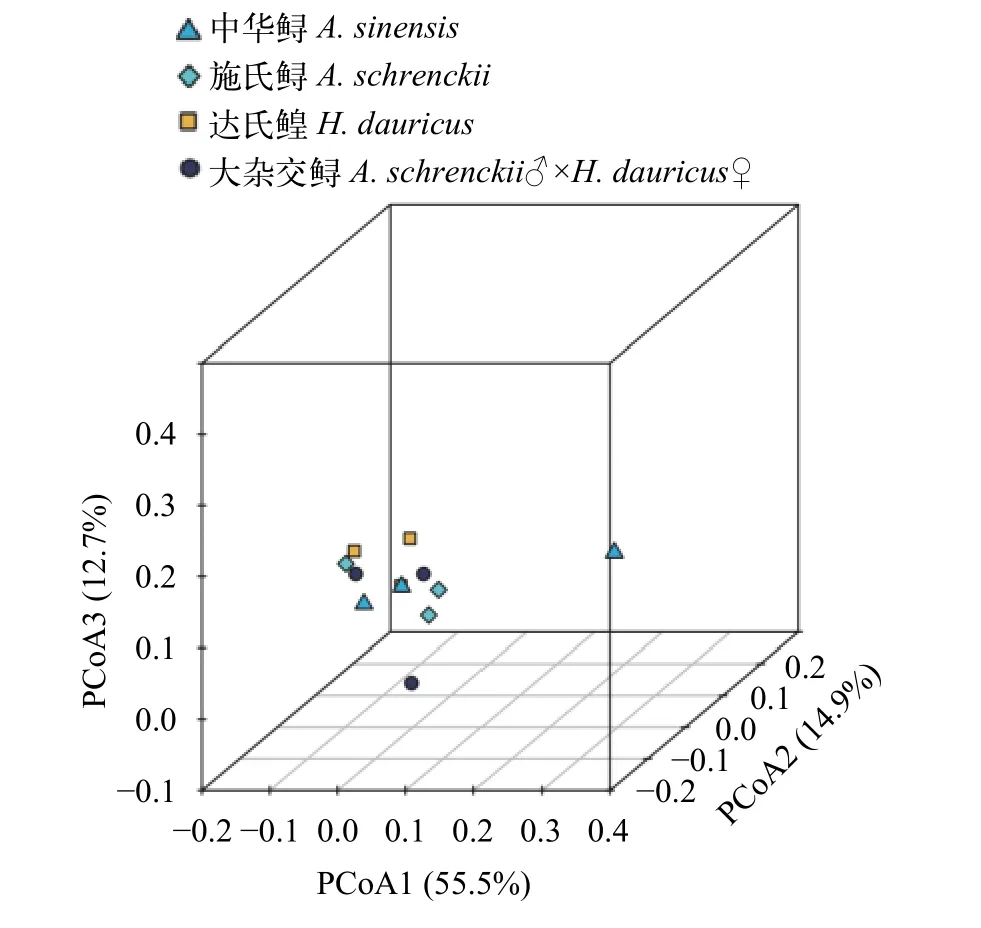
圖1 基于weighted UniFrac距離的樣品細菌群落結構PCoA分析Fig. 1 Principal coordinates analysis (PCoA) of community compositions in samples microbiota based on weighted UniFrac
12個鱘鰉魚養殖水體樣品共獲得20個門類細菌(圖 2)。不同品種鱘鰉魚網箱養殖水環境中的優勢菌門基本一致, 均由Proteobacteria、Actinobacteria、Bacteroidetes、Verrucomicrobia和Planctomycetes組成, 這些優勢門類分別占到所有樣品序列總數的88.81%—93.94%。其中, 豐度最高的菌門為Proteobacteria, 占樣品序列總數的35.98%—39.94%,其次是Actinobacteria, 占樣本序列總數的21.77%—24.70%。差異顯著性分析結果顯示, 這些優勢細菌門在各鱘鰉品種網箱養殖水體中的豐度不存在顯著性差異(P≥0.05), 說明各鱘鰉魚網箱養殖水體中的微生物結構組成在門水平上基本一致。
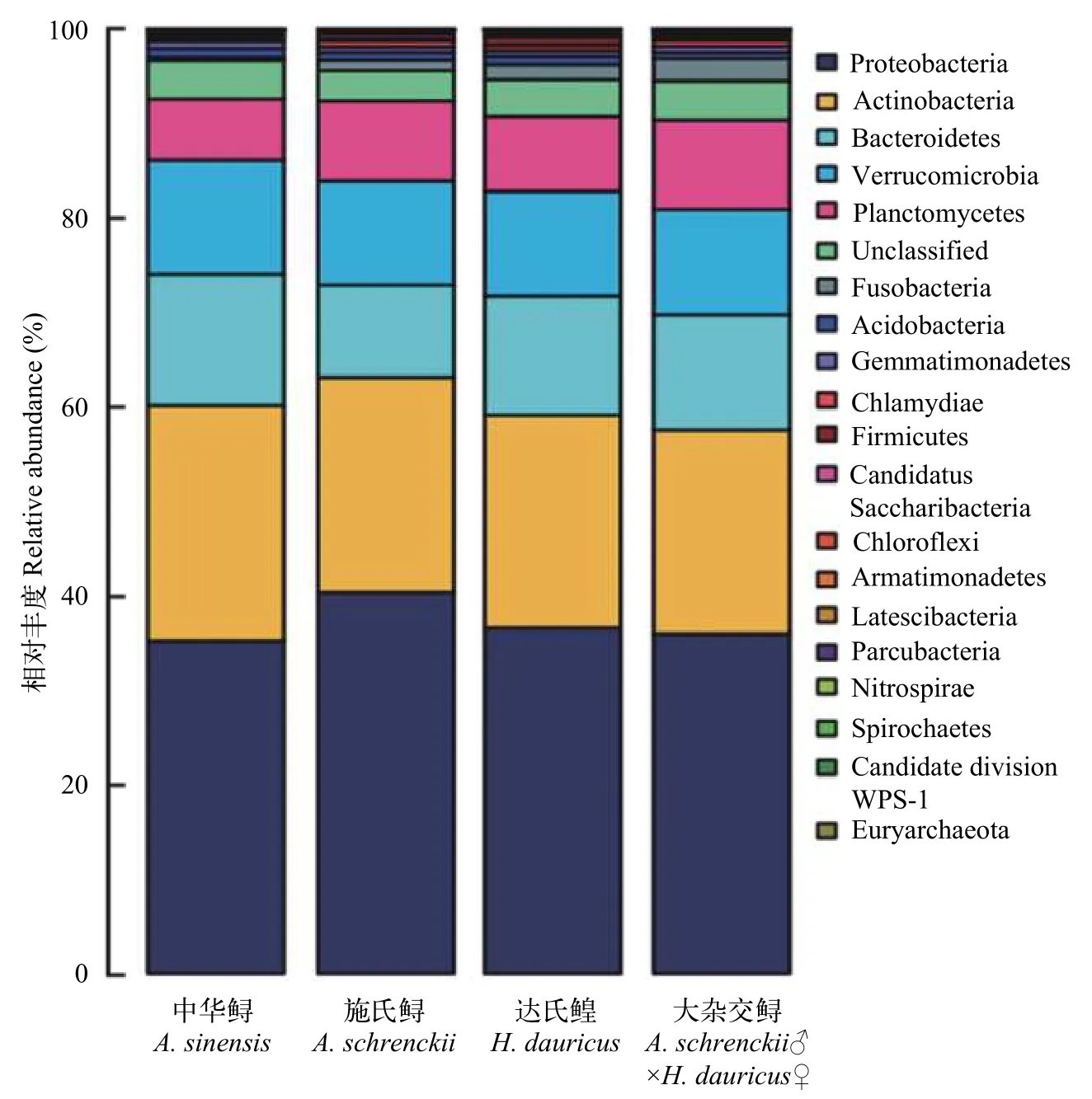
圖2 門水平下各鱘鰉魚品種網箱養殖水體中細菌群落結構組成Fig. 2 The taxonomic composition distribution in samples at the phylum level
在各鱘鰉魚品種網箱養殖水體樣品中, 共檢測到224個細菌屬, 對豐度前50的細菌屬進行熱圖分析(圖 3), 養殖水體中細菌種群有高達34.77%—58.81%的物種未分類, 除此之外相對豐度在2%以上的細菌屬主要有Ilumatobacter(3.59±0.97)%、Sediminibacterium(2.38±0.56)%、Acinetobacter(2.53±3.33)%、Spartobacteria_genera_incertae_sedis(2.13±0.68)%和Subdivision3_genera_incertae_sedis(2.01±1.91)%。同時統計結果顯示, 這些優勢菌屬在各鱘鰉品種網箱養殖水體的差異不顯著(P≥0.05), 表明在屬水平上, 各鱘鰉魚網箱養殖水體中的優勢菌屬結構組成相似。
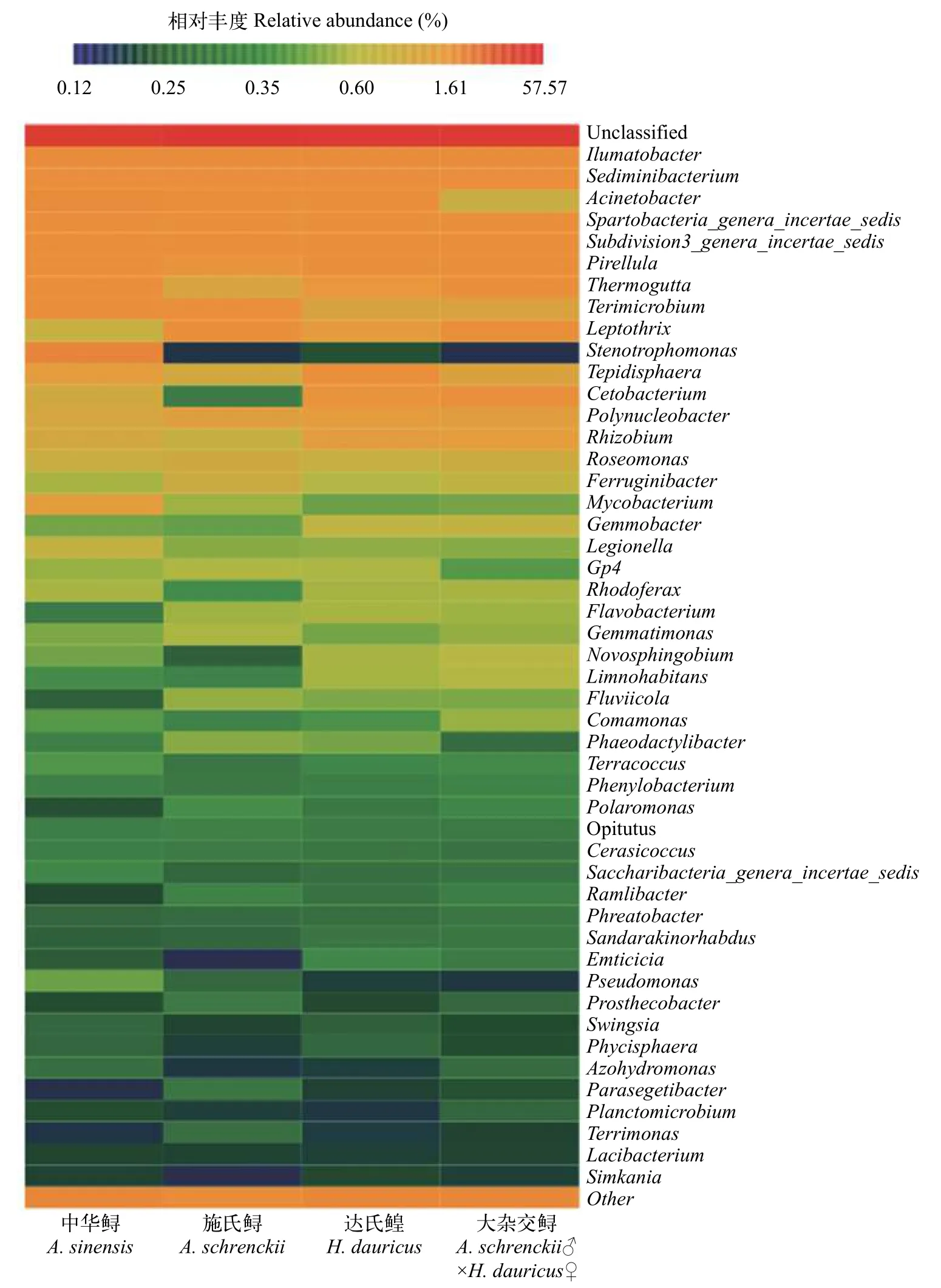
圖3 屬水平下各鱘鰉魚品種網箱養殖水體中細菌群落結構組成Fig. 3 The taxonomic composition distribution in samples at the genus level
2.3 鱘鰉魚網箱養殖水體細菌群落組成比較分析
通過構建韋恩圖來分析不同品種鱘鰉魚網箱養殖水體樣品中所共有的和特有的OTU數目(圖 4)。中華鱘、施氏鱘、達氏鰉和大雜交鱘網箱養殖水體共有了1059個OTUs, 統計分析表明, 共有的OTUs序列分別占中華鱘、施氏鱘、達氏鰉和大雜交鱘網箱養殖水體序列總數的99.13%、98.44%、99.21%和99.18%。因此, 不同鱘鰉魚網箱養殖水體中的核心菌群是一致的。此外, 中華鱘、施氏鱘、達氏鰉和大雜交鱘網箱養殖水體中還含有特有的OTUs分別為70、156、43和68個, 分別占中華鱘、施氏鱘、達氏鰉和大雜交鱘網箱養殖水體總序列數的0.13%、0.51%、0.08%和0.09%。
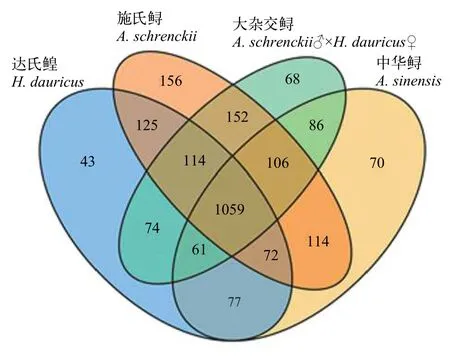
圖4 不同品種鱘鰉魚網箱養殖水體中共有的和特有的OTUsFig. 4 Venn diagram displaying the number of shared and unique OTUs in the different sturgeon cage culture water
2.4 中華鱘及其他鱘鰉魚養殖水體中潛在病原菌分析
在本研究檢測的網箱養殖水體樣品中共發現鱘鰉魚病原菌菌屬7個, 主要包括Aeromonas、Acinetobacter、Chryseobacterium、Edwardsiella、Flavobacterium、Pseudomonas和Vibrio。從表 4可以看出, 7個潛在病原菌菌屬在不同鱘鰉魚養殖水體中的分布規律較為接近, 但是7個潛在致病菌菌屬的相對豐度存在顯著性差異(P<0.05), 除中華鱘養殖水體中Pseudomonas>Flavobacterium外, 其余相對豐度大小均表現為:Acinetobacter>Flavobacterium>Pseudomonas>Aeromoas>Chryseobacterium>Vibrio>Edwardsiella。
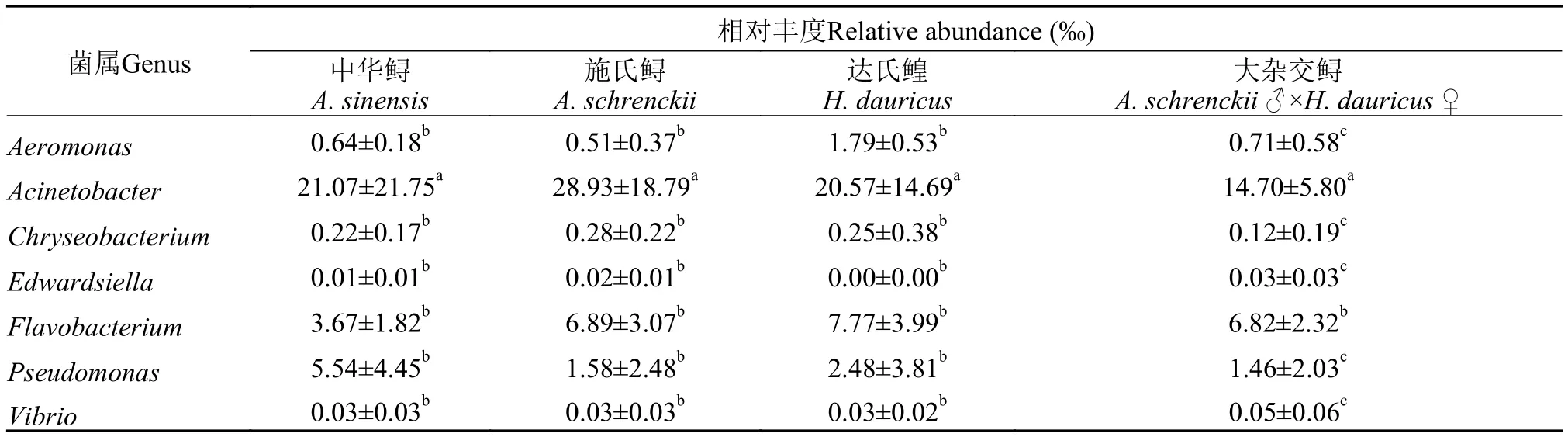
表4 不同品種鱘鰉魚網箱養殖水體中潛在病原菌屬及分布Tab. 4 Potential pathogens distribution in the different sturgeon cage culture water (mean±SEM, n=3)
利用熒光定量PCR對已報道鱘鰉魚養殖過程中的典型病原菌進行檢測。從圖 5可以看出,A. hydrophila在養殖水體中的豐度[(7406±1892) copies/mL]要高于或顯著高于(P<0.05)其他病原菌, 其次為F. columnar[(4889±1649) copies/mL)和P. fluorescens[(3259±1117) copies/mL)。
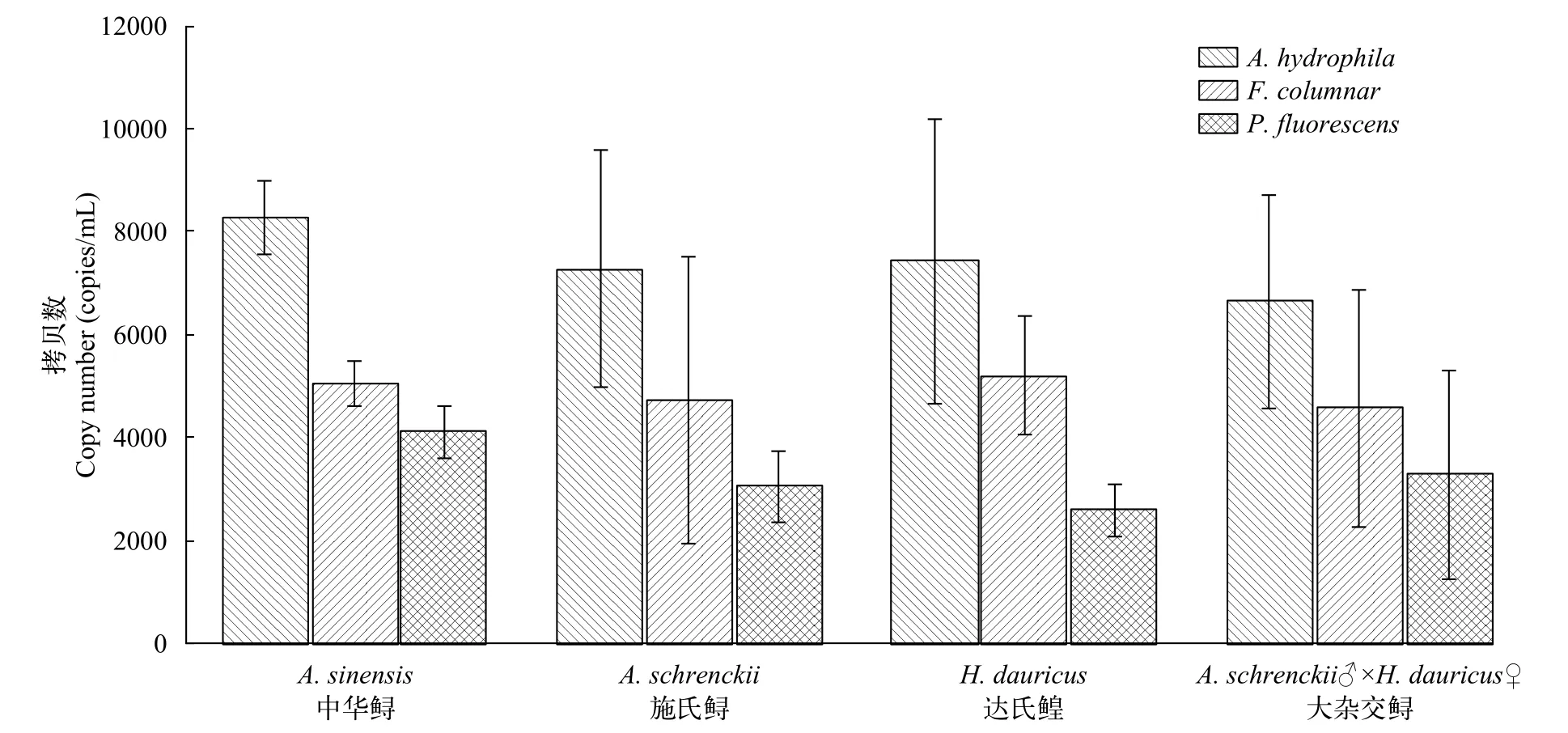
圖5 網箱養殖水體中病原微生物豐度Fig. 5 Frequency of pathogenic microorganisms in cage culture water
3 討論
養殖水體中存在著大量的已知和未知微生物,其與水生生物體內寄生的微生物菌群相互作用、相互影響, 形成了復雜的細菌-細菌、細菌-宿主互作關系, 從而對水生生物的健康成長產生重要的影響[20]。大量的研究表明, 明確養殖環境中的微生物結構組成將有助于病害控制防治、益生菌篩選及病原菌發病機制研究等工作[8,21]。因此, 本研究采用高通量測序技術, 對4種鱘鰉魚網箱養殖水體中的微生物的結構組成及潛在病原菌分布進行了分析和比較。
從16S rRNA基因高通量測序結果來看, 不同品種鱘鰉魚在同一水域同一管理條件下, 其養殖水體中核心菌群基本一致, 優勢菌群主要由Proteobacteria、Actinobacteria、Bacteroidetes、Verrucomicrobia和Planctomycetes組成, 這與已報道的羅非魚[22]、草魚[23]、魚菜共生[24]和魚貝混養[25]等養殖水環境的優勢菌群相似。研究顯示, Proteobacteria、Actinobacteria、Bacteroidetes和Planctomycetes在脫氮除磷、降解大分子、有機物質轉換及產生抗菌類物質等密切相關, 這些優勢微生物的存在對于魚類健康養殖有重要意義[24,26,27]。而Verrucomicrobia是污染程度的指示菌群[28], 在未受污染的沉積物中普遍存在, 在污染的沉積物中出現缺失, 這與本研究檢測出鱘鰉魚網箱養殖水質指標較好(處于Ⅱ—Ⅲ級)相吻合。同時, 新近的研究顯示, 魚類腸道中的優勢微生物也來自于Proteobacteria、Actinobacteria和Bacteroidetes[29,30], 這在一定程度上也說明了水生生物與其水環境中的微生物之間存在緊密的互作關系。
在屬水平上, 各樣品未分類的細菌(unclassified)占比都超過34%, 占比最高達到58.81%, 說明鱘鰉魚養殖水體中的微生物種類復雜多樣, 有大量的微生物未被人們熟知, 同時也表明利用傳統的培養分離等方法很難得到全面、準確的結果[31]。因此, 為了更好地培育這一珍貴物種, 采用高通量測序技術闡明其養殖環境中的微生物結構組成十分必要。在水產養殖實踐中, 養殖環境中的許多致病菌, 尤其是條件致病菌大量增殖導致的水產病害頻發是水產養殖過程面臨的主要問題[6]。該結果證實了鱘鰉魚典型病原菌在養殖環境中的普遍性, 本文采用高通量測序技術在網箱養殖水體樣本中共發現鱘鰉魚病原菌菌屬7個。
基于16S rRNA片段基因高通量測序技術能夠解析樣本中微生物的總體結構, 取得更多不能通過分離培養技術獲取的細菌種類信息, 但限于二代高通量測序技術測序長度偏短, 其對于具體到種一級的信息辨別能力不足[20], 這對于獲取種間關系復雜的病原菌信息難度較大。為此, 本試驗利用實時熒光定量PCR的方法對網箱養殖環境水體樣品中常見的典型鱘鰉魚致病菌進行定量檢測, 檢測結果顯示A. hydrophila在養殖水體中的豐度要高于F. columnar和P. fluorescens, 這與高通量測序檢測的致病菌屬結果不一致。盡管16S rRNA基因片段的PCR引物擴增的特異性會出現一定的差異, 但推測主要原因還是在于致病菌屬包含了不止一種的致病菌種。Aeromoas廣泛存在于自然界及健康魚體的腸道中,屬于條件致病菌。根據田甜等[3]和楊移斌等[32]的報道,A. hydrophila是中華鱘及其他鱘鰉魚病害最常見的病原菌, 可導致紅嘴病、腹水病和敗血癥等的發生。在鱘鰉魚的養殖過程中, 病原菌的早期監控對疾病防控具有極為重要的作用, 本研究的結論將有助于針對性地指導對該區域中華鱘等鱘鰉魚養殖過程進行科學防病和水質調控。
4 結論
在同一水域同一管理條件下, 不同品種鱘鰉魚網箱養殖水體中的細菌組成與豐度基本一致, 優勢菌門均由Proteobacteria、Actinobacteria、Bacteroidetes、Verrucomicrobia和Planctomycetes組成,優勢菌屬為Ilumatobacter、Sediminibacterium、Acinetobacter、Spartobacteria_genera_incertae_sedis和Subdivision3_genera_incertae_sedis, 表明不同鱘鰉魚的養殖生態環境管理經驗是可以相互借鑒的。在鱘鰉魚網箱養殖環境中, 共發現鱘鰉魚病原菌菌屬7個:Aeromonas、Acinetobacter、Chryseobacterium、Edwardsiella、Flavobacterium、Pseudomonas和Vibrio, 實時熒光定量PCR檢測結果顯示, 在鱘鰉魚養殖過程中最常見的病原菌A. hydrophila的豐度最高, 為(7406±1892) copies/mL, 其次F. columnar的豐度為(4889±1649) copies/mL及P.fluorescens的豐度為(3259±1117) copies/mL。

