四十八份青花菜品種SSR指紋圖譜構建
林朦婕,溫慧萍,肖建中,鄭 強,*
(1.麗水學院 生態學院,浙江 麗水 323000;2.華南師范大學 生命科學學院,廣東 廣州 510631)
青花菜(BrassicaoleraceaL.var.italicPlanch.)是十字花科蕓薹屬甘藍種中以花球為產品的一個變種,營養價值高、具較好的抗癌活性[1],是國際流行蔬菜,也是中國大宗的重要蔬菜種類之一,在全國各地均有種植[2]。但目前中國蔬菜種子經營主體數量眾多,青花菜種子市場秩序比較混亂,魚龍混雜,大量偽劣套牌種子的出現不僅造成種子質量下降,也導致病害頻發,對種植農戶與地方經濟造成巨大的負面影響。因此,建立一套準確高效的青花菜品種真實性鑒定技術體系,對打擊假冒偽劣種子與規范我國種子市場尤為重要。
農作物的品種鑒定方法主要包括形態學鑒定法、物理化學鑒定法、生化鑒定法和DNA分子標記法等[3]。形態學鑒定法耗時長,易受環境條件的影響,且鑒定結果具有一定的主觀性;物理化學鑒定法與生化鑒定法在應用范圍上有較大的局限,對于近似品種往往難以區分;DNA分子標記法通過分析DNA水平的差異來進行品種鑒定,具有快速、高效、準確、易實現自動化等優點,越來越受到重視[4]。簡單重復序列(simple sequence repeat,SSR)標記,因其具有多態性豐富、穩定性與重復性好、技術簡單易于操作等特點,在指紋圖譜的構建與品種真實性鑒定方面得到廣泛應用。段艷鳳等[5]利用篩選到的6對多態性引物成功構建了中國88個馬鈴薯審定品種的指紋圖譜,并能將其完全區分;Zhu等[6]用18對多態性豐富的SSR引物成功構建了浙江省主栽的48個水稻品種的DNA指紋圖譜,并成功用指紋圖譜進行品種鑒定;王慶彪等[7]利用20對EST-SSR引物構建了中國50個甘藍代表品種的指紋圖譜并用于品種鑒定;賴運平等[8]從952對SSR引物中篩選得到47對核心引物,構建了184份甘藍型油菜的指紋圖譜;公丹等[9]用14對SSR引物系統構建了88份豇豆品種的DNA指紋圖譜。近年來,在SSR分子標記技術的基礎上,國內已經出臺了一系列重要蔬菜品種的分子鑒定技術標準,包括蕓薹屬的白菜與甘藍等[10],為解決品種爭議、保護育種權益、規范市場奠定了基礎。盡管目前有利用分子標記對青花菜進行遺傳多樣性分析或指紋圖譜構建相關的研究,但大多采用的是ISSR(inter-simple sequence repeat)、RAPD(random amplified polymorphic DNA)等分子標記對少數品種樣本進行聚類分析或指紋圖譜構建[11-12],或者由于采用的引物不具備核心引物特質[13-18],這些研究尚不能系統地應用于青花菜品種的真實性鑒定。為此,本研究以12份遺傳差異較大的品種為材料,從945對蕓薹屬的SSR引物中篩選到了20對核心SSR引物,并構建了48份國內市場常見的青花菜栽培品種的DNA指紋圖譜,旨在為開發青花菜品種真實性分子鑒定技術標準或規程,以及為促進國內青花菜DNA指紋圖譜庫的系統構建奠定基礎。
1 材料與方法
1.1 供試材料
48份青花菜材料部分來源于中國青花菜育種單位(北京蔬菜花卉研究所、浙江省農業科學院蔬菜研究所、臺州市農業科學研究院等),部分來源于種子經銷實體店或網店,涵蓋了目前中國市場上主要的青花菜品種,具體信息見表1。

表1 四十八份青花菜代表品種特性與來源
1.2 基因組DNA的提取
稱取0.2 g青花菜種子,放入-20 ℃預冷的研缽,加入液氮研磨至細粉狀,按照植物基因組DNA提取試劑盒[天根生化科技(北京)有限公司,試劑盒型號DP350]的操作說明,提取青花菜種子基因組DNA,用微量核酸蛋白分析儀測定DNA濃度與純度,并稀釋至40 ng·μL-1備用。
1.3 SSR引物
依據參考文獻[13-18]報道的序列,由生工生物工程(上海)股份有限公司合成共合成945對SSR引物,并挑選12份性狀差異較大的品種(炎秀、優秀、耐寒優秀、陽光、喜鵲、幸運、黛蘭諾、B1199、南秀366、萬寶金、TBR-800、曼陀綠)進行引物初篩。
1.4 PCR擴增
1.4.1 降落式PCR
引物初篩過程采用降落式PCR程序。反應體系為20 μL,包括ddH2O 14.4 μL、10× Buffer緩沖液2 μL、Mg2+(25 mmol·L-1)1.2 μL、dNTP Mixture(25 mmol·L-1)0.2 μL、Taq酶(5 U·μL-1)0.2 μL、DNA模板(40 ng·μL-1)1 μL、上下游引物(10 μmol·L-1)各0.5 μL。降落式PCR程序為:94 ℃預變性2 min,94 ℃變性40 s,62.5 ℃退火30 s,72 ℃延伸45 s,每循環降1 ℃,共10個循環;94 ℃變性40 s,52.5 ℃退火30 s,72 ℃延伸45 s,共28個循環;72 ℃延伸5 min,4 ℃保存。
1.4.2 三引物巢式PCR
引物復篩過程與指紋圖譜構建則采用了三引物巢式PCR。三引物巢式PCR中的3條引物分別是常規反向引物、5’端帶有M13序列的正向引物和熒光標記的M13引物。反應體系25 μL,包括ddH2O 18 μL、10×Buffer緩沖液2.5 μL、Mg2+(25 mmol·L-1)1.5 μL、dNTP Mixture(25 mmol·L-1)0.25 μL;Taq酶(5 U·μL-1)0.25 μL、DNA模板(40 ng·μL-1)1 μL、上游引物(16 μmol·L-1)0.5 μL、下游引物(4 μmol·L-1)0.5 μL、FAM或HEX熒光M13引物(16 μmol·L-1)0.5 μL。三引物巢式PCR程序為:94 ℃預變性5 min,1個循環;94 ℃變性30 s,56 ℃退火45 s,72 ℃延伸45 s,共30個循環;94 ℃變性30 s,53 ℃退火45 s,72 ℃延伸45 s,共8個循環;72 ℃延伸10 min,4 ℃保存。
1.5 等位基因檢測
引物初篩采用6%非變性聚丙烯酰胺凝膠電泳對PCR產物進行檢測,恒定功率80 W[19]。三引物嵌套式PCR產物則采用基于熒光標記的DNA分析檢測儀,測定PCR產物片段大小[20]。
1.6 核心引物的確定、指紋圖譜的構建
在上述凝膠電泳檢測與熒光毛細管檢測技術的基礎上,根據條帶是否清晰可辨、多態性豐富程度、是否在9對染色體上均勻分布等原則,從945對引物中篩選出核心SSR引物,并在這些核心引物的基礎上構建48份青花菜品種構建指紋圖譜。指紋圖譜的構建采用“0,1”陣列模式[21]。
1.7 數據分析
利用Power Marker V3.25軟件計算多態性等位基因數量、基因型數目、引物多態性信息含量(PIC)與雜合率。
2 結果與分析
2.1 SSR核心引物篩選
引物初篩采用非變性聚丙烯酰胺凝膠電泳檢測,按照擴增條帶清晰易辨、等位基因數≥3、品種區分能力強、在染色體上分布均勻等標準,從945對SSR引物中共挑選出46對多態性豐富、帶型清晰的引物。按照5號染色體上的擴增位點設計的8對引物(P C5-1~P C5-8)對12份青花菜品種(依次為B1-B8、B10-B12、B16)進行PCR擴增的檢測,結果見圖1。

十二份青花菜品種依次為B1~B8、B10~B12、B16。
對上述篩出的46對引物進行三引物嵌套式PCR擴增,其擴增產物會帶上FAM或HEX熒光標記,可通過DNA分析儀對擴增產物的峰型和等位基因大小進行分析。如圖2所示,用熒光標記引物CB10234、Na12A02擴增12份青花菜品種,DNA分析結果表明,所測得12個品種均出現5種不同類型特征峰。FAM熒光標記引物CB10234對應第1種類型的峰值分別為140、148,第2種類型的峰值分別為148、154,第3種類型的峰值分別為140、154,第4種類型的峰值為138,第5種類型的峰值分別為138、148。HEX熒光標記引物Na12A02對應第1種類型的峰值分別為184、196,第2種類型的峰值分別為178、184,第3種類型的峰值分別為178、196,第4種類型的峰值分別為174、196,第5種類型的峰值為184。

圖2 引物CB10234(A)、Na12A02(B)在12份青花菜品種中檢測到的等位基因類型
按照峰型簡單、主峰明顯、主峰與次高峰相對位置穩定的篩選標準,最終從46對初篩引物中選擇出了20對核心SSR引物,具體信息見表2。
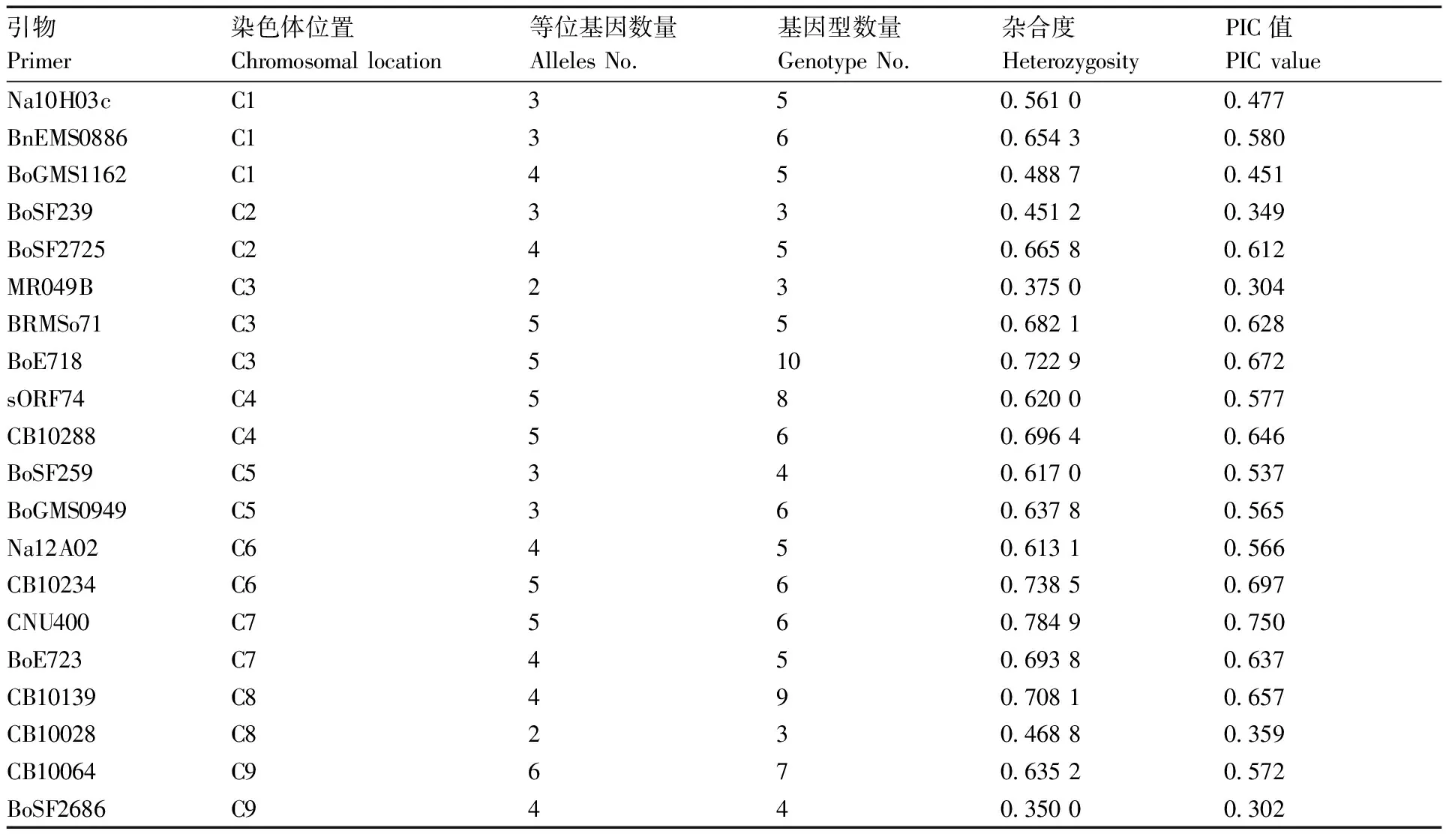
表2 二十對核心SSR引物多態性信息
2.2 SSR指紋圖譜的構建
根據20對引物在青花菜品種中的擴增情況,結合聚丙烯酰胺凝膠電泳與熒光標記的DNA分析,構建了48份青花菜栽培品種的DNA指紋圖譜。凝膠電泳(圖3)能夠較為直觀地顯示不同青花菜品種在某個擴增位點的擴增情況,但由于其分辨率較低,難以準確判斷出擴增條帶的大小,同時也難以區分條帶差異較小的片段,因而只作為DNA指紋圖譜的補充。圖4為基于20個擴增位點的熒光電泳分型結果構建得到的48份青花菜品種的DNA指紋圖譜。該圖譜以青花菜品種編號、擴增位點名稱和“0,1”陣列為基礎制作,其中,“0”代表在相應擴增位點無擴增條帶,“1”代為在相應擴增位點有擴增條帶,每個青花菜品種均有包含20個位點信息的指紋代碼,具有唯一性,每一個指紋代碼可作為一個品種的標識。
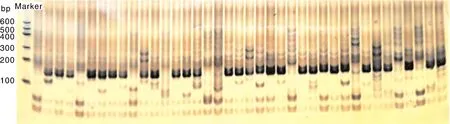
圖3 引物Na12A02對39份青花菜品種(依次為B1~B39)擴增的凝膠電泳圖

圖4 四十八份青花菜品種的DNA指紋圖譜
20對核心SSR引物構建的48份青花菜品種的指紋圖譜顯示:該套核心引物共檢測到等位基因79個,平均每條染色體上等位基因4.39個,平均每對引物擴增得到等位基因和基因型數量分別為3.95、5.55個。除了C3上的MR049B位點與C8上的CB10028位點僅有2個等位基因外,其余位點等位基因數量均大于或等于3;其中,等位基因數量最多的是位于C9染色體上的CB10064,共檢測到6個,而BRMS071、BoE718、sORF74、CB10288、CB10234、CNU400這6個位點的等位基因數均達到了5個。PIC介于0.302~0.750,平均為0.547。綜上信息表明,該套核心引物擴增效果好、多態性豐富,符合核心引物要求。
3 討論
DNA指紋技術在農作物品種鑒定領域具有無可替代的優勢與潛力,逐漸取代傳統的形態學鑒定法而成為品種鑒定方法的主流[22]。在眾多不同類型的分子標記中,SSR分子標記具有穩定性好、多態性高、共顯性遺傳等優勢,被國際植物品種權保護組織(International Union for the Protection of New Varieties of Plants,UPOV)分子測試指南推薦為品種鑒定與數據庫構建的兩種優選標記之一。SSR標記進行品種鑒定一般采用一套固定的核心位點組合[22],通過該套核心位點組合的擴增差異進行農作物品種的真實性或身份鑒定。核心引物的篩選和確定是構建指紋圖譜的重要環節,本研究借助凝膠電泳檢測平臺與熒光毛細管檢測平臺,篩選出的20對引物擴增條帶清晰、多態性豐富、在染色體上分布較均勻,通過特異標記及其組合可以有效鑒別市面上大多數青花菜品種的真實性。
優良的種子是保證優良品種遺傳特性得以穩定發揮的基礎,因此明確品種的真實性是確保優良品種的關鍵,該圖譜可作為青花菜品種鑒定和分類的依據,對青花菜品種真實性的快速、高效、準確鑒定具有重要意義。在構建指紋圖譜的方法中,采用“0,1”格式的DNA指紋圖譜[21]:以青花菜品種編號、擴增位點名稱,以及“0”“1”陣列為基礎制得。該方式構建的指紋圖譜不僅清晰直觀,更重要的是可以利用存儲軟件(如Excel)的搜索功能對圖譜庫中的指紋數據進行快速搜索,能夠在短時間內從大量的指紋數據中找到目標數據或對目標數據進行對比。
青花菜品種的真實性鑒定可采用2種方法:DNA指紋圖譜法或對照品種比對法[22]。DNA指紋圖譜法是將待鑒定品種的DNA指紋信息數據與48份青花菜品種的DNA指紋圖譜進行比對,若待鑒定品種的DNA指紋信息數據與青花菜DNA指紋圖譜庫中的某個品種信息一致,則可判斷待鑒定品種與指紋圖譜庫中的該品種為同一品種;若待鑒定品種的DNA指紋信息數據與青花菜DNA指紋圖譜庫中的48份指紋信息均不一致,則可判斷待鑒定品種不屬于48份青花菜品種中的任一品種。而對照品種比對法則是利用核心SSR引物組合分別擴增待鑒定品種與對照品種,獲得相應的DNA指紋信息數據,并將兩者的DNA指紋信息數據進行比較,若兩者的指紋信息數據相同,則可判定待鑒定品種與對照品種為相同品種;若兩者的指紋信息數據不同,則判定待鑒定品種與對照品種為不同品種。基于SSR分子標記技術的真實性鑒定法在48 h內即可完成青花菜品種鑒定工作,與傳統的田間種植鑒定法相比有極大的技術優勢。此外,基于此指紋圖譜的遺傳分析,可以為青花菜品種的譜系研究、分子育種等提供參考信息。

