胰腺實(shí)性假乳頭狀瘤與無(wú)功能性神經(jīng)內(nèi)分泌腫瘤磁共振成像預(yù)測(cè)模型的建立
劉芳 朱蒙蒙 王鐵功 曹凱 孟英豪 邊云 王莉 陸建平 邵成偉
海軍軍醫(yī)大學(xué)第一附屬醫(yī)院放射診斷科,上海 200433
胰腺實(shí)性假乳頭狀瘤(solid pseudopapillary tumors of pancreas, SPTs)是一種少見的低度惡性腫瘤,占胰腺原發(fā)腫瘤的1%~2%,近年來(lái)隨著影像檢查手段的進(jìn)步及普及,其發(fā)病率有所增加[1-2]。SPTs可通過(guò)剜除等局部治療手段治愈[3],預(yù)后良好。胰腺神經(jīng)內(nèi)分泌腫瘤(pancreatic neuroendocrine tumors, PNETs)占胰腺腫瘤的2%~10%,預(yù)后較SPTs差,且大多數(shù)為無(wú)功能性腫瘤,根治性切除術(shù)是治愈PNETs的唯一潛在的方法[4],同時(shí)根據(jù)腫瘤的組織學(xué)分級(jí),術(shù)后需要對(duì)部分患者進(jìn)行靶向治療、化療或放療等[5-7]。由于兩者的治療方法及預(yù)后不同,因此術(shù)前精確診斷具有重要的臨床價(jià)值。MRI由于其高分辨率及無(wú)輻射等優(yōu)點(diǎn),已成為胰腺疾病診斷的主要檢查手段[8-9],但是SPTs與PNETs的部分MRI表現(xiàn)重疊,鑒別存在困難。本研究旨在建立鑒別SPTs和PNETs的預(yù)測(cè)模型,以期提高術(shù)前診斷準(zhǔn)確率及提供預(yù)后信息。
資料與方法
一、一般資料
連續(xù)性收集2013年1月至2020年12月間海軍軍醫(yī)大學(xué)第一附屬醫(yī)院行胰腺腫瘤手術(shù)切除并經(jīng)術(shù)后病理證實(shí)為SPTs的142例(SPTs組)及PNETs的137例(PNETs組)患者的臨床及影像學(xué)資料。所有患者均在手術(shù)前1個(gè)月內(nèi)行MRI增強(qiáng)掃描。排除標(biāo)準(zhǔn):(1)術(shù)前行放療、化療者;(2)MRI資料不全;(3)圖像質(zhì)量差,難以診斷。該研究已通過(guò)醫(yī)院倫理委員會(huì)批準(zhǔn)。
依據(jù)國(guó)際預(yù)測(cè)模型建模共識(shí)[10],按照納入的時(shí)間順序,將2013年1月至2018年12月間106例SPTs和100例PNETs患者歸入訓(xùn)練集,2019年1月至2020年12月間36例SPTs和37例PNETs患者歸入驗(yàn)證集。
二、MRI掃描方法
患者檢查前均禁食禁水4 h。MRI設(shè)備采用美國(guó)GE公司Signa HDxt 3.0 T、美國(guó)GE公司Discovery 750 3.0 T掃描儀和8通道體部線圈。掃描序列:(1)橫斷面呼吸觸發(fā)脂肪抑制快速自旋回波T2WI序列。重復(fù)時(shí)間(repetition time, TR) 6 316 ms,回波時(shí)間(echo time, TE)85 ms,矩陣224×320,視野440 mm×440 mm,層數(shù)20,層厚5 mm,層間距1 mm。(2)肝臟快速容積成像(liver acquisition with volume acceleration,LAVA)T1WI序列。TR 2.58 ms,TE 1.18 ms,矩陣224×320,無(wú)層間距,層厚5 mm,視野440 mm×440 mm。增強(qiáng)掃描采用高壓注射器以2.0 ml/s的流率經(jīng)前臂靜脈注入對(duì)比劑釓噴替酸葡甲胺(Gd-DTPA) 0.2 ml/kg,注射結(jié)束后用20 ml生理鹽水以同樣流率沖洗。分別于注射對(duì)比劑后15、20、40 s行動(dòng)脈期、門靜脈期、延遲期掃描。
三、圖像分析
由兩位經(jīng)驗(yàn)豐富的放射診斷科醫(yī)師獨(dú)立閱片觀察,記錄一致的觀察結(jié)果,意見不一致時(shí)經(jīng)過(guò)協(xié)商達(dá)成共識(shí)。觀察指標(biāo)為腫瘤位置,病灶大小、形狀、邊界,有無(wú)囊變,T1WI信號(hào)、T2WI信號(hào),強(qiáng)化方式、強(qiáng)化峰值期相、峰值期強(qiáng)化程度,胰膽管是否擴(kuò)張、胰腺有無(wú)萎縮以及有無(wú)周圍血管、器官侵犯。T1WI內(nèi)有高信號(hào)代表腫瘤內(nèi)出血;病灶內(nèi)觀察到T2WI水樣高信號(hào),增強(qiáng)后無(wú)明顯強(qiáng)化判定為腫瘤囊變;胰管直徑≥3 mm或膽總管直徑≥10 mm定義為胰膽管擴(kuò)張;病灶與血管、器官分界不清視為侵犯血管與器官。所有病灶經(jīng)手術(shù)切除后送病理檢查,由兩名經(jīng)驗(yàn)豐富的病理科醫(yī)師單獨(dú)盲法閱片,診斷意見不同時(shí)經(jīng)過(guò)協(xié)商達(dá)成一致。
四、統(tǒng)計(jì)學(xué)處理
結(jié) 果
一、兩組患者的臨床及MRI影像特征
SPTs組與PNETs組患者的臨床及MRI影像特征分析見表1。訓(xùn)練集SPTs組與PNETs組間年齡、性別、腫瘤大小、腫瘤形狀、囊變、T1WI信號(hào)、T2WI信號(hào)、強(qiáng)化峰值期相、峰值期強(qiáng)化程度、強(qiáng)化方式、侵犯鄰近器官差異均有統(tǒng)計(jì)學(xué)意義(P值均<0.05),其余特征差異均無(wú)統(tǒng)計(jì)學(xué)意義。驗(yàn)證集SPTs組與PNETs組年齡、腫瘤形狀、囊變、T1WI信號(hào)、T2WI信號(hào)、強(qiáng)化峰值期相、峰值期強(qiáng)化程度、強(qiáng)化方式差異均有統(tǒng)計(jì)學(xué)意義(P值均<0.05),其余特征差異無(wú)統(tǒng)計(jì)學(xué)意義。
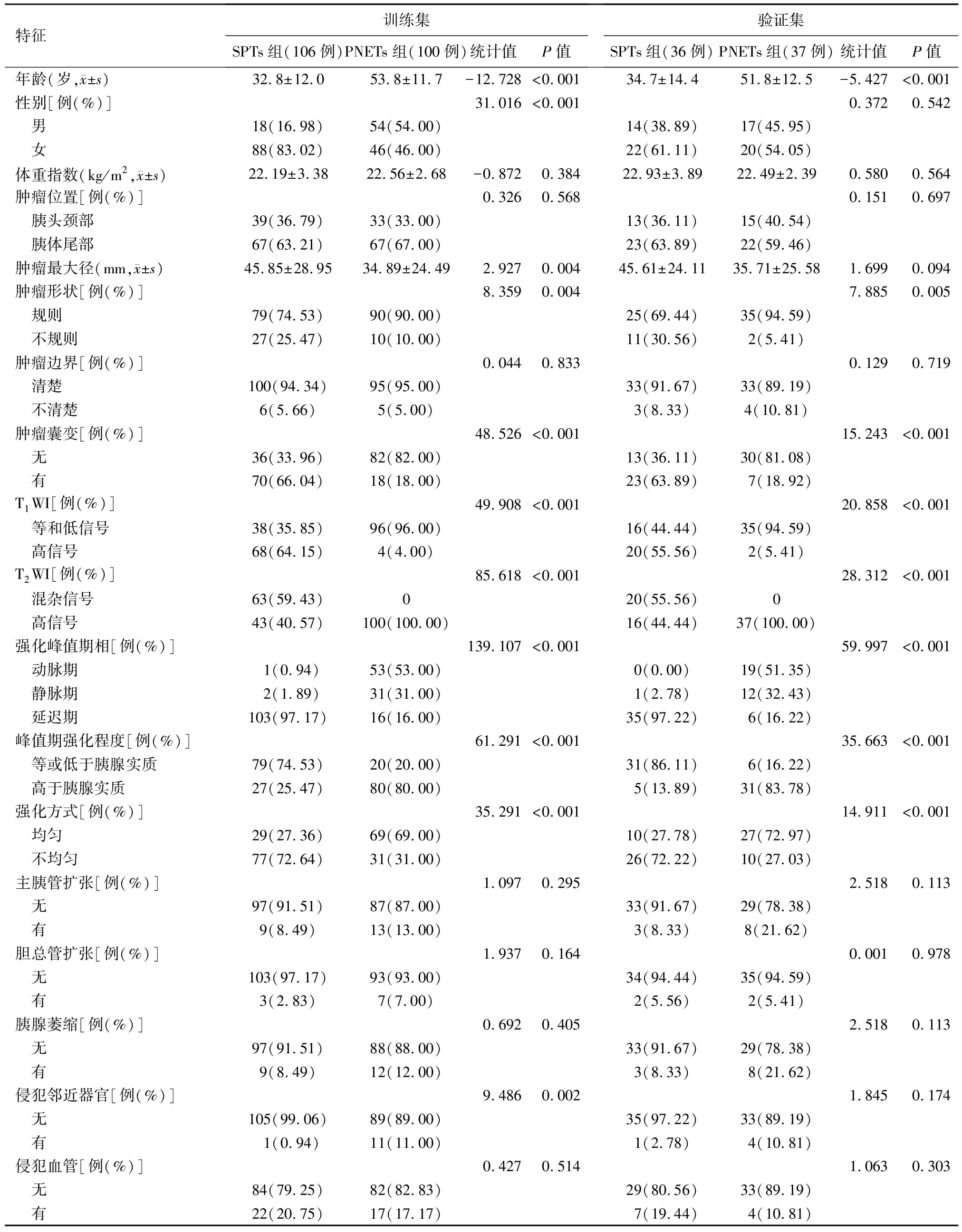
表1 142例胰腺實(shí)性假乳頭狀瘤患者與137例胰腺神經(jīng)內(nèi)分泌腫瘤患者臨床及MRI影像特征比較
二、兩組患者臨床及MRI影像特征的單因素回歸分析
單因素分析結(jié)果顯示(表2),訓(xùn)練集SPTs組與PNETs組的年齡、性別、腫瘤大小、腫瘤形狀、是否囊變、T1WI信號(hào)、強(qiáng)化峰值期相、峰值期強(qiáng)化程度、強(qiáng)化方式、侵犯鄰近器官差異均有統(tǒng)計(jì)學(xué)意義(P值均<0.05)。驗(yàn)證集的年齡、形狀、囊變、T1WI信號(hào)、峰值期相強(qiáng)化程度、強(qiáng)化方式差異有統(tǒng)計(jì)學(xué)意義(P值均<0.05)。
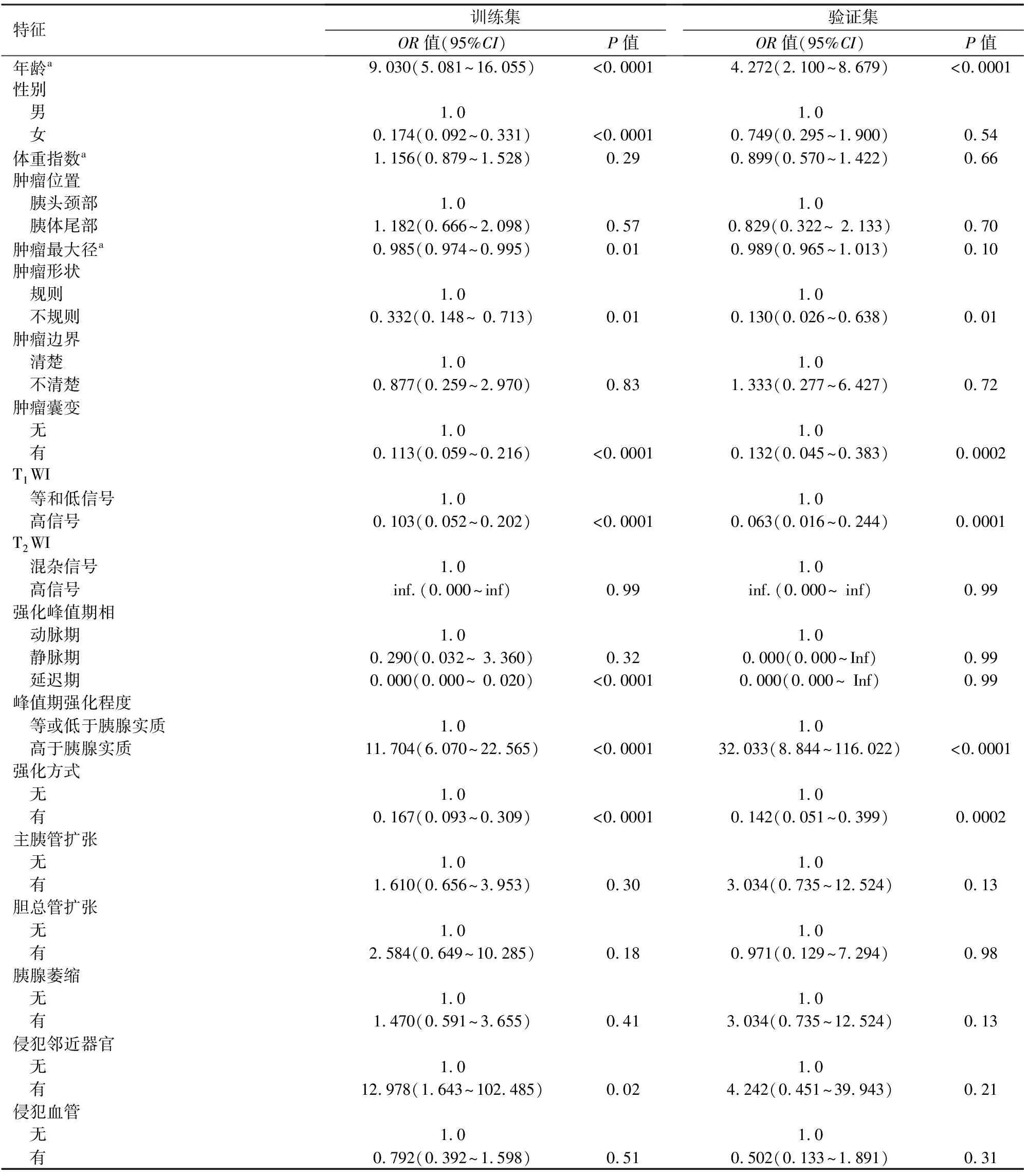
表2 142例胰腺實(shí)性假乳頭狀瘤患者與137例胰腺神經(jīng)內(nèi)分泌腫瘤患者臨床及MRI影像特征的單因素回歸分析
三、預(yù)測(cè)模型的建立及診斷效能
將上述訓(xùn)練集中單因素回歸分析具有統(tǒng)計(jì)學(xué)意義的10個(gè)因素(年齡、性別、腫瘤大小、腫瘤形狀、囊變、T1WI信號(hào)、強(qiáng)化峰值期相、峰值期強(qiáng)化程度、強(qiáng)化方式、侵犯鄰近器官)進(jìn)一步納入多因素回歸分析,結(jié)果顯示,年齡、性別、腫瘤大小、T1WI信號(hào)、峰值期強(qiáng)化程度、強(qiáng)化峰值期相是6個(gè)預(yù)測(cè)SPTs與PNETs的獨(dú)立因素(表3),即年齡越大、男性患者、腫瘤體積越小、T1WI不含高信號(hào)、強(qiáng)化峰值期相位于動(dòng)脈期或靜脈期、峰值期強(qiáng)化程度高于胰腺實(shí)質(zhì)者更傾向于PNETs。利用這6個(gè)因素建立預(yù)測(cè)模型,預(yù)測(cè)PNETs概率的公式為:4.31+1.13×年齡+1.31×腫瘤大小-1.29×女性-4.18×T1WI呈高信號(hào)+1.28×強(qiáng)化高于胰腺實(shí)質(zhì)-4.69×延遲期強(qiáng)化。
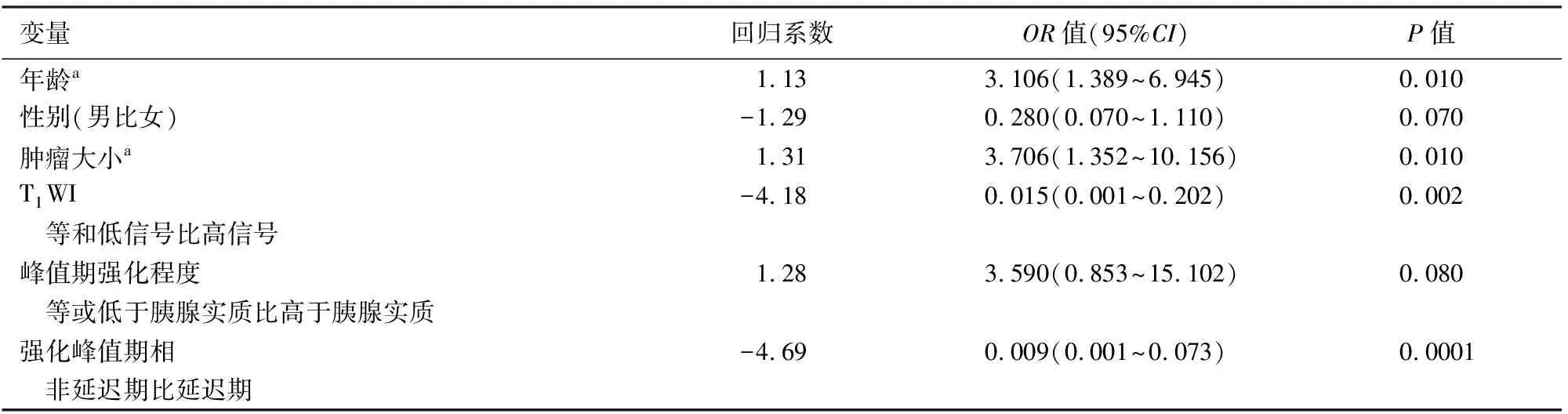
表3 142例胰腺實(shí)性假乳頭狀瘤患者與137例胰腺神經(jīng)內(nèi)分泌腫瘤患者臨床及MRI影像特征的多因素回歸分析
將預(yù)測(cè)模型可視化為列線圖(圖1)。列線圖在訓(xùn)練集和驗(yàn)證集的AUC值分別為0.99(95%CI0.977~1.000)、0.97(95%CI0.926~1.000)(圖2);在訓(xùn)練集的靈敏度、特異度、準(zhǔn)確率分別為98.00%、94.34%、96.12%;在驗(yàn)證集的靈敏度、特異度、準(zhǔn)確率分別為86.49%、97.22%、91.78%,提示預(yù)測(cè)模型對(duì)SPTs和PNETs的鑒別具有良好的診斷效能。
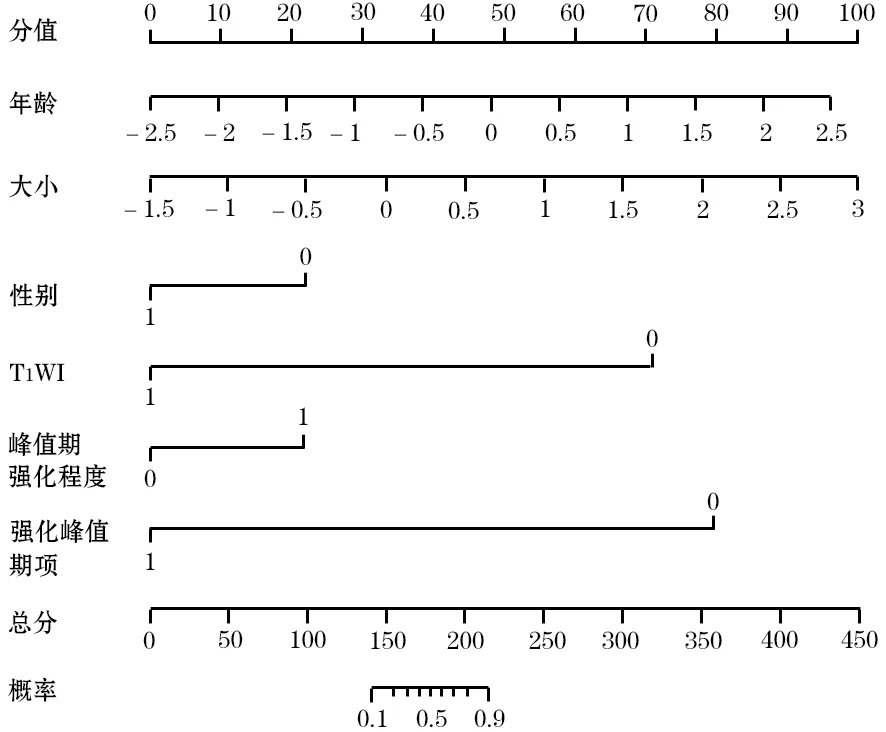
圖1 胰腺實(shí)性假乳頭狀瘤與胰腺神經(jīng)內(nèi)分泌腫瘤診斷列線圖
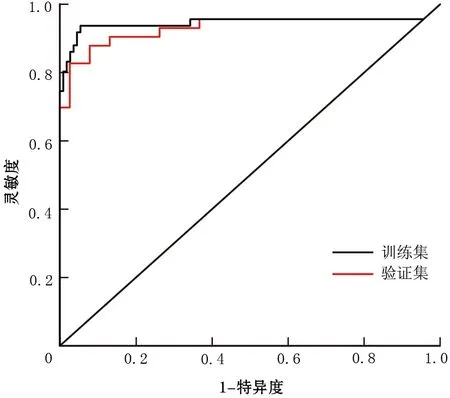
圖2 列線圖在訓(xùn)練集與驗(yàn)證集中的ROC曲線
四、預(yù)測(cè)模型的臨床應(yīng)用
為評(píng)估預(yù)測(cè)模型的實(shí)際臨床應(yīng)用效果,繪制預(yù)測(cè)SPTs和PNETs的臨床決策曲線(圖3),當(dāng)列線圖鑒別兩類疾病的閾值>0.05時(shí),列線圖較“所有的患者視為PNETs治療”方案或“所有患者視為SPTs治療”方案獲得更多的凈收益,即給患者帶來(lái)更多的臨床獲益。圖4為臨床實(shí)際應(yīng)用中的2個(gè)病例,利用預(yù)測(cè)模型可以準(zhǔn)確診斷SPTs和PNETs。
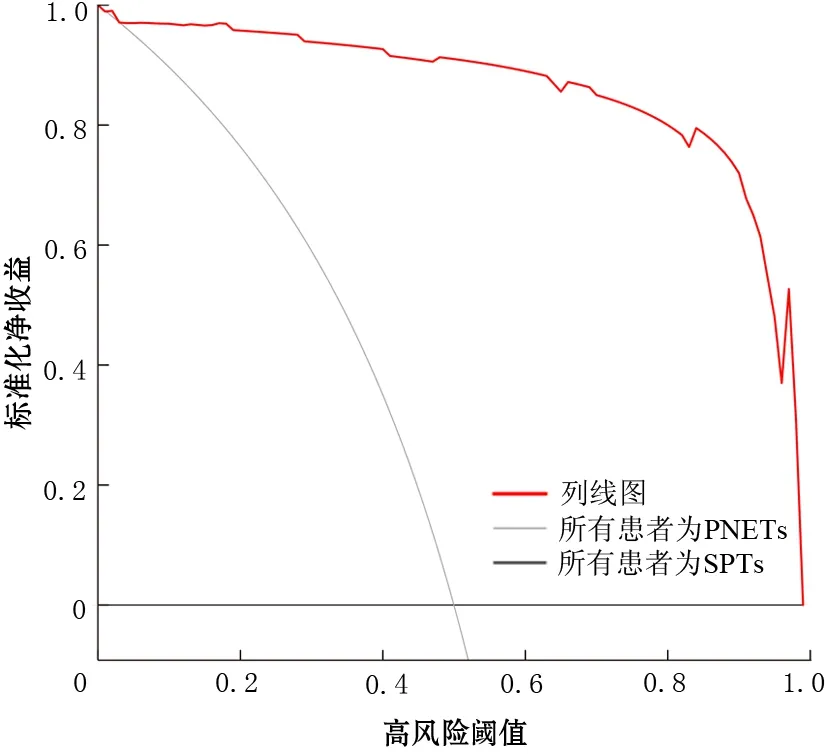
注:PNETs為胰腺神經(jīng)內(nèi)分泌腫瘤;SPTs為胰腺實(shí)性假乳頭狀瘤圖3 鑒別胰腺實(shí)性假乳頭狀瘤和神經(jīng)內(nèi)分泌腫瘤的列線圖決策曲線
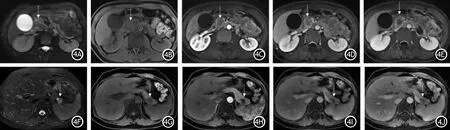
圖4 胰腺神經(jīng)內(nèi)分泌腫瘤與胰腺實(shí)性假乳頭狀瘤患者的MRI表現(xiàn)。橫斷面脂肪抑制T2WI示胰頭部一枚稍高信號(hào)影(↑),病灶長(zhǎng)徑約24.65 mm(4A),橫斷面脂肪抑制T1WI示腫塊呈低信號(hào)(↑,4B),橫斷面增強(qiáng)示腫塊呈輕度強(qiáng)化,強(qiáng)化峰值位于門靜脈期,峰值強(qiáng)化程度低于正常胰腺實(shí)質(zhì)(4C~4E),根據(jù)列線圖診斷為神經(jīng)內(nèi)分泌腫瘤的概率約0.8;橫斷面脂肪抑制T2WI示胰尾部一結(jié)節(jié)狀混雜高信號(hào)影(↑),病灶長(zhǎng)徑約24.80 mm(4F),橫斷面脂肪抑制T1WI示腫塊呈低信號(hào)(↑,4G),橫斷面增強(qiáng)示腫塊呈漸進(jìn)性強(qiáng)化,強(qiáng)化峰值位于延遲期,峰值強(qiáng)化程度低于正常胰腺實(shí)質(zhì)(4H~4J),根據(jù)列線圖診斷為實(shí)性假乳頭狀瘤的概率>0.9
討 論
SPTs與PNETs均為胰腺少見腫瘤,近年來(lái)隨著影像檢查技術(shù)的發(fā)展與普及,兩者的發(fā)生率也逐漸增多,且常常為偶然發(fā)現(xiàn),無(wú)明顯臨床癥狀,兩者的影像表現(xiàn)具有一定的重疊[8]。以往研究表明,SPTs常見于年輕女性,病灶內(nèi)常發(fā)生出血,增強(qiáng)后呈漸進(jìn)性延遲輕度強(qiáng)化[11-14]。本研究結(jié)果與文獻(xiàn)一致,訓(xùn)練集的SPTs患者平均年齡為33歲,其中高達(dá)83.02%(88/106)患者是女性,64.15%(68/108)患者病灶內(nèi)可觀察到T1WI高信號(hào)(出血),97.17%(103/106)患者病灶強(qiáng)化峰值位于胰腺延遲期,74.54%(89/106)患者病灶強(qiáng)化程度弱于正常胰腺實(shí)質(zhì)。PNETs通常血供豐富,增強(qiáng)后常明顯強(qiáng)化,強(qiáng)化峰值以動(dòng)脈期或門靜脈期為著[15-16],本研究結(jié)果與之相似,訓(xùn)練集80%(80/100)病灶明顯強(qiáng)化,53%(53/100)強(qiáng)化峰值位于動(dòng)脈期,31%(31/100)強(qiáng)化峰值位于靜脈期。PNETs具有一定侵襲性,本研究11%(11/100)患者病灶侵犯鄰近器官。SPTs因侵襲性低,完整的手術(shù)切除可達(dá)到根治性目的[17-18],而PNETs術(shù)后常需要進(jìn)行輔助性放化療或靶向治療[19]。因此術(shù)前精確診斷對(duì)于臨床治療的選擇及指導(dǎo)具有重要意義。
術(shù)前影像學(xué)評(píng)估方法較多,但各有利弊。超聲內(nèi)鏡引導(dǎo)下細(xì)針穿刺術(shù)(endoscopic ultrasonography-guided fine-needle aspiration,EUS-FNA)雖然可獲得病灶的組織學(xué)標(biāo)本進(jìn)行病理診斷,但是該檢查有創(chuàng)、昂貴,可能產(chǎn)生一系列嚴(yán)重的并發(fā)癥,且靈敏度并不高,因此在臨床上的應(yīng)用有限[20]。CT、MRI是胰腺病變術(shù)前診斷及無(wú)創(chuàng)評(píng)估的主要影像手段。然而,CT具有輻射,且對(duì)病灶內(nèi)成分的判定價(jià)值有限,對(duì)于病灶出血、囊變的評(píng)估不夠敏感。MRI由于其軟組織分辨率高,多參數(shù)成像,且無(wú)輻射,對(duì)于出血、囊變等病變的檢測(cè)較敏感,因此對(duì)于兩者的評(píng)估更優(yōu)。
雖然已有SPTs與PNETs影像鑒別的相關(guān)研究,但結(jié)果有一定的局限性,對(duì)于兩者鑒別仍有一定困難。Wang等[21]利用CT圖像特征鑒別SPTs與弱強(qiáng)化的PNETs,通過(guò)多因素分析發(fā)現(xiàn),年輕患者、病灶內(nèi)出現(xiàn)“浮云征”、鈣化是SPTs的獨(dú)立預(yù)測(cè)因素,3個(gè)因素聯(lián)合診斷的AUC值為0.865。但該研究樣本量小,沒(méi)有對(duì)建立的模型進(jìn)行驗(yàn)證。Liu等[22]通過(guò)分析147例PNETs和21例SPTs的超聲內(nèi)鏡圖像,發(fā)現(xiàn)PNETs回聲均勻、呈富血供。然而,EUS檢查有創(chuàng),依賴于操作者的水平,并不作為兩類疾病診斷的首選檢查方式。Li等[23]利用MRI組學(xué)分析數(shù)據(jù)來(lái)鑒別SPTs與PNETs,但沒(méi)有納入常規(guī)的影像學(xué)特征,由于影像組學(xué)特征不穩(wěn)定,且缺乏外部驗(yàn)證,使得該模型的臨床應(yīng)用有限。
本研究共收集142例SPTs、137例PNETs患者的臨床及MRI數(shù)據(jù),樣本量高于以往的研究。利用患者常規(guī)臨床及MRI的6個(gè)特征(年齡、性別、病灶大小、T1WI有無(wú)高信號(hào)、強(qiáng)化峰值期相、峰值期強(qiáng)化是否高于胰腺實(shí)質(zhì))建立的預(yù)測(cè)模型,表現(xiàn)出較好的預(yù)測(cè)能力,且診斷靈敏度、特異度、準(zhǔn)確率均較高,并進(jìn)一步利用決策曲線,滿足臨床決策的實(shí)際需要。
本研究具有以下局限性:(1)回顧性研究,可能存在選擇偏倚;(2)診斷模型缺乏外部驗(yàn)證;(3)未納入與疾病相關(guān)的實(shí)驗(yàn)室檢查指標(biāo),如神經(jīng)元特異性烯醇化、嗜鉻素A、突觸素等;(4)納入的樣本均是術(shù)后病理證實(shí)的病例,術(shù)前穿刺病理證實(shí)的并未納入,導(dǎo)致病例數(shù)減少。未來(lái),本課題組將開展前瞻性多中心的研究,擴(kuò)大樣本量,增加新的模型算法,使研究模型可以進(jìn)一步推廣。
利益沖突所有作者均聲明不存在利益沖突
- 中華胰腺病雜志的其它文章
- 基于CT影像特征用于鑒別具有慢性胰腺炎病史的胰腺癌與腫塊型慢性胰腺炎的列線圖構(gòu)建
- 單源雙能CT掃描技術(shù)在改善胰腺圖像質(zhì)量中的應(yīng)用價(jià)值
- 胰腺導(dǎo)管內(nèi)乳頭狀黏液性腫瘤MRI影像特征及惡變風(fēng)險(xiǎn)預(yù)測(cè)模型建立
- 局限性自身免疫性胰腺炎與胰腺導(dǎo)管腺癌CT影像特征列線圖模型構(gòu)建
- 多排螺旋CT動(dòng)脈期影像組學(xué)分值與胰頭癌腸系膜上靜脈切緣的關(guān)系
- 自動(dòng)定量CT影像上腫瘤3D體積術(shù)前預(yù)測(cè)可切除性胰腺癌總體生存期的隊(duì)列研究

