胰腺導(dǎo)管內(nèi)乳頭狀黏液性腫瘤MRI影像特征及惡變風(fēng)險預(yù)測模型建立
方旭 李晶 王鐵功 李娜 孟英豪 馮小晨 邊云 邵成偉 陸建平 王莉
海軍軍醫(yī)大學(xué)第一附屬醫(yī)院放射診斷科,上海 200433
隨著影像學(xué)技術(shù)的發(fā)展和廣泛應(yīng)用,胰腺囊性腫瘤的檢出率逐漸增高。胰腺導(dǎo)管內(nèi)乳頭狀黏液性腫瘤(intraductal papillary mucinous neoplasm, IPMN)是最常見的胰腺囊性腫瘤,屬于胰腺癌的癌前病變[1-2]。在手術(shù)治療的IPMN患者中,主胰管型及混合胰管型的惡變率為38%~68%,分支胰管型為12%~47%[3]。2017版國際共識指南(international consensus guidelines, ICG)將胰頭部IPMN導(dǎo)致梗阻性黃疸、強(qiáng)化壁結(jié)節(jié)≥5 mm、主胰管內(nèi)徑≥10 mm定義為IPMN惡變的高危征象和外科手術(shù)的絕對適應(yīng)證;將胰腺炎病史、囊腫≥3 cm、囊壁增厚、強(qiáng)化壁結(jié)節(jié)<5 mm、主胰管內(nèi)徑5~9 mm、主胰管管徑突然改變伴遠(yuǎn)端胰腺萎縮、淋巴結(jié)腫大、CA19-9升高、囊腫增長率≥5 mm/2年作為IPMN惡變的危險征象和外科手術(shù)的相對適應(yīng)證[4]。因此影像學(xué)評估IPMN惡變征象對手術(shù)干預(yù)的時機(jī)具有重要價值。然而,單個征象在預(yù)測惡變時均存在一定局限性,容易導(dǎo)致病變的過診或漏診[5]。既往多項研究報道所建立的IPMN惡變預(yù)測模型具有良好的預(yù)測能力[6-12],但大多數(shù)預(yù)測模型包含穿刺行囊液分析等有創(chuàng)操作,或僅適用于某一種類型的IPMN,目前尚缺少一種無創(chuàng)、同時適用于所有類型IPMN的MRI預(yù)測模型。本課題組前期研究已建立基于CT影像特征的IPMN惡變的預(yù)測模型,具有較好的預(yù)測效能和臨床獲益[13]。本研究基于MRI影像特征建立預(yù)測模型并進(jìn)行驗證,旨在評估MRI影像特征列線圖預(yù)測IPMN惡變的臨床價值。
資料與方法
一、一般資料
回顧性分析2012年10月至2020年4月間海軍軍醫(yī)大學(xué)第一附屬醫(yī)院260例術(shù)前經(jīng)MRI檢查且術(shù)后病理確診的IPMN患者的臨床資料。排除標(biāo)準(zhǔn):(1)同時伴發(fā)非IPMN起源的PDAC以及合并胰腺其他腫瘤的患者;(2)術(shù)前接受放、化療的患者;(3)MRI圖像無法清晰顯示IPMN病灶的患者。收集的信息主要包括性別、年齡、體重指數(shù)、有無梗阻性黃疸、有無胰腺炎病史、手術(shù)方式等。根據(jù)2019版WHO IPMN病理學(xué)級別定義[14]將患者分為非惡變組(低度異型增生)和惡變組(重度異型增生、浸潤癌)。根據(jù)國際預(yù)測模型建模共識[15],將患者依據(jù)時間順序分為訓(xùn)練集和驗證集,其中2012年10月至2019年4月共193例(非惡變組117例、惡變組76例)患者作為訓(xùn)練集,2019年5月至2020年4月共67例(非惡變組40例、惡變組27例)患者作為驗證集。本研究通過醫(yī)院倫理委員會審核批準(zhǔn)。
二、影像學(xué)檢查方法
患者檢查前均禁食禁水4 h。MRI設(shè)備為美國GE公司Signa HDxt 3.0 T、美國GE公司Discovery 750 3.0 T掃描儀和8通道體部線圈。掃描序列:(1)橫斷面呼吸觸發(fā)脂肪抑制快速自旋回波T2WI序列。重復(fù)時間(time of repetition, TR)6 316 ms,回波時間(time of echo, TE)85 ms,層數(shù)20,層厚5 mm,層間距1 mm,視野440 mm×440 mm,矩陣224×320。(2)肝臟快速容積成像(liver acquisition with volume acceleration,LAVA)T1WI序列。TR 2.58 ms,TE 1.18 ms,層厚5 mm,無層間距,視野440 mm×440 mm,矩陣224×320。增強(qiáng)掃描采用高壓注射器以2.0 ml/s的流率經(jīng)前臂靜脈注入對比劑釓噴替酸葡甲胺(Gd-DTPA)0.2 ml/kg,注射結(jié)束后用20 ml生理鹽水以同樣流率沖洗。分別在注射對比劑后15、20、40 s行動脈期、門靜脈期、延遲期掃描。
三、圖像分析
由2名高年資影像科醫(yī)師明確疾病為IPMN但對患者其他臨床和病理學(xué)信息不知情的情況下共同進(jìn)行閱片,結(jié)果不一致時互相協(xié)商達(dá)成一致意見。依據(jù)2017版ICG中IPMN影像學(xué)評估標(biāo)準(zhǔn)分析患者的MRI表現(xiàn),包括IPMN類型、囊腫部位、囊腫大小、囊壁是否增厚、有無壁結(jié)節(jié)及壁結(jié)節(jié)大小、主胰管內(nèi)徑、有無主胰管管徑突然改變伴遠(yuǎn)端胰腺萎縮、淋巴結(jié)是否腫大等。其中囊壁增厚定義為厚度≥2 mm[16];壁結(jié)節(jié)定義為囊壁或擴(kuò)張胰管壁上強(qiáng)化的實性成分;胰腺萎縮定義為同一位置的主胰管內(nèi)徑與胰腺實質(zhì)厚度比>0.5[17];淋巴結(jié)腫大定義為T1WI增強(qiáng)門靜脈期最大短徑≥10 mm。所有測量數(shù)量均以橫斷面最大徑為標(biāo)準(zhǔn)。
四、統(tǒng)計學(xué)處理
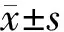
結(jié) 果
一、臨床資料
訓(xùn)練集和驗證集非惡變組與惡變組的IPMN類型、囊腫大小、囊壁增厚、壁結(jié)節(jié)大小、主胰管內(nèi)徑、主胰管管徑突然改變伴遠(yuǎn)端胰腺萎縮的差異均有統(tǒng)計學(xué)意義,訓(xùn)練集非惡變組與惡變組的黃疸、淋巴結(jié)腫大的差異有統(tǒng)計學(xué)意義,其余臨床特征和MRI表現(xiàn)差異均無統(tǒng)計學(xué)意義(表1)。

表1 260例胰腺導(dǎo)管內(nèi)乳頭狀黏液性腫瘤患者一般資料
二、預(yù)測模型的構(gòu)建
多因素logistic逐步回歸分析顯示,黃疸、囊腫大小、壁結(jié)節(jié)≥5 mm、主胰管管徑突然改變伴遠(yuǎn)端胰腺萎縮的差異有統(tǒng)計學(xué)意義(表2),是預(yù)測IPMN惡變的獨立危險因素。據(jù)此建立的預(yù)測IPMN惡變的模型為-0.35+2.28×黃疸+1.57×壁結(jié)節(jié)≥5 mm+2.92×主胰管管徑突然改變伴遠(yuǎn)端胰腺萎縮-1.95×囊腫<3 cm-1.05×囊腫≥3 cm。可視化列線圖見圖3。

表2 胰腺導(dǎo)管內(nèi)乳頭狀黏液性腫瘤惡變風(fēng)險因素多變量分析
三、預(yù)測模型在訓(xùn)練集和驗證集中的預(yù)測效能
訓(xùn)練集和驗證集的預(yù)測模型列線圖的ROC曲線見圖2,訓(xùn)練集的AUC值為0.85(95%CI0.79~0.91),靈敏度、特異度和準(zhǔn)確率分別為72.37%、85.47%和80.31%;驗證集的AUC值為0.84(95%CI0.74~0.94),靈敏度、特異度和準(zhǔn)確率分別為81.48%、75.00%和77.61%。

圖1 基于胰腺導(dǎo)管內(nèi)乳頭狀黏液性腫瘤MRI特征的列線圖

圖2 訓(xùn)練集和驗證集的ROC曲線
四、臨床決策曲線分析
繪制列線圖預(yù)測IPMN惡變的決策曲線(圖3)。臨床決策曲線分析表明,當(dāng)列線圖鑒別IPMN惡變的概率>0.16時使用列線圖診斷IPMN,比將“所有患者視為惡變治療”方案或?qū)ⅰ八谢颊咭暈榉菒鹤冎委煛狈桨父茏尰颊攉@益。

圖3 列線圖預(yù)測胰腺導(dǎo)管內(nèi)乳頭狀黏液性腫瘤惡性的決策曲線
討 論
既往研究結(jié)果顯示,黃疸、壁結(jié)節(jié)大小、囊腫大小、主胰管內(nèi)徑是預(yù)測IPMN惡變模型的常用獨立預(yù)測因素[6-12],其中黃疸、壁結(jié)節(jié)≥5 mm是2017版ICG中IPMN惡變的高危征象和外科手術(shù)的絕對適應(yīng)證。雖然主胰管管徑突然改變伴遠(yuǎn)端胰腺萎縮是IPMN惡變的重要征象[18-19],但既往研究很少將其納入到預(yù)測模型。
本研究多因素分析結(jié)果發(fā)現(xiàn),黃疸、壁結(jié)節(jié)≥5 mm、主胰管管徑突然改變伴遠(yuǎn)端胰腺萎縮、囊腫大小均與IPMN惡變顯著相關(guān),因此,建立的對IPMN惡變的預(yù)測模型包含黃疸、壁結(jié)節(jié)≥5mm、主胰管管徑突然改變伴遠(yuǎn)端胰腺萎縮、囊腫大小4項獨立因素。該模型是基于MRI影像特征的無創(chuàng)評估模型,對IPMN的惡變表現(xiàn)出良好的預(yù)測能力(訓(xùn)練集AUC=0.85,驗證集AUC=0.84)。
本研究建立的預(yù)測模型納入主胰管管徑突然改變伴遠(yuǎn)端胰腺萎縮,預(yù)測IPMN惡變的OR值高達(dá)18.53,其機(jī)制是由于IPMN伴高度異型增生或浸潤癌的生物學(xué)特征與胰腺導(dǎo)管腺癌的常規(guī)表現(xiàn)類似,腫瘤阻塞并且侵犯主胰管,造成主胰管狹窄,甚至截斷,導(dǎo)致上游主胰管擴(kuò)張,長期胰管高壓引起胰管破裂,胰液外滲導(dǎo)致胰腺炎,反復(fù)發(fā)作致使胰管周圍胰腺組織萎縮,影像學(xué)即表現(xiàn)為腫瘤遠(yuǎn)端的胰腺萎縮。然而,2017版ICG中高危征象之一的主胰管內(nèi)徑≥10 mm在本研究中并未作為獨立預(yù)測因素進(jìn)入預(yù)測模型,可能是由于訓(xùn)練集惡變組的主胰管內(nèi)徑≥10 mm患者僅占40.79%,另有學(xué)者研究得出主胰管內(nèi)徑5~7mm是IPMN惡變的最佳閾值[20-21],表明將主胰管內(nèi)徑≥10 mm作為IPMN惡變高危征象會存在漏診的可能性。
為了克服單因素分析評估IPMN惡變的局限性,近年來基于列線圖的預(yù)測模型在評估IPMN惡變中也取得了很多進(jìn)展。Shimizu等[6,8]分別在2010年和2015年構(gòu)建了列線圖預(yù)測模型,預(yù)測因素包括性別、IPMN類型、壁結(jié)節(jié)大小、細(xì)胞學(xué)分析;隨后基于2017版ICG建立新的預(yù)測模型(AUC=0.763),包括壁結(jié)節(jié)大小、主胰管內(nèi)徑、囊腫大小,并獲得良好的外部驗證結(jié)果(AUC=0.725)[12]。但該研究團(tuán)隊的細(xì)胞學(xué)分析和壁結(jié)節(jié)大小分別依靠內(nèi)鏡下逆行胰膽管造影和超聲內(nèi)鏡檢查,均屬于有創(chuàng)操作,且易受到操作者經(jīng)驗影響。Correa-Gallego等[7]和Attiyeh等[11]基于多中心數(shù)據(jù)構(gòu)建了分別針對主胰管型或混合胰管型IPMN、分支胰管型IPMN的兩個獨立預(yù)測模型,但是基于2012版ICG評估標(biāo)準(zhǔn),納入模型的因素均以臨床指標(biāo)為主,影像學(xué)評估不夠全面。Jang等[10]收集了日本和韓國22家醫(yī)療中心的2 525例分支胰管型IPMN患者構(gòu)建列線圖預(yù)測模型,在訓(xùn)練集(AUC=0.783)和驗證集(AUC=0.737)均具有良好的鑒別能力。但該模型并不適用于惡變率相對較高的主胰管型或混合胰管型IPMN。本研究基于MRI影像特征列線圖的預(yù)測模型,優(yōu)勢在于基于2017版ICG、無創(chuàng)、適用于所有類型IPMN,且表現(xiàn)出良好的預(yù)測效能。本研究不足之處:(1)回顧性研究,僅納入經(jīng)手術(shù)切除的患者,未納入尚處于隨訪階段的患者;(2)單中心研究,預(yù)測模式缺少外部驗證;(3)囊腫增長速率、癌胚抗原、CA19-9未納入評估指標(biāo),由于缺少術(shù)前隨訪數(shù)據(jù),部分患者腫瘤指標(biāo)缺失。筆者將聯(lián)合多中心,增加樣本量,進(jìn)行外部驗證,為預(yù)測模型的臨床應(yīng)用提供更有力的證據(jù)。
利益沖突所有作者均聲明不存在利益沖突

