河南省臭椿炭疽病病原鑒定
王樹和,張佳正,何金鶴
(河南科技大學園藝與植物保護學院,河南 洛陽 471000)
臭椿(Ailanthus altissima(Mill.)Swingle)為苦木科(Simaroubaceae)臭椿屬落葉喬木,原產于中國北部及中部,全國各省區幾乎都有分布[1]。臭椿樹干高大挺拔,樹皮光滑,樹冠如傘狀,極具觀賞價值;而且該樹種耐鹽堿和干旱、抗煙塵和病蟲害,是一種抗性極強的優良綠化樹種[2-3]。因此,臭椿被廣泛用于城市園林建設、山區植樹造林和工礦區綠化,單獨種植或與其它樹種一起混種均可。除用于觀賞綠化外,臭椿還是藥用植物,其樹皮、根皮及果實均可入藥,具有重要的經濟價值[4-5]。
2018 年9 月筆者在河南省洛陽市嵩縣天池山國家森林公園進行病害調查,發現臭椿炭疽病嚴重發生,一些植株病葉率達到70%以上。該病主要危害葉片,病斑褐色呈圓形或近圓形,邊緣顏色較深,病斑中央壞死組織常脫落形成穿孔,后期造成臭椿大量落葉,嚴重影響樹木生長和景觀價值。王教敏[6]于2009 報道了青島地區發生的臭椿炭疽病,基于形態學和rDNA-ITS 序列,鑒定分離菌株SQD-107 為膠孢炭疽菌(Colletotrichum gloeosporioidesPenz.)。本次調查觀察到的臭椿炭疽病與王教敏[6]描述的癥狀存在著較為明顯的差異,發病后期多數病斑形成穿孔。本研究擬采用形態學與多基因系統發育分析相結合的方法,對該地區臭椿炭疽病病原菌鑒定,并經柯赫氏法則驗證,以期為該病害防治策略的制定提供參考。
1 材料與方法
1.1 材料
臭椿炭疽病病葉采集于河南省洛陽市嵩縣天池山國家森林公園。致病性測定的臭椿健康葉片采集于河南科技大學校園。
1.2 方法
1.2.1 病原菌分離純化 參照Chen 等[7]病原組織分離法分離病原菌,分離的菌株單孢純化后,保存于PDA 斜面上,置4℃冰箱中保存備用。
1.2.2 致病性測定 分離菌株CH-1 和CH-3 用于接種試驗,參照Torres-Calzada 等[8]的方法進行有傷和無傷接種(圖1),將采集的臭椿健康葉片用0.5% NaClO 表面消毒,無菌水沖洗3 次,葉面水分晾干后進行接種。有傷接種時用無菌接種針刺傷葉片,移液槍吸取供試菌株分生孢子懸浮液20 μL(濃度為1×106個·mL?1)滴在葉片刺傷部位,對照處理接種20 μL 無菌水;無傷接種對健葉未進行刺傷,其余操作同有傷接種。每個處理接種10 片葉子,試驗重復2 次。接種后的葉片放置于加有濕潤濾紙的保鮮盒內,在葉柄處包裹脫脂棉并滴加無菌水,將裝有葉片保鮮盒置于培養箱內,培養條件為:溫度25℃,12 h 光暗交替。逐日觀察葉片的發病情況,接種葉片發病后再進行分離培養,完成柯赫氏法則的驗證。
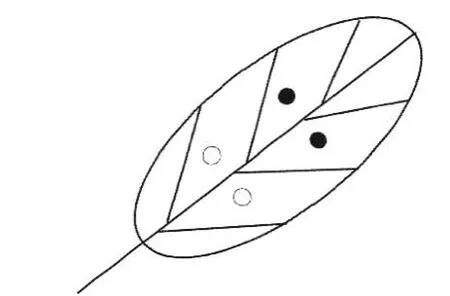
圖1 葉片接種示意圖Fig.1 Schematic diagram of the protocol used to leaf inoculation
1.3 病原菌的形態觀察
參照Yan 等[9]描述的方法進行形態學鑒定。在光學顯微鏡(Leica DM2500,Germany)下觀察分生孢子梗、分生孢子、子囊、子囊孢子等微觀形態,并測量分生孢子和子囊孢子(n=50)的大小。依照Yang 等[10]描述的方法誘導分生孢子附著胞的產生,觀察記錄附著胞形態特征并測量其大小(n=30)。
1.4 分子生物學鑒定
采用改良CTAB 法[11]提取菌株CH-1 和CH-3 基因組DNA。使用rDNA-ITS 通用引物ITS5/ITS4[12]、肌動蛋白(actin,ACT)引物ACT-512F/ACT-783R[13]、β-微管蛋白(beta-tubulin 2,TUB2)引物TUBT1/TUB2b[14-15]、甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物GDF1/GDR1[16]和幾丁質合成酶(chitin synthase,CHS-1)引 物CHS-79F/CHS-345R[13]對病原菌基因組DNA 進行擴增。
PCR 擴增得到的目的片段通過1%的瓊脂糖凝膠電泳檢測后委托北京擎科生物技術公司進行測序。測序結果在NCBI(http://www.ncbi.nlm.gov)數據庫中進行BLAST 比對,根據比對結果下載參比序列(表1),使用PhyloSuite 軟件中MAFFA 插件對建樹序列進行多重比對[17],必要時進行手工校正。比對后的基因序列在PhyloSuite 軟件中按照ACT、TUB2、CHS-1、GAPDH和ITS的順序串聯整合成一個多基因數據集[17],基因序列合并的數據集在MEGA X 軟件中采用最大似然法(maximum likelihood,ML)并選用TN93+G 核苷酸替代模型構建系統進化樹,各分支節點的置信值通過1000 次自舉(Bootstrap)抽樣進行評估[18]。
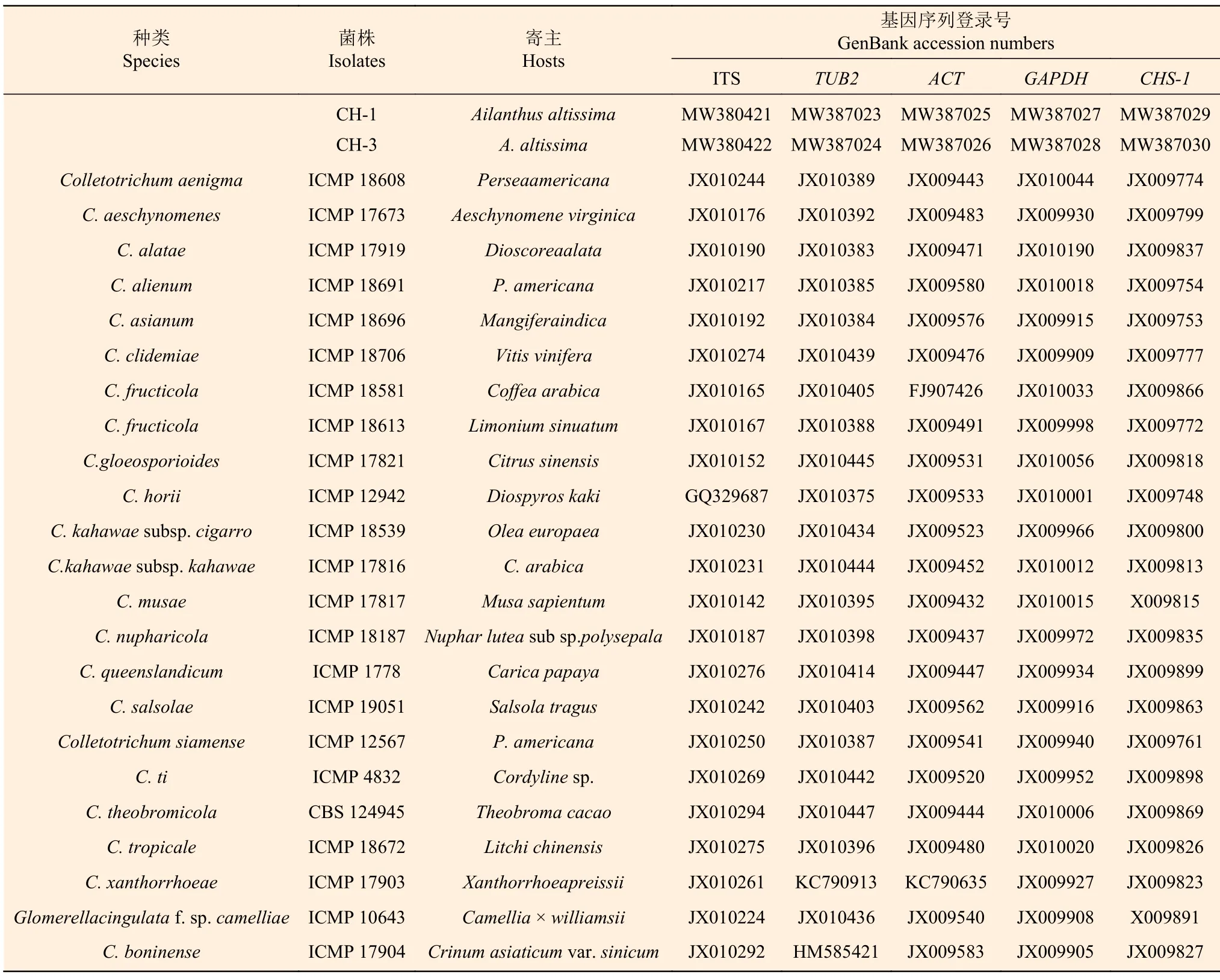
表1 本研究中用于構建系統發育樹的菌株信息及基因序列登記號Table 1 Collection details and GenBank accession numbers of isolates used for phylogenetic analysis in this study
2 結果與分析
2.1 病害癥狀與致病性測定
該病害主要危害葉片,發病初期在葉片上可見褐色小點,擴展以后形成淺褐色圓形或近圓形病斑,病斑邊緣顏色較深,發病后期在葉片病健交界處產生一圈裂紋,病斑中央組織脫落可形成穿孔。有時多個病斑相互愈合形成大斑,脫落后形成大的穿孔(圖2A)。
致病性測定結果顯示,有傷接種條件下供試菌株CH-1 和CH-3 均可使臭椿葉片發病(圖2B,2C),接種1~2 d 后在接種部位可見褐色斑點,接種5~7 d 后一些病斑在病健交接處產生離層,進一步發展形成穿孔癥狀(圖2B,2C),與自然發病癥狀完全相同。發病組織再分離,獲得分離物經鑒定與接種菌株相同,由此證明分離獲得的菌株為致病菌。無傷接種和對照未見發病。

圖2 臭椿炭疽病癥狀Fig.2 Symptoms of anthracnose on Ailanthus altissima
2.2 病原菌的形態學鑒定
從河南省洛陽市嵩縣天池山國家森林公園采集的臭椿病葉樣品中分離獲得11 個菌株,所有菌株在PDA 上菌落表現一致,菌落平整且邊緣整齊,氣生菌絲較密,棉絮狀,菌落初始為白色,幾天后菌落中間出現灰綠色(圖3A),背面有黑色素沉積(圖3B)。25℃培養5 d 的菌落直徑為6.18 ± 0.67 cm。菌落上產生的分生孢子堆白色到淺黃色,顯微鏡檢可見分生孢子為圓柱狀,兩端鈍圓,單孢,無色(圖3C),孢子大小(12.01~18.10)μm×(4.66~6.90)μm,平均長14.55 ± 1.22 μm,寬5.79 ± 0.44 μm。附著胞淺至深棕色,橢圓形或近球形(圖3D,3E),大小(6.20~7.96)μm×(4.68~6.79)μm,平均長7.85 ± 1.12 μm,寬5.62 ± 0.49 μm。在PDA 上培養15 d 左右可形成子囊殼,子囊棍棒狀,內含8 個子囊孢子,子囊孢子梭狀,兩端鈍圓,稍彎曲(圖3F,3G),子囊孢子大小(13.83~22.53)μm×(4.05~6.29)μm,平均長18.35 ± 1.65 μm,寬5.20 ± 0.53 μm。根據形態學和培養特征初步鑒定分離菌株為炭疽菌(Colletotrichumspp.)。[19-20]
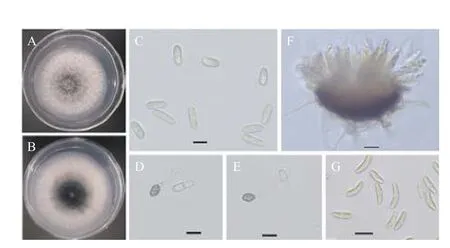
圖3 臭椿炭疽病病原菌的純培養和形態特征Fig.3 Morphology and cultural characteristics of Colletotrichum fructicola from Ailanthus altissima
2.3 病原菌的分子生物學鑒定
對菌株CH-1 和CH-3 的ITS、ACT、TUB2、GAPDH和CHS-1基因進行擴增和測序,得到大小分別為557 bp、289 bp、722 bp、280 bp 和299 bp的特異性片段。將序列提交至GenBank 數據庫(表1),通過BLAST 搜索和比對,結果顯示菌株CH-1 和CH-3 的ITS 和ACT基因序列與膠孢炭疽菌復合種(C.gloeosporioidesspecies complex)內的多個種序列相似性達到99%以上;菌株CH-1 和CH-3 的TUB2、GAPDH和CHS-1基因序列與果生炭疽菌(C.fructicola)序列相似性達到99%以上。從NCBI 上選取相關序列聯合構建系統發育樹,以C.boninense為外群,進行多基因系統發育分析,結果顯示,供試菌株CH-1 和CH-3 與果生炭疽菌(C.fructicola)聚于同一分支,自展支持率為99%(圖4)。結合形態學特征和多基因系統發育分析,最終鑒定在河南省洛陽市嵩縣天池山國家森林公園發生的臭椿炭疽病病原菌為果生炭疽菌(C.fructicola)[21-22]。
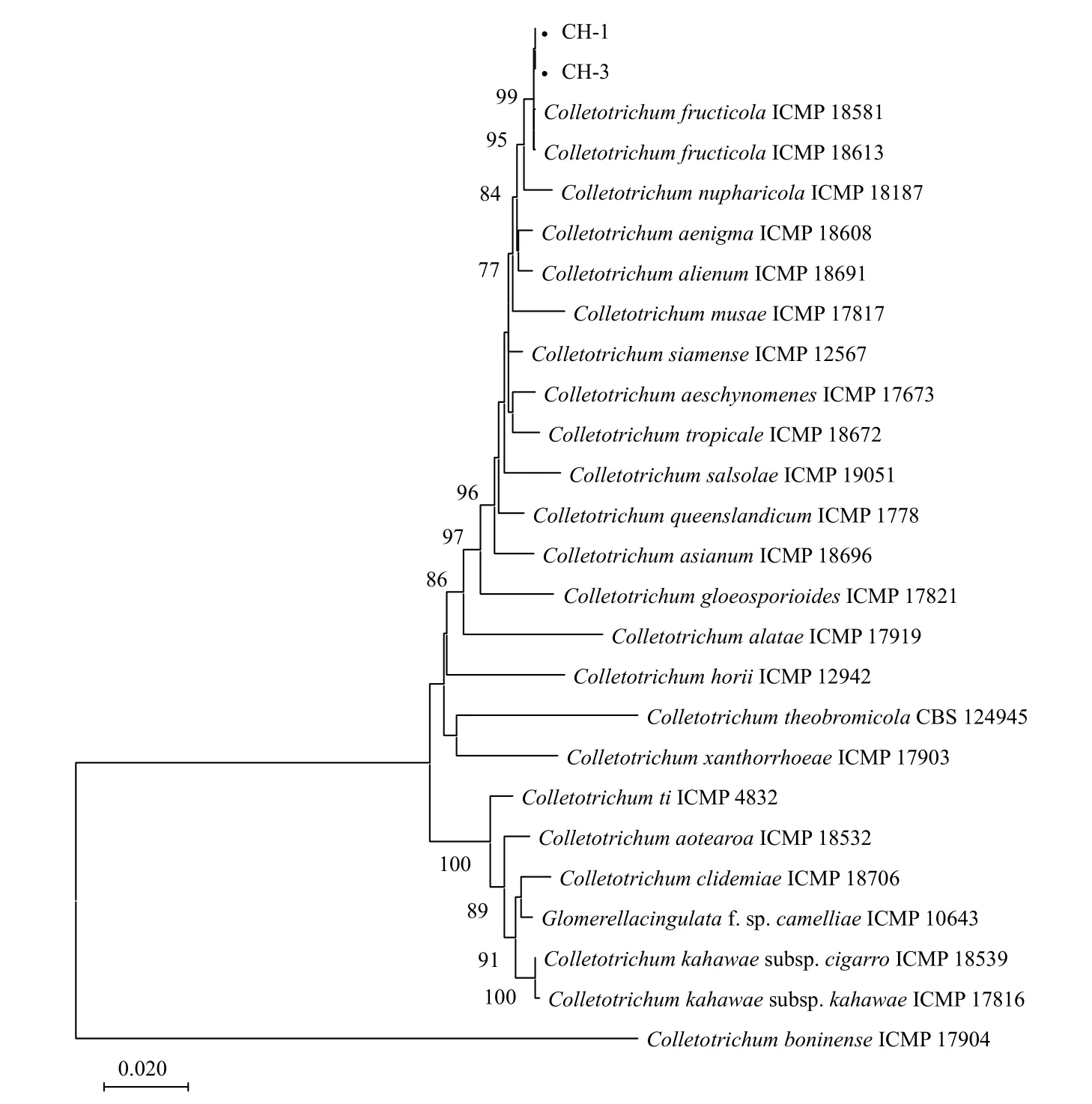
圖4 基于最大似然法構建臭椿炭疽病病原菌及其相關種的多基因系統發育樹Fig.4 Phylogenetic tree based on sequences of Colletotrichum isolates from Ailanthus altissima and related species using maximum likelihood method
3 討論
本研究在河南省洛陽市嵩縣天池山國家森林公園進行病害調查,發現臭椿炭疽病嚴重發生,對發病葉片進行病原菌分離,共獲得到11 個分離物,它們在PDA 上菌落特征表現一致,正面菌落先白色后灰色,背面黑色。菌落上產生的分生孢子堆白色到淺黃色,分生孢子圓柱狀,兩端鈍圓,單孢,無色。由于炭疽菌屬(Colletotrichum)內種類繁多、形態簡單,能夠用于形態鑒定的特征較少,造成其種間界限不明確、分類鑒定困難[19,23]。通過形態學難以確認11 個分離物確切的種,初步鑒定為炭疽菌(Colletotrichumspp.)。
近年來,分子生物學技術在真菌分類鑒定中的應用,對炭疽菌屬的分類鑒定方法產生了深刻影響[19,24]。rDNA-ITS 序列分析是炭疽菌分子鑒定中應用最早、最多的方法,為許多物種的鑒定及系統進化分析提供了有力工具[23-24]。研究發現,僅基于rDNA-ITS 序列并結合形態特征進行系統進化分析或物種鑒定存在一定的局限性,對于一些近緣相似種和復合種,仍不能準確反映和有效識別其親緣關系[19,24]。目前,基于形態學和多基因序列的系統發育分析方法被眾多研究者接受[25-27]。隨著炭疽菌多基因系統學研究的深入,將炭疽菌屬真菌劃分為14 個復合種(C.acutatum、C.boninense、C.caudatum、C.dematium、C.destructivum、C.dracaenophilu、C.gigasporum、C.gloeosporioides、C.graminicola、C.magnum、C.orbiculare、C.orchidearum、C.spaethianum和C.truncatum)和部分獨立種[19,28-29]。Weir 等采用ITS、ACT、CAL、CHS-1和GAPDH基因對大量炭疽菌株進行多基因序列分析和形態學鑒定,明確了C.gloeosporioides復合種內包含了22 個種和1 個亞種[21]。目前,C.gloeosporioides復合種已接受41 個合格種,其中大多數為植物病原菌[21,25,28,30]。本研究中對分離菌株進行形態學觀察和多基因(ITS、ACT、TUB2、GAPDH和CHS-1)系統發育分析的結果顯示,它們均為C.gloeosporioides復合種內的果生炭疽菌(C.fructicola)。
果生炭疽菌(C.fructicola)首次在泰國咖啡果實上發現[20],之后陸續報道該病菌可侵染多種經濟作物,如梨[21]、蘋果[22]、柑橘[31]、煙草[32]、木薯[33]和芒果[34]等,引起葉片壞死和果實腐爛。Weir等[21]研究發現果生炭疽菌具有明顯的地域多樣性和生物多樣性,僅依賴形態學特征或rDNA-ITS 序列均很難對其準確鑒定。目前,推薦使用多基因序列的系統發育分析對其進行準確鑒定[21,27]。
4 結論
本研究對采自河南省洛陽市嵩縣天池山國家森林公園的臭椿炭疽病樣品進行了病原菌分離與純化,致病性測定證明分離物可侵染臭椿葉片,并引起與林間癥狀一致的炭疽病;病原菌形態特征觀察及多位點基因(ITS、ACT、TUB2、CHS-1和GAPDH)系統發育分析表明,引起該地區臭椿炭疽病的病原菌為果生炭疽菌(C.fructicola)。該研究結果可為深入研究臭椿炭疽病的發生流行規律以及制定防治策略奠定基礎。

