晚期妊娠藥物引產對新生兒黃疸的影響
劉艷慧 馬向英 呂英璞 李毅飛 趙騰騰 習東燕
在自然臨產前通過藥物、機械等手段使產程發動,達到分娩的目的,稱為妊娠晚期引產。對于有明確引產指征的孕婦,引產術作為促進自然分娩的干預措施之一,廣泛應用于臨床,可降低剖宮產率,并避免并發癥的發生[1]。目前用于妊娠晚期引產的手段主要包括機械方式及藥物方式。前者是通過機械作用刺激宮頸管,促進宮頸局部內源性前列腺素合成與釋放從而促進宮頸軟化、成熟以達到引產的目的,可有效避免藥物的副作用,但它限制應用于胎膜完整及無陰道感染的情況下。用于妊娠晚期引產的藥物主要包括縮宮素、米索前列醇及普貝生。近年來陸續有報道稱藥物引產會增加新生兒黃疸的發生風險,縮宮素引產與新生兒黃疸發生率的關系報道較為多見[1],亦有少數文獻報道使用米索前列醇與新生兒黃疸的相關性。筆者就所在科室使用藥物引產后新生兒的黃疸情況予以總結,報道如下。
1 資料與方法
1.1 一般資料 選取2017年1月至2018年6月于石家莊市人民醫院經陰道分娩的足月產產婦200例作為研究對象,其中縮宮素引產病例70例(A組),米索前列醇引產病例30例(B組),普貝生引產病例30例(C組),自然臨產病例70例(D組)。將縮宮素引產病例按照縮宮素的應用劑量(2.5~5.0 U、5.0~7.5 U、7.5~10 U)分為a組(n=35)、b組(n=19)和c組(n=16)。
1.2 納入與排除標準
1.2.1 納入標準:①研究對象均無煙酒嗜好;②均為足月產;③均為單胎妊娠;④均為經陰道分娩且產程順利。
1.2.2 排除標準:①有妊娠合并癥,如妊娠期高血壓疾病、妊娠期糖尿病等;②母親為O型血,患有肝腎疾病、原發性高血壓、糖尿病及其他心血管疾病;③新生兒紅細胞增多癥、新生兒溶血、新生兒感染性疾病;④足月低體重兒及巨大兒;⑤新生兒窒息。
1.3 方法
1.3.1 縮宮素的應用:靜脈滴注縮宮素應從小劑量、低濃度開始,起始濃度均以2.5 U縮宮素+0.9%氯化鈉500 ml靜脈滴注,即0.5%縮宮素濃度,滴速從8滴/min起,嚴密觀察宮縮強度、宮縮持續時間、宮縮間歇時間,根據宮縮情況逐漸調整縮宮素用量至有效宮縮,滴速控制在<40滴/min,補液量控制在<1 000 ml/d,防止水中毒。如果達到最大滴速后仍無有效宮縮可以增加縮宮素的濃度,即以5.0 U縮宮素+0.9%氯化鈉500 ml變成1%縮宮素濃度,此時應將滴速減半,再根據宮縮情況調整,最大用量為40滴/min,原則上不再增加縮宮素的濃度和滴數[2]。給藥時加強監護,一旦發現宮縮過頻、過強立即停藥。
1.3.2 米索前列醇的應用:應用米索前列醇時不能將藥物壓成碎片,每次陰道放置劑量為25 μg,觀察6 h后如仍無宮縮,先進行陰道檢查,了解宮頸的成熟度,同時了解原放置的藥物是否溶化、吸收,如果已經溶化吸收可以再次放置米索前列醇25 μg,如果沒有溶化和吸收則不宜再放。應用米索前列醇的每日總量不超過50 μg,以免藥物吸收過多造成宮縮過頻過強。使用米索前列醇時應嚴密監測宮縮和胎心率,在產房觀察,如果出現宮縮過頻過強,應立即進行陰道檢查,并取出殘留藥物[2]。
1.3.3 普貝生的放置:消毒外陰后將前列腺素E2栓(普貝生)置于陰道后穹隆深處,并旋轉90°,這樣使得普貝生栓劑橫置于陰道后穹隆,便于保持原位,并保留2~3 cm終止帶于陰道外口以便于取出。放置藥物后,孕婦需在床上平臥20~30 min以利于栓劑吸水膨脹,2 h后復查藥物的位置,如藥物位置沒有改變孕婦方可下地活動。普貝生取出的時機:行人工破膜術或自然破膜;出現規律宮縮(每3分鐘1次)并行陰道檢查發現宮頸成熟度得到明顯改善,宮頸Bishop評分≥6分;子宮收縮過頻(≥每10分鐘5次);可疑胎兒宮內窘迫時;母體出現惡心、嘔吐、腹瀉、發熱、低血壓、心動過速或者陰道流血增多等不良反應,并且無法用其它原因解釋時[2]。
1.4 觀察指標 在新生兒娩出后的24 h、48 h、72 h,應用皮膚測膽儀測量新生兒經皮膽紅素水平,當經皮膽紅素水平超過220.6 μmol/L時,抽取新生兒靜脈血查血清膽紅素水平,比較新生兒黃疸的發生率。
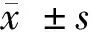
2 結果
2.1 4組病例一般資料比較 4組病例在孕產婦年齡、孕周、新生兒體重等一般資料比較差異無統計學意義(P>0.05),具有可比性。見表1。
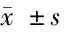
表1 4組病例一般資料比較
2.2 4組新生兒經皮膽紅素水平比較 4組新生兒娩出后的24 h、48 h、72 h新生兒經皮膽紅素水平差異無統計學意義(P>0.05)。見表2。

表2 4組不同時段新生兒經皮膽紅素水平比較
2.3 不同劑量縮宮素引產組新生兒經皮膽紅素水平比較 a組新生兒在產后的24 h、48 h、72 h經皮膽紅素水平分別為(64.94±29.92)μmol/L、(125.12±38.42)μmol/L、(176.80±38.25)μmol/L;b組為(64.77±35.53)μmol/L、(129.54±27.37)μmol/L、(171.87±29.75)μmol/L;c組為(84.32±27.03)μmol/L、(150.45±31.45)μmol/L、(177.65±29.07)μmol/L。3組新生兒經皮膽紅素水平在產后24 h、48 h、72 h 3個時段均無明顯差異(P>0.05)。見表3。

表3 縮宮素引產3組不同時段新生兒經皮膽紅素水平比較
2.4 縮宮素引產組、米索前列醇引產組、普貝生引產組分別與自然臨產組新生兒黃疸發生率比較 縮宮素引產組新生兒黃疸發生率為10%;米索前列醇引產組為3.3%,普貝生引產組為6.7%;自然臨產組為7.1%。藥物引產組分別與自然臨產組新生兒黃疸發生率比較,差異均無統計學意義(χ2=0.365,0.076,0.000,P>0.05)。見表4。

表4 藥物引產組分別與自然臨產組新生兒黃疸發生率比較 例(%)
3 討論
保障圍產期安全一直是產科關注的重點,亦是難點之一,如果繼續妊娠會對母親或者胎兒造成危險,就需要進行引產,引產的方法包括機械方法及藥物方法。機械方法包括低位水囊、Foley導管、海藻棒等。臨床當中應用最多的主要是宮頸球囊,它可以通過機械重力作用的刺激,增加內源性前列腺素的分泌,使宮頸管得到軟化、縮短,從而使宮口擴張。宮頸擴張球囊應用于足月妊娠促宮頸成熟的引產效果優于單純應用靜滴縮宮素,具有成功率高、并發癥少、患者滿意度高等優勢[3]。宮頸擴張球囊的使用需要在滿足胎膜完整及無陰道感染兩個條件下完成。
藥物引產主要包括縮宮素引產及前列腺素制劑引產,后者又包括米索前列醇引產和普貝生引產。由于縮宮素半衰期短而在臨床應用過程中比較安全,如果在靜點縮宮素過程中出現過頻過強的宮縮,可及時停用,停用后數分鐘過頻過強宮縮的狀態就可以得到有效的緩解。縮宮素在引產過程中是通過縮宮素受體發揮作用,而宮頸處縮宮素受體非常少,所以縮宮素的促宮頸成熟作用比較弱,它僅能通過刺激蛻膜合成前列腺素等來促進宮頸成熟,故在宮頸條件不成熟的孕婦中應用縮宮素的引產成功率較低。對于宮頸條件不成熟的孕婦引產時應先進行促宮頸成熟的處理。目前臨床當中比較常見的促宮頸成熟藥物有米索前列醇和普貝生,兩者用于引產可以取得良好的效果,但米索前列醇容易造成宮縮過頻過強,從而容易引發胎兒窘迫,而普貝生是通過緩釋裝置使得藥物緩慢釋放而發揮作用,這可以減少宮縮過頻、過強的風險,雖然目前臨床當中尚未確定在促宮頸成熟這一方面,兩者哪個作用更好,但相對于米索前列醇容易造成宮縮過頻過強來講,普貝生相對安全。在平時的臨床工作當中,引產前應先進行宮頸評分,如果宮頸評分>6分,可直接進行縮宮素點滴引產,如果宮頸評分<6分,應先進行促宮頸成熟,具體促宮頸成熟的方法應根據當地醫院的條件及病人的接受度綜合考慮。
大多數研究認為晚期妊娠使用縮宮素引產會增加新生兒黃疸的發生率[4-6]。并且縮宮素的使用劑量越大,黃疸的程度越深[7,8]。僅有少數文獻稱縮宮素引產與新生兒黃疸無明顯相關性[9,10]。我們發現認為縮宮素引產會增加新生兒黃疸發生率的文獻當中,縮宮素應用時所用介質為5%葡萄糖。認為縮宮素引產與新生兒黃疸無明顯相關性的文獻當中,有文獻應用縮宮素時所用介質為0.9%氯化鈉,有文獻所用何介質未做詳細說明。本單位在晚期妊娠使用縮宮素引產時應用0.9%氯化鈉作為稀釋溶液,篩查新生兒黃疸時應用皮膚測膽儀測量新生兒經皮膽紅素水平。
雖然在診斷高膽紅素血癥時的金標準為血清總膽紅素水平,但篩查血清膽紅素水平為有創操作,在臨床工作中具有一定的局限性,尤其對于新生兒而言,靜脈采血比較困難而且如果監測新生兒血清膽紅素水平就需要反復穿刺,增加新生兒的不適感。而測定經皮膽紅素水平為無創操作,應用于平時臨床工作中既方便又快捷,可動態觀察血清總膽紅素的變化水平[11]。故在我們的研究中使用經皮膽紅素水平作為觀察指標是有理論依據的。當我們把為0.9%氯化鈉溶液作為縮宮素使用時的稀釋液時,比較了縮宮素組與自然臨產組新生兒在產后24 h、產后48 h、產后72 h的經皮膽紅素水平以及新生兒黃疸發生率,結果表明縮宮素引產組與未使用任何藥物自然臨產組新生兒經皮膽紅素水平在產后72 h之內差異無統計學意義,2組之間新生兒黃疸發生率差異亦無統計學意義。分析原因,當使用稀釋劑為5%葡萄糖時新生兒黃疸的發生率增加,可能是由于葡萄糖的應用容易造成水中毒,而縮宮素降低了紅細胞的變形能力,這是由于縮宮素在紅細胞膜上的作用引起的滲透腫脹,從而增加了水分的攝入。
為解釋新生兒高膽紅素血癥和縮宮素給藥有關而提出的其他機制可能是對胎兒紅細胞的創傷,因為子宮激活、氧元素對子宮血管的血管收縮作用,由于氧元素的抗利尿活性而導致的紅細胞生成性改變以及大量無電解質稀釋劑導致的低鈉血癥。正是因為應用縮宮素時使用5%葡萄糖溶液的給藥方法,增加了胎盤低鈉血癥的風險,從而增加新生兒黃疸的發生。因此我們認為,在使用縮宮素引產時,應用含電解質的稀釋劑并不會增加新生兒膽紅素水平。然而我們的研究僅比較了應用含電解質稀釋劑進行縮宮素引產與未應用任何引產藥物而自然臨產的新生兒膽紅素水平,且樣本量較少,如果可以增加樣本量,并且把應用5%葡萄糖作為稀釋劑時縮宮素引產后新生兒膽紅素水平拿來一起比較,將更具有說服力,尚待今后完善。
米索前列醇作為促宮頸成熟常用的藥物之一已廣泛應用于臨床,2014年頒布的妊娠晚期促子宮頸成熟與引產指南中也明確提出了米索前列醇促宮頸成熟的應用常規。張紅[12]對應用米索前列醇引產與無藥物引產自然分娩后新生兒總膽紅素水平進行了測定,結果表明米索前列醇引產組新生兒生后血清總膽紅素水平高于無藥物引產組,認為米索前列醇用于晚期妊娠引產可加重新生兒黃疸。陳琪瑋等[13]也認為晚期妊娠應用米索前列醇引產可加重新生兒黃疸。而我們的研究結果顯示應用米索前列醇引產并不會增加新生兒經皮膽紅素水平及新生兒黃疸發生率。這與Liebenstein等[14]的報道一致。究其原因我們發現在此研究當中,米索前列醇組與未使用藥物引產的自然臨產組相比,新生兒窒息率有顯著的差異,米索前列醇引產組新生兒窒息率明顯高于未使用藥物的自然臨產組,而我們的研究中將新生兒窒息放在排除標準中,摒棄了新生兒窒息這一干擾因素。這可以用米索前列醇的應用會引起宮縮過頻、過強,從而發生胎兒窘迫,胎兒窘迫又可以使胎兒紅細胞發生病理性改變、破壞增加,最終導致新生兒黃疸的發生來解釋,從這可以看出米索前列醇并不是導致新生兒黃疸的直接因素。故我們認為在嚴格掌握引產指征,應用米索前列醇的方法正確,并避免胎兒窘迫、新生兒窒息發生的情況下,并不會增加新生兒膽紅素水平。
除米索前列醇之外,普貝生作為促宮頸成熟的藥物之一亦廣泛應用于臨床。研究顯示普貝生促宮頸成熟的引產效果顯著,可顯著降低剖宮產和羊水胎糞污染的發生風險[15,16]。與米索前列醇相比較,普貝生含有藥物控釋裝置,可以通過控釋系統以0.3 mg/h的速度恒速釋放前列腺素E2,從而激活內源性前列腺素,提高彈性蛋白酶和高膠原酶的活性,從而松弛宮頸平滑肌、軟化宮頸,以此達到促宮頸成熟的目的[17]。雖然目前筆者尚未找到資料顯示應用米索前列醇與應用普貝生引產哪個效果更顯著,但相比較米索前列醇而言,普貝生有使藥物緩慢釋放的優點,通過這一點普貝生可以減少宮縮過頻、過強的發生,從而降低胎兒窘迫的發生,間接避免了新生兒黃疸的發生。通過這一點也可以說明米索前列醇的應用與新生兒黃疸并無直接關系,胎兒窘迫的發生可能增加了新生兒黃疸的發生率。故我們認為晚期妊娠使用普貝生引產并不會增加新生兒膽紅素水平。
綜上所述,我們認為在嚴格掌握引產指征的前提下,晚期妊娠正確、謹慎的使用藥物引產并不會增加新生兒膽紅素水平以及新生兒黃疸發生率,然而在藥物引產過程中仍需嚴密觀察宮縮、胎心等指標,有情況隨時處理,以減少藥物不良反應的發生。

