基于電導率傳感器的實驗探究教學設(shè)計




化學是一門以實驗為基礎(chǔ)的學科,化學實驗是實現(xiàn)教學目標的重要方法和途徑。新課標要求在內(nèi)容選擇上精心設(shè)計學生必做實驗,同時適當增加數(shù)字化實驗、定量實驗和創(chuàng)新實踐活動等,讓學生在實驗探究活動中學習科學方法,認識科學探究過程,體會、認識技術(shù)手段的創(chuàng)新對化學科學的重要價值[1]。難溶電解質(zhì)在水溶液中存在的溶解平衡是一個重要的化學平衡。筆者利用電導率傳感器進行實驗探究,引導學生論證溶解平衡的存在,體驗溶度積常數(shù)的獲得,判斷溶解平衡的移動。應用數(shù)字化實驗進行探究與數(shù)理分析,有利于學生加深對化學平衡理論的理性認識,增強數(shù)據(jù)實證意識,發(fā)展學生的化學學科核心素養(yǎng)。
一、教材內(nèi)容分析
人教版[2]與魯科版[3]教材分別以難溶電解質(zhì)AgCl和PbI為例,說明存在溶解平衡,指出溶度積常數(shù)只與難溶電解質(zhì)的性質(zhì)與溫度有關(guān),而與沉淀的量無關(guān)。難溶電解質(zhì)在水溶液中的溶解度很小。利用傳統(tǒng)的實驗手段很難搞清其微觀離子在水中的存在和運動,而應用電導率傳感器可以探知微弱的離子濃度變化,并以數(shù)字化的形式呈現(xiàn)難溶電解質(zhì)的溶解平衡及影響因素。筆者在教學設(shè)計中創(chuàng)新實驗方案,通過測量難溶電解質(zhì)PbI飽和液的電導率,獲得各離子的實際濃度和溶度積常數(shù),通過測量懸濁液稀釋過程和升溫過程的電導率變化,說明溶解平衡的存在和溫度效應的影響,以加強實驗與理論結(jié)合的數(shù)據(jù)實證,提高學生的化學學科能力。
二、教學現(xiàn)狀分析
很多化學教師非常關(guān)注并開展了相關(guān)的數(shù)字化實驗教學研究。鄭曉紅[4]利用氯離子傳感器,通過氯離子濃度的升降來定性研究氯化銀沉淀溶解平衡的移動。楊玲等[5]利用pH傳感器與電導率傳感器探究碳酸鈣的溶解平衡的移動方向。相關(guān)實驗研究思路新穎,推理縝密,證明了溶解平衡的存在和移動,但都沒有對離子濃度、溶度積常數(shù)進行定量計算,沒有研究溫度對溶解平衡的影響,且普通的氯離子傳感器在濃度極低時的敏感性和精確性并不理想,只能作定性變化的研究。在溶解平衡的實驗教學中要充分論證平衡理論,必須獲得離子實際濃度并計算溶度積常數(shù),因為離子的實際濃度變化是溶解平衡發(fā)生變化最直接的表達,也是溶解平衡移動方向最直接的判斷,而溶度積常數(shù)可直觀表現(xiàn)和比較沉淀的溶解性。
三、教學與評價目標
(一)教學目標
第一,通過對難溶電解質(zhì)離子濃度與電導率關(guān)系的認識,初步理解溶解平衡的存在,并從宏觀和微觀角度解釋溶解平衡。
第二,觀察懸濁液的稀釋和加熱過程中電導率變化的情況,了解溶解平衡的存在和移動,并通過電導率、離子濃度、溶度積常數(shù)等判斷溶解平衡的移動,解釋平衡移動的原因。
第三,通過利用電導率傳感器實驗探究離子濃度和對有毒廢棄物的無害化處理,培養(yǎng)學生嚴謹求實的探究精神和環(huán)保意識的社會責任。
(二)評價目標
第一,利用電導率與離子濃度的關(guān)系,計算溶度積常數(shù),診斷并發(fā)展學生宏觀—微觀—符號三重表征的理解水平。第二,通過對電導率實驗的設(shè)計和操作,診斷并發(fā)展學生利用數(shù)字化傳感器進行科學實驗的探究水平。第三,通過對稀釋和加熱懸濁液過程中的電導率變化曲線的解讀和點評,評估并提高學生對化學平衡理論和溶解平衡移動的理解水平。
(三)教學重點與難點
重點是使學生掌握溶解平衡的存在和移動,難點是用離子濃度和化學平衡理論解讀溶解平衡移動。
四、教學設(shè)計思路
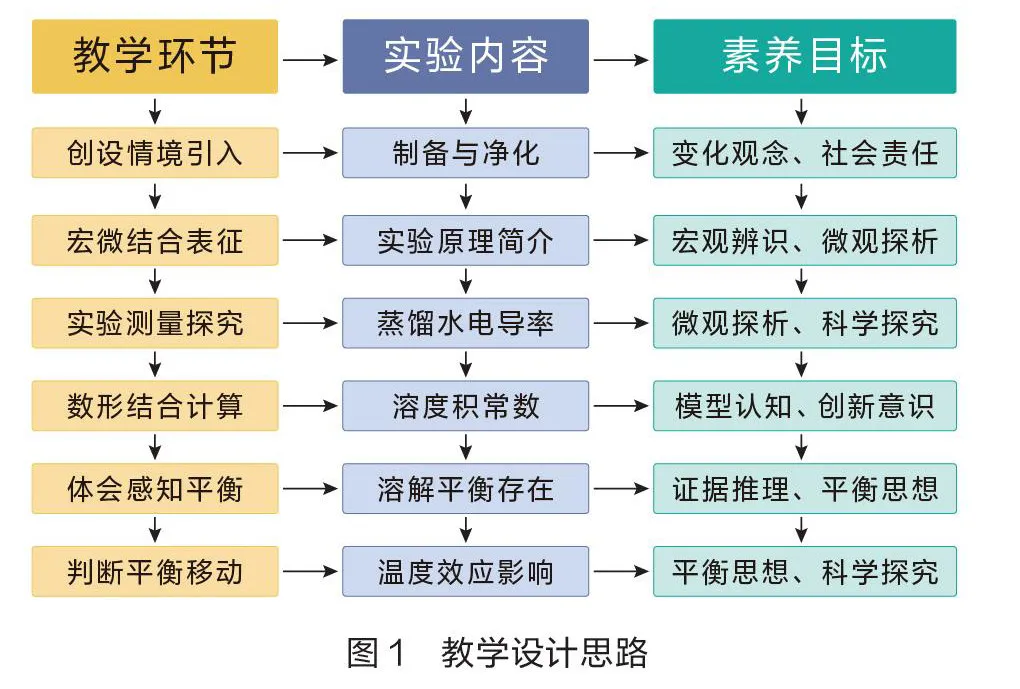
難溶電解質(zhì)的溶解平衡是水溶液中一個重要的化學平衡。通過此內(nèi)容的學習,學生能熟練應用化學平衡理論解釋溶解平衡,同時更加透徹地了解溶液中離子濃度變化的情況。筆者采用教—學—評一體化策略,助力學生核心素養(yǎng)發(fā)展。在教學過程中,以黃金雨為情境,通過6個教學步階,引導學生電導率實驗探究溶解平衡的存在和移動,有效建構(gòu)和完善化學平衡理論(如圖1)。
五、教學過程
(一)碘化鉛的制備與凈化
首先取兩個250 mL規(guī)格的燒杯,分別加入0.5 g硝酸鉛和0.6 g碘化鉀,向兩個燒杯中分別加入150 mL 65 ℃熱水,然后用玻璃棒攪拌加速溶解后將碘化鉀溶液倒入硝酸鉛溶液中,立即產(chǎn)生金黃色的碘化鉛沉淀,最后將懸濁液趁熱過濾于燒瓶中,燒瓶內(nèi)在燈光的照射下不斷生成閃著金光的“黃金雨”。濾液在冷卻過程中不斷地析出大小均一的碘化鉛沉淀。
將碘化鉛沉淀轉(zhuǎn)移到離心試管內(nèi),加入5 mL蒸餾水,置于離心機上以900轉(zhuǎn)/秒的轉(zhuǎn)速離心3分鐘,將上層清液倒入1個盛有NaS固體的燒杯中進行無害化處理,再加入蒸餾水按上述離心操作3次。
實驗分析 :制備實驗主角碘化鉛(引入課題),展現(xiàn)鮮艷亮麗的色彩讓學生體會化學之美,吸引學生的注意力,激發(fā)學生的興趣。反復地離心操作和蒸餾水清洗,目的是除去多余的硝酸根、鉀離子等可溶離子,確保碘化鉛沉淀的純度。凈化操作可根據(jù)課時的安排,課前另制沉淀。強調(diào)含鉛污染物的無害化處理,增強學生的環(huán)保意識,發(fā)展學生“社會責任”相關(guān)素養(yǎng)。
(二)電導率實驗原理
固態(tài)物質(zhì)的導電能力通常以電阻表示,而液態(tài)物質(zhì)的導電能力通過用電導表示。電導是電阻的倒數(shù)。由于溶液導電能力主要受離子濃度影響,所以同種電解質(zhì)的水溶液電導越大說明電解質(zhì)離子濃度越大。難溶電解質(zhì)多為溶解度極小的強電解質(zhì),電解質(zhì)的極限摩爾電導率 (S·m2·mol-1)、測量電導率 (S·m-1)、電解質(zhì)的離子濃度 (mol·L-1)、沉淀物(AB型)的溶度積常數(shù)(mol3·L-3)有如下關(guān)系:
查表[6]可得25 ℃時碘化鉛的極限摩爾電導率為1.478×10-2 S·m2·mol-1。
實驗分析:溶液的導電性是電解質(zhì)電離性質(zhì)的重要內(nèi)容。介紹實驗原理,讓學生基本掌握溶液導電能力與離子濃度的關(guān)系,并知道可以通過電導率實驗測量獲得離子濃度,進一步計算難溶電解質(zhì)的溶度積常數(shù),達成化學研究微—宏—符的三重表征,發(fā)展學生“宏觀辨識與微觀探析”素養(yǎng)。
(三)蒸餾水電導率測定
按圖2搭建實驗裝置。
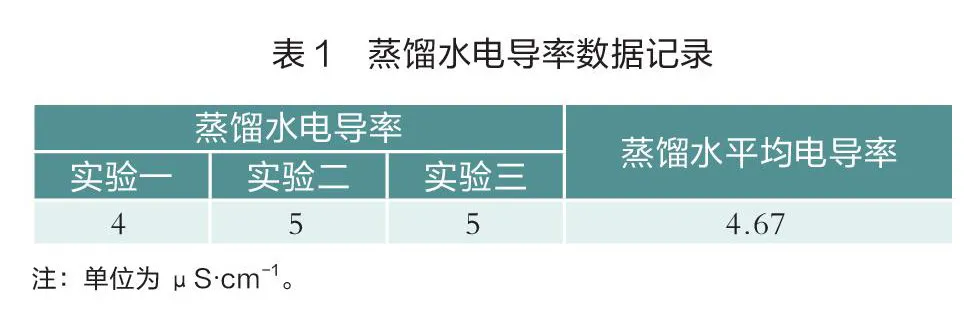
在小燒杯中加入20 mL的蒸餾水,將電導率傳感器放入蒸餾水中測量,將操作結(jié)果填入表1中,重復3次取平均值。
實驗分析:雖然蒸餾水的電導率非常小,但由于溶有少量的雜質(zhì),如二氧化碳等,這些溶質(zhì)相對于難溶電解質(zhì)來說,仍有較大影響。測定蒸餾水的電導率進行數(shù)據(jù)處理時,用扣除溶劑電導率后的數(shù)據(jù)表示電解質(zhì)的電導率較為精確。如果實驗有更高精度的要求,還可以對蒸餾水進行預處理。處理的方法是向蒸餾水中加入少量高錳酸鉀,用硬質(zhì)燒瓶進行重蒸餾[7],得到“電導水”。“電導水”的電導率可以做到小于1 μS·cm-1。
(四)溶度積常數(shù)的獲得
將純凈的碘化鉛沉淀全部(沉淀越多溶解速率越快)倒入到盛有75.00 mL蒸餾水的大燒杯中,放入電導率傳感器開始測量電導率,用玻璃棒輔助磁力攪拌器進行攪拌,直至電導率測量值表現(xiàn)為不再變化,達到溶解飽和呈懸濁狀,獲得數(shù)據(jù)記錄并計算填表(見表2)。
實驗分析:根據(jù)碘化鉛的極限摩爾電導率,結(jié)合實驗測量溶解飽和的懸濁液電導率,本實驗可以比較精確地獲得溶度積常數(shù)=7.40×10-9(26.5 ℃)。化學手冊提供數(shù)據(jù)為7.10×10-9(25 ℃),誤差僅偏大4.22%,故本實驗操作方法有非常高的參考價值。本次實驗測得的實驗值略大于化學手冊給出的數(shù)值。造成誤差的主要原因是本次實驗室內(nèi)氣溫為26.5 ℃,比手冊數(shù)據(jù)溫度25 ℃略高。在電導率測量中,即便溫度只高1.5 ℃,也會因為溫度效應造成測量數(shù)值偏大。
(五)溶解平衡的存在
繼續(xù)在上述懸濁液中測量電導率,將數(shù)據(jù)采集系統(tǒng)設(shè)置為每隔5 s采集1次電導率,用滴定管在燒杯中添加蒸餾水(每次加25.00 mL),用磁力攪拌器加上玻璃棒輔助攪拌,觀察電導率回升到368 μS·cm-1時添加1次蒸餾水。共添加蒸餾水3次。獲得電導率數(shù)據(jù)的變化曲線(如圖3)。
實驗分析:當懸濁液中加入蒸餾水后各離子濃度迅速下降,碘化鉛離子積<,溶液部分為不飽和狀態(tài)。根據(jù)溶度積規(guī)則,沉淀的溶解平衡向溶解方向發(fā)生移動,以達成=狀態(tài)。這一過程碘化鉛沉淀在攪拌作用下會逐漸溶解,溶液趨于飽和,離子濃度逐漸上升,表現(xiàn)為電導率逐漸上升。
每次加入蒸餾水后溶液電導率下降,下降幅度受加入蒸餾水的量與原有溶液的量之比影響。比值越大,下降越多。每次加入蒸餾水的量均為25 mL,而溶液則由75 mL變?yōu)?00 mL、125 mL。比值逐漸減小,所以電導率下降的幅度也逐漸減小。每次加入蒸餾水攪拌后電導率逐漸升高,但由于懸濁液中固體的量減小、溶液的總量增加,溶解速率減慢,溶解沉淀達到飽和濃度逐漸困難,表現(xiàn)為電導率升高達到飽和(平衡)狀態(tài)值所需的時間增加。
(六)平衡的溫度效應
將上述碘化鉛懸濁液加蒸餾水至400 mL,用磁力攪拌器和玻璃棒攪拌至飽和。經(jīng)沉積之后將上層澄清液200 mL倒入一個同批次同容量的燒杯,將兩個燒杯置于雙孔恒溫水浴鍋中。在兩個燒杯中分別放入電導率傳感器,在其中一個燒杯中再放入溫度傳感器,設(shè)置水浴鍋開始加熱,用玻璃棒在兩個燒杯中攪拌,系統(tǒng)設(shè)置為每隔0.5秒記錄測量數(shù)據(jù)。
結(jié)合溫度數(shù)據(jù),繪制電導率數(shù)據(jù)變化曲線。
實驗分析:與其他化學平衡一樣,難溶電解質(zhì)的溶度積常數(shù)也是隨溫度改變而變化的。由于大多數(shù)難溶電解質(zhì)溶解與電離的總反應是吸熱過程,所以溶度積常數(shù)是隨溫度升高而增大的。
通過澄清液升溫過程電導率上升的對比實驗,可知溫度升高時溶液電導率上升并不完全是由于溶液中離子濃度增加引起的。從圖4曲線可看出,澄清液電導率變化曲線與溫度變化曲線幾乎平行,這是由于澄清液中水的電離、離子的活度、離子的電遷移率(淌度)都在隨著溫度的升高而增大,電導率也隨之增大。與澄清液相比,懸濁液電導率變化曲線有明顯的躍起。這是因為懸濁液中還有離子濃度在增加的因素。溫度升高,沉淀溶解平衡向正向移動,溶度積常數(shù)也在增大。
六、教學效果與反思
筆者進行教學設(shè)計時沒有選用學生熟悉的硫酸鋇、氯化銀作為實驗研究的對象,而采用色彩驚艷的碘化鉛作為研究對象,主要是考慮到硫酸鋇、氯化銀的溶解度更小,測量其水溶液時需要的傳感器精度要求很高,使用現(xiàn)有設(shè)備很難實現(xiàn),同時利用碘化鉛也可以讓學生對非AB型難溶電解質(zhì)消除陌生感,便于建構(gòu)各類沉淀物溶度積計算的模型。實驗結(jié)束,用試劑NaS妥善處理含鉛廢液,防止環(huán)境污染,使實驗教學過程既能科學論證化學理論,又能保證環(huán)保無污染。
傳統(tǒng)溶解平衡實驗的數(shù)字化創(chuàng)新改進,可以使原本抽象的化學理論轉(zhuǎn)化為直觀的實驗現(xiàn)象和可靠的數(shù)據(jù)實證,讓學生體驗實驗前的變量選擇、實驗中的過程操作、實驗后的數(shù)據(jù)處理。親歷實驗使學生對化學理論更加信服,批判性、創(chuàng)新性思維能力和科學探究能力得以提高。
參考文獻
[1] 中華人民共和國教育部.普通高中化學課程標準:2017年版2020年修訂[S].北京:人民教育出版社,2020.
[2] 王晶,鄭長龍.化學反應原理(選擇性必修1)[M].北京:人民教育出版社,2020.
[3] 王磊,陳光巨.選擇性必修1 化學反應原理[M].濟南:山東科學技術(shù)出版社,2019.
[4] 鄭曉紅.利用手持技術(shù)探究難溶電解質(zhì)的溶解平衡[J].中學化學教學參考,2016(9):56-57.
[5] 楊玲,吳曉紅,王亞濤.借助傳感器探究難溶電解質(zhì)的溶解平衡[J].教育與裝備研究,2020,36(7):71-73.
[6] J.A.迪安.蘭氏化學手冊[M].魏俊發(fā),譯.北京:科學技術(shù)出版社,1991.
[7] 孫文東,陸嘉星.物理化學實驗(第三版)[M].北京:高等教育出版社,2014.
(作者系浙江省海寧市第一中學教師)
責任編輯:祝元志

