不同營養液電導率對黃瓜幼苗生長和礦質元素含量的影響
丁小濤,何立中,金海軍,張紅梅,崔佳維,周 強,余紀柱
(上海市農業科學院,上海市設施園藝技術重點實驗室,上海都市綠色工程有限公司,上海 201403)
營養液的電導率(electrical conductivity,EC)常用于指示溫室植物生產中水培溶液的養分狀況,其與根區植物可利用的營養離子的組成有關[1]。 EC 過高會造成溫室番茄產量降低,果實體積減小,影響果實對水分的吸收;過低會造成養分虧缺,影響作物生長[2]。
黃瓜是我國重要的栽培蔬菜之一,目前,中國溫室黃瓜大多采用傳統的“肥大水勤”的營養液管理方式,不僅造成養分浪費,也污染環境[3]。 黃瓜大苗定植便于集中管理,可降低整個溫室能耗,還可有效提高產量和經濟效益[4]。 無土栽培黃瓜育苗時間長,科學按需施肥對提高溫室黃瓜生產效益,降低溫室運營成本具有十分重要的意義。 本試驗擬研究不同營養液EC 對黃瓜幼苗生長、光合和植株礦質元素含量的影響,以期指導黃瓜苗期生產。
1 材料與方法
1.1 試驗材料
試驗于上海市崇明區港沿鎮國家設施農業工程技術研究中心崇明基地“Venlo”型現代溫室中進行,所用黃瓜品種為‘戴多星’,由瑞克斯旺(中國)種子有限公司提供。 栽培基質為巖棉塊(10 cm ×10 cm ×6.5 cm),由荷蘭grodan 公司提供。 使用便攜式電導率儀(DDB-303A,上海雷磁)和pH 測試儀(PHB-4,上海雷磁)測量營養液的EC 值和pH。 用去離子水和可溶性肥料(上海永通生態工程股份有限公司)配制不同EC 的營養液。
1.2 試驗設計
將巖棉塊在苗床上浸泡1 d,浸泡營養液EC 2.0 dS∕m、pH 5.5。 種子于室溫浸種4 h 后,放入培養箱25 ℃條件下催芽,待芽長至0.5 cm 時,播種至巖棉塊,蓋上約2 cm 厚的蛭石,覆薄膜保濕。 出苗后揭開薄膜,溫室白天溫度25 ℃,晚上17 ℃。 至試驗開始前,黃瓜幼苗生長期間保證正常營養液供給,灌溉營養液 EC 2.0 dS∕m、pH 5.5。
試驗設置10 個處理:1)EC0.36; 2)EC0.72; 3)EC1.08; 4)EC1.45; 5)EC2.17; 6)EC2.9; 7)EC4.35;8)EC5.8;9)EC8.5;10)EC11.6,各處理對應的 EC 值分別為 0.36 dS∕m、0.72 dS∕m、1.08 dS∕m、1.45 dS∕m、2.17 dS∕m、2.90 dS∕m、4.35 dS∕m、5.80 dS∕m、8.50 dS∕m、11.60 dS∕m。 使用相同量的 A 和 B母液(表1)進行配制,使用鹽酸(HCl)和氫氧化鈉(NaOH)將營養液的pH 調節至5.5[5]。 待苗長至2 葉1心時進行處理。 試驗期間模擬潮汐灌溉,每周灌溉3—4 次,保持各處理EC 水平穩定。 每個處理4 株黃瓜,重復3 次。 兩周后取樣,保存于-80 ℃冰箱備用。
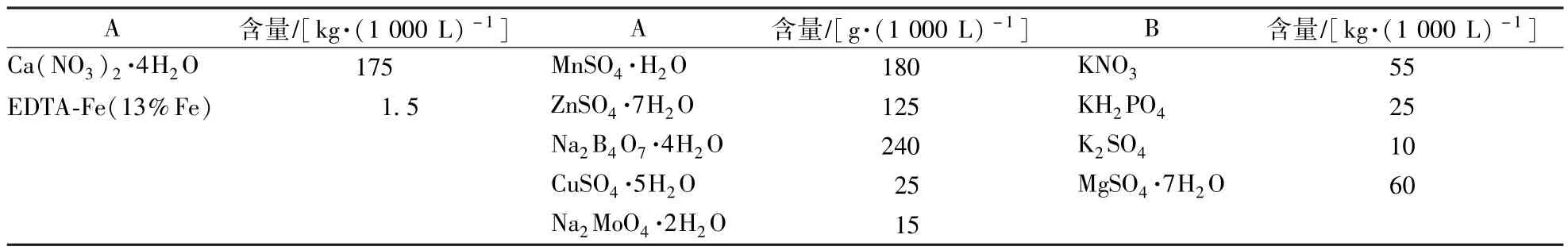
表1 黃瓜營養液母液元素成分(A 罐、B 罐)Table 1 Elements component of the mother nutrient solution of cucumber in different tanks(A,B)
1.3 指標測定
1.3.1 黃瓜生長量
用直尺測量黃瓜株高;選擇植株第2 節位置進行莖粗和葉柄長的測量;測量第2—3 節長度,將其作為節間長度;每個處理隨機挑選5 株稱鮮重,之后將植株放入烘箱,105°C 下殺青2 h,80°C 烘3 d,稱植株干重。
1.3.2 氣體交換參數
利用PP-Systems 公司生產的CIRAS-3 型便攜式光合儀測量植株中部展開最大功能葉凈光合速率(Pn)、氣孔導度(Gs)、胞間二氧化碳濃度(Ci)、蒸騰速率(Tr)。 光照強度設置為 1 000 μmol∕(m2·s),溫度、濕度、CO2濃度為溫室自然條件。 所有處理重復測定5 次,結果以平均值±標準差表示。
1.3.3 葉綠素和類胡蘿卜素含量
取葉片組織0.1 g,用10 mL 95%的乙醇遮光下抽提至少3 d,不時晃動至葉片全部變白,取上清液,并用紫外可見分光光度計在665 nm、649 nm 和470 nm 下測量吸光值,葉綠素a、b 和類胡蘿卜素的含量參考Jiang 等[6]的方法計算。
1.3.4 礦物質元素含量
礦物質元素含量委托歐陸分析技術服務(蘇州)有限公司進行測定,植株總氮含量(N-total)采用近紅外分析法測定;鉬含量(Mo)通過電感耦合等離子體質譜儀(ICP-MS)測定,磷(P)、鉀(K)、鈣(Ca)、鎂(Mg)、鋅(Zn)、硫(S)、鐵(Fe)、錳(Mn)、硼(B)和銅(Cu)采用電感耦合等離子體原子發射光譜法(ICP-AES)測定。
1.4 統計分析
使用SAS 9.3 軟件對各處理進行統計分析,結果以平均值±標準差表示,不同小寫字母表示在P<0.05 水平上差異顯著。 使用Origin 7.5 軟件進行作圖。
2 結果與分析
2.1 不同EC 處理對黃瓜生長參數的影響
從圖1可知,低EC 和高EC 處理的黃瓜幼苗相對矮小,低EC 處理植株葉色較淡,高EC 處理植株基質底部根系很少。

圖1 不同EC 處理對黃瓜植株和根系生長的影響Fig.1 Effects of different EC treatments on the growth of cucumber seedlings and roots
由圖2 可知,EC1.08、EC1.45、EC2.17、EC2.9、EC4.35、EC8.5 處理黃瓜株高較大,處理間差異不顯著,EC0.36 處理株高最小;EC2.17、EC2.9、EC5.8 黃瓜莖粗較大,處理間差異不顯著,EC0.36 和EC11.6處理莖粗最小;EC0.72、EC1.08、EC1.45、EC2.17、EC2.9、EC4.35 處理黃瓜節間長度較大,處理間差異不顯著,EC0.36 處理節間長度最小;EC2.17、EC2.9 黃瓜葉柄長較大,處理間差異不顯著,EC0.72 和EC11.6 處理葉柄長較小;EC2.17、EC2.9、EC4.35 黃瓜植株鮮重較大,處理間差異不顯著,EC0.36 和EC11.6 處理植株鮮重較小;EC1.08、EC1.45、EC2.17、EC2.9 和 EC4.35 黃瓜植株干重較大,處理間差異不顯著,其他處理較低,其中EC0.36 和EC11.6 處理干重較小。

圖2 不同EC 處理對黃瓜株高、莖粗、節間長度、葉柄長、植株鮮重、植株干重的影響Fig.2 Effects of different EC treatments on plant height,stem diameter,internode length,petiole length,seedlings fresh weight and dry weight of cucumber
2.2 不同EC 處理對黃瓜葉片氣體交換參數的影響
從圖 3 可知,EC0.72、EC1.08、EC1.45、EC2.17、EC2.9、EC4.35 和 EC5.8 處理黃瓜的凈光合速率較大,處理間差異不顯著,EC11.6 處理的凈光合速率較小;EC1.08、EC1.45、EC2.17、EC2.9 處理黃瓜葉片氣孔導度較高,處理間差異不顯著,其他處理較低;EC0.72、EC1.08、EC1.45、EC2.17、EC2.9 和 EC4.35 處理葉片胞間二氧化碳濃度較大,處理間差異不顯著,其他處理較低;EC2.17 和EC2.9 葉片蒸騰速率較大。綜上,黃瓜葉片凈光合速率、氣孔導度、胞間二氧化碳濃度、蒸騰速率以EC11.6 處理最低,其次為EC8.5和EC0.36 處理。
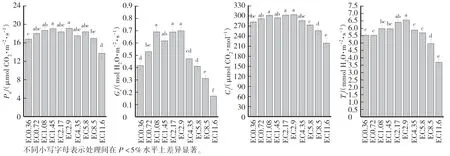
圖3 不同EC 處理對黃瓜葉片氣體交換參數的影響Fig.3 Effects of different EC treatments on gas exchange parameters of cucumber leaves
2.3 不同EC 處理對黃瓜葉片葉綠素、類胡蘿卜素含量的影響
不同EC 營養液處理后,黃瓜葉綠素a、b、總葉綠素和類胡蘿卜素變化較為一致,均以EC0.36 處理最低,EC0.72 處理次之,其他處理間差異不顯著(圖4)。
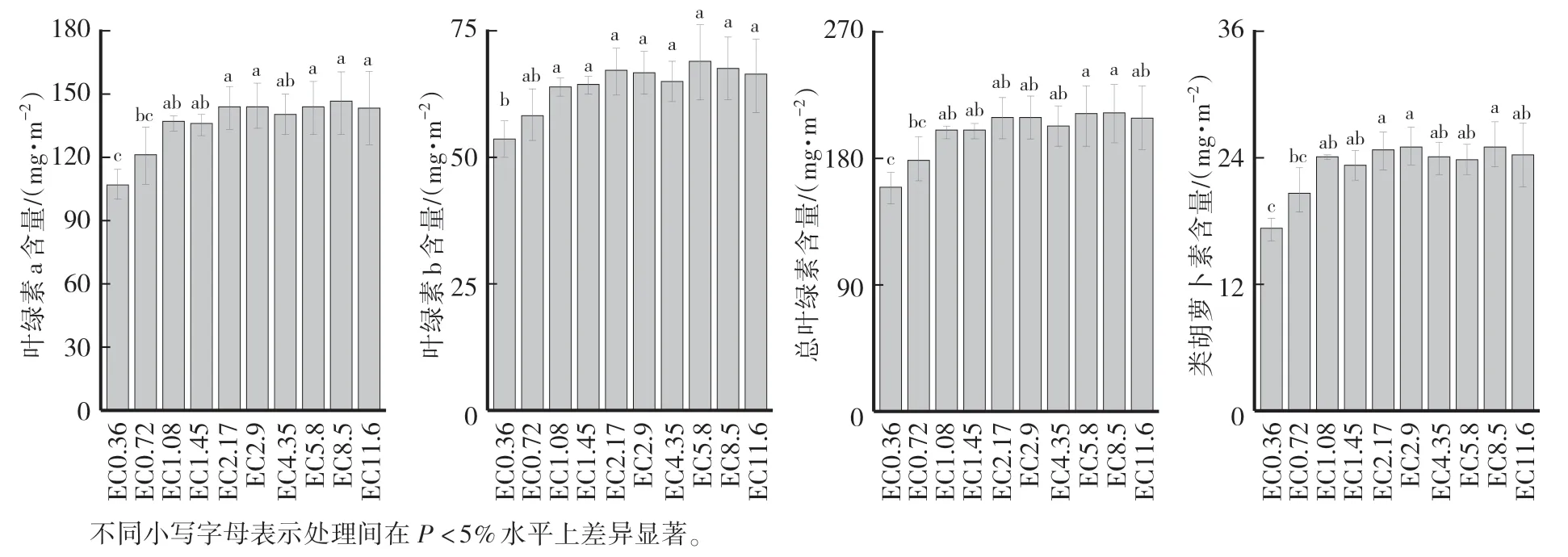
圖4 不同EC 處理對黃瓜葉片葉綠素a、b、總葉綠素和類胡蘿卜素含量的影響Fig.4 Effects of different EC treatments on chlorophyll a,b,total chlorophyll content and carotenoid content of cucumber leaves
2.4 不同EC 處理對黃瓜植株各元素含量的影響
從圖5 可知,黃瓜植株總N 含量隨著營養液EC 升高呈先升高后降低趨勢,EC2.9 處理達到最高;植株K 含量也隨著EC 升高而升高,當EC 達2.9 dS∕m 時,K 含量不再升高;隨EC 的升高,植株P 含量呈先降低后升高又降低趨勢;植株Ca 含量隨著EC 升高呈先升高而后略降低的趨勢,EC2.17 處理最大;植株Mg 含量隨著EC 增加而升高,EC2.9 處理最大,之后隨著EC 增加變化不大或略有降低;EC0.36 處理植株S 含量最低,EC11.6 處理最高。
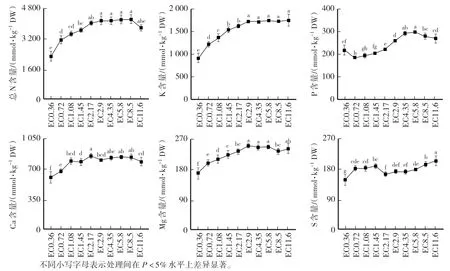
圖5 不同EC 處理對黃瓜植株大量元素含量的影響Fig.5 Effects of different EC treatments on macroelements content of cucumber plants
從圖6 可知,隨著營養液EC 的升高,黃瓜植株Fe 含量出現先降低后升高的趨勢;植株Mn 含量在低、中EC 處理時含量較低,高EC 處理時含量相對較高;EC2.17 和EC4.35 處理植株Zn 含量最高,低EC 和高EC 處理較低;隨著營養液EC 的增加,植株B 含量逐漸增加;EC0.36 處理植株Cu 含量最高;EC1.45 處理植株Mo 含量最大。
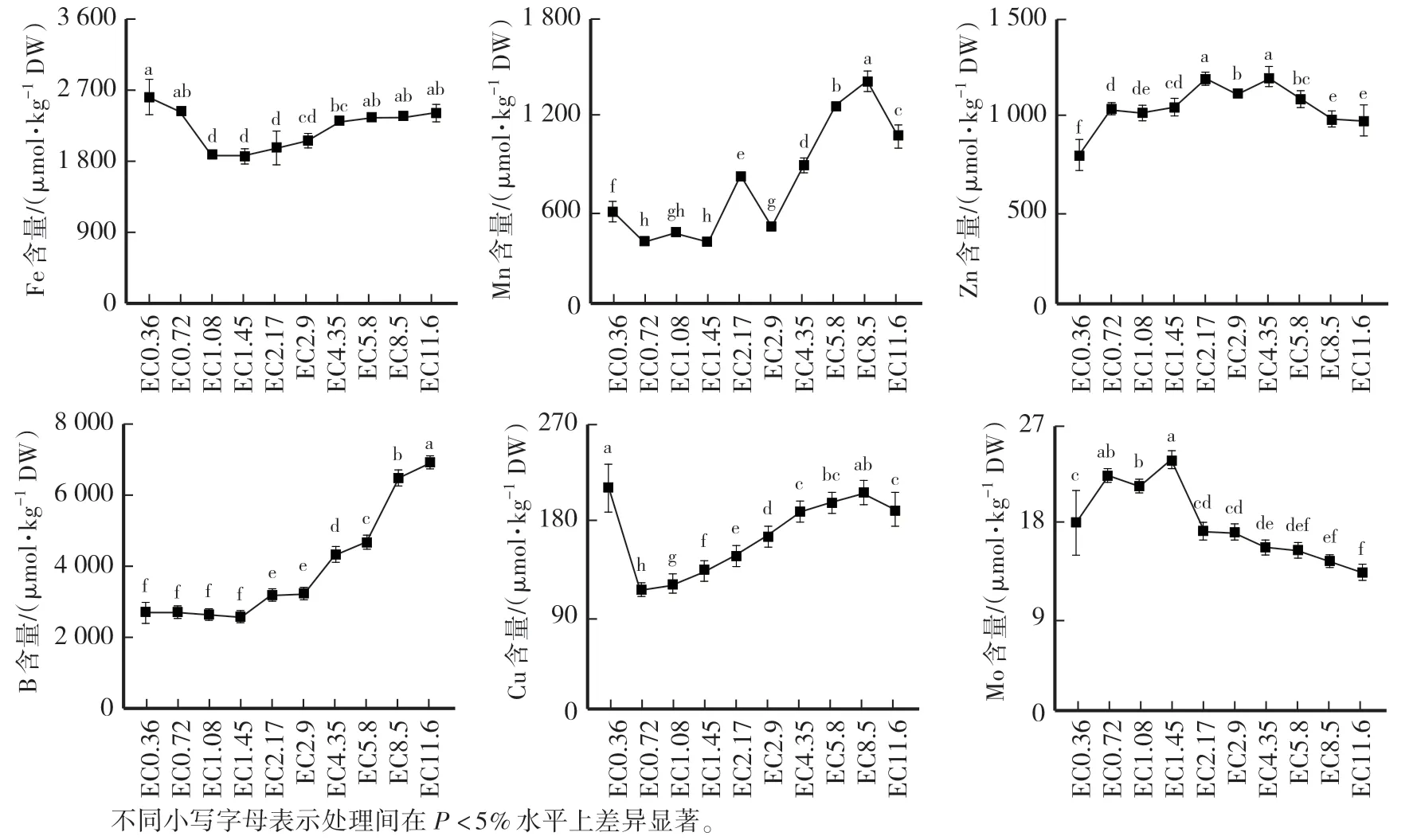
圖6 不同EC 處理對黃瓜植株微量元素含量的影響Fig.6 Effects of different EC treatments on microelements content of cucumber plants
3 結論與討論
本研究中,EC0.36 和EC11.6 處理黃瓜株高、莖粗、節間長度、葉柄長、植株鮮重、植株干重最低,EC2.17 和EC2.9 處理植株鮮重、干重最大,說明營養液電導率過高或者過低會明顯抑制黃瓜植株生長和干物質積累[5]。 Lam 等[7]研究發現,中等 EC 處理(2.0 dS∕m 和 4.0 dS∕m)的植株生長參數最大。 李杰等[8]以不同EC 營養液處理蕹菜發現,EC 為1.5 dS∕m 時,蕹菜的株高、莖粗、葉長和葉寬最大。
過高或過低EC 處理的黃瓜植株凈光合速率較低,氣孔導度表現更為明顯,其原因可能是氣孔限制所致[9]。 倪紀恒等[3]研究表明,營養液EC 為2.5 dS∕m 和2.2 dS∕m 時黃瓜最大光合速率、光能初始利用率、電子傳遞速率和產量顯著大于營養液EC 為1.5 dS∕m 和0.036 dS∕m 時,這也與本研究結果相似。 低EC處理顯著降低了葉片葉綠素a、b、總葉綠素和類胡蘿卜素的含量,這可能是植株在低EC 條件下,營養液元素吸收較少,葉綠素和類胡蘿卜素的合成受到影響所致[7,10]。
植株礦質元素含量的變化也是判斷營養液EC 適宜與否的重要依據[11]。 本試驗中,黃瓜植株大量元素含量先是隨著EC 值的增大而增加,到一定程度后(2.17—5.8 dS∕m),就不再增加,或有所降低,其原因可能是高EC 導致鹽脅迫產生,而鹽脅迫又會影響礦質元素的吸收所致[12-13]。 微量元素也有類似變化,但B 元素含量卻是隨著EC 處理的增大而不斷增加。 這與Ahmadi 等[14]對辣椒的研究結果相似,高EC 處理并不一定增加辣椒葉片中大量元素和微量營養素的含量。 說明黃瓜幼苗對礦質元素尤其是大量元素的吸收有一定的飽和點,當EC 達到2.9 dS∕m 后,大多礦質元素即不能被有效吸收,若繼續增加,會造成肥料浪費,甚至對植物造成鹽脅迫[15]。 礦質元素是植物光合作用、細胞代謝過程所需各種酶的重要組成部分[16-17]。 Hauer-jákli 等[18]研究發現,葉片中Mg 含量對植物生物量積累和光合作用至關重要,但不同植物的凈光合速率都有一個Mg 含量的飽和點,適宜的Mg 含量可以有效提高植物葉片的凈光合速率。 Mn是細胞中重要的還原劑和許多關鍵酶的活化劑,也是葉綠素形成和維持葉綠素正常結構所必須的元素,Mn 缺乏會影響植物光合產物的形成和干物質的積累,并抑制植物地上和地下部生長,降低根冠比;Mn 過量可導致根尖分生組織受損,蛋白質合成受阻,葉綠素a、b 的含量下降,光合速率降低[19]。 另外,植物礦質元素過多會導致元素之間產生拮抗作用[20]。 所以,創造適宜的根系礦質營養環境,提高植物的養分利用效率對植物生長尤其重要[21]。
綜上,EC2.17 和EC2.9 處理的黃瓜植株相對生長最好,光合作用較強,同時礦質元素吸收效率較高。EC0.36、EC0.72 處理植物光合作用較低,干物質積累較少;EC8.5、EC11.6 處理礦質元素吸收效率較低,且對植物根系產生鹽脅迫,導致植物光合作用較低,植物干物質積累較少。

