華蟾素逆轉(zhuǎn)白細(xì)胞介素-17A引起的彌漫大B細(xì)胞淋巴瘤細(xì)胞株對(duì)利妥昔單抗的耐藥
朱園 劉秀丹 朱志剛 李康保 鐘偉杰
廣州市第一人民醫(yī)院1老年病科血液腫瘤科,2超聲醫(yī)學(xué)科,3老年病科消化科(廣州 510180)
彌漫大B細(xì)胞淋巴瘤(DLBCL)是最常見(jiàn)的非霍奇金淋巴瘤亞型,約占25%~35%[1],在我國(guó)占比更高,可達(dá)45%[2]。雖然一線(xiàn)的免疫化療R-CHOP方案改善了DLBCL患者的預(yù)后,但仍有相當(dāng)一部分患者因利妥昔單抗耐藥而出現(xiàn)進(jìn)展或復(fù)發(fā),有研究報(bào)道[3],30%的DLBCL病例對(duì)利妥昔單抗耐藥,既往對(duì)利妥昔單抗治療敏感的B細(xì)胞淋巴瘤病人再次接受治療時(shí),接近60%的病例出現(xiàn)利妥昔單抗耐藥[4]。
腫瘤微環(huán)境中包含有輔助性17細(xì)胞(Th17)和調(diào)節(jié)性T細(xì)胞(Treg),Th17細(xì)胞主要分泌白細(xì)胞介素(IL)-17起作用。新的CD4+T細(xì)胞亞型IL-17+Foxp3+Treg細(xì)胞(IFT)為T(mén)reg和Th17細(xì)胞分化的中間階段細(xì)胞,也可以分泌IL-17。研究發(fā)現(xiàn)[5-6]IFT促進(jìn)食管癌和結(jié)腸癌生長(zhǎng)。IL-17是DLBCL發(fā)生發(fā)展中的關(guān)鍵因素,并與預(yù)后相關(guān)。IL-17在體內(nèi)及體外均促進(jìn)DLBCL的生長(zhǎng)[7]。利妥昔單抗使DLBCL細(xì)胞分泌IL-6增加,促進(jìn)Th17和IFT細(xì)胞表達(dá)增加并分泌IL-17增加,抑制了p53的表達(dá),誘導(dǎo)DLBCL細(xì)胞抵抗利妥昔單抗[8]。
華蟾素(cinobufagin)的主要成分是干蟾皮提取物,所含的蟾蜍苷元及華蟾蜍精具有較強(qiáng)的抗癌作用[9]。華蟾素可增強(qiáng)惡性淋巴瘤的化療效果[10]。華蟾素可抑制消化道腫瘤患者Treg細(xì)胞的數(shù)量[11],降低肺癌患者外周血中IL-17等Th17細(xì)胞相關(guān)細(xì)胞因子的表達(dá)[12]。華蟾素還可調(diào)控肺癌患者Th17和Treg細(xì)胞及IL-17的表達(dá)[9]。上述研究均局限于外周血,而目前尚無(wú)華蟾素對(duì)DLBCL腫瘤微環(huán)境中Th17和Treg細(xì)胞的研究。
本研究通過(guò)體外細(xì)胞共培養(yǎng),構(gòu)建模擬的DLBCL腫瘤微環(huán)境,通過(guò)ELISA、qRT-PCR、流式細(xì)胞術(shù)和細(xì)胞凋亡檢測(cè)等方法,探討華蟾素能否改善IL-17A引起的DLBCL細(xì)胞株對(duì)利妥昔單抗的耐藥,并初步分析其中的機(jī)制。本研究首次在體外實(shí)驗(yàn)中證實(shí)華蟾素能逆轉(zhuǎn)IL-17A引起的DLBCL細(xì)胞株對(duì)利妥昔單抗的耐藥。
1 材料與方法
1.1 材料與細(xì)胞 CCK-8試劑盒購(gòu)買(mǎi)自日本Dojindo公司,Transwell小室購(gòu)買(mǎi)自美國(guó)CORNING公司,重組人IL-17A購(gòu)買(mǎi)自美國(guó)R&D Systems公司,利妥昔單抗(rituximab,0.1 g/100 mL)購(gòu)買(mǎi)自瑞士諾華公司,華蟾素(5 mL/支)購(gòu)買(mǎi)自安徽華潤(rùn)金蟾藥業(yè)股份有限公司。所有ELISA試劑盒、流式抗體和凋亡試劑盒均購(gòu)買(mǎi)自美國(guó)eBioscience公司,western blot抗體均購(gòu)買(mǎi)自美國(guó)Santa Cruz公司。人體外周血單個(gè)核細(xì)胞(PBMCs)是通過(guò)空腹抽取健康志愿者的外周靜脈血10 mL,肝素抗凝,用Ficoll-Hypaque方法分離獲得。人DLBCL細(xì)胞株SU-DHL-2(ABC型)和SU-DHL-4細(xì)胞株(GCB型)購(gòu)買(mǎi)自BNCC(北京,中國(guó))。本研究方案獲得廣州市第一人民醫(yī)院倫理委員會(huì)審查通過(guò),倫理批件號(hào)為K-2019-034-01。
1.2 體外細(xì)胞共培養(yǎng) 本項(xiàng)目包含兩個(gè)體外細(xì)胞共培養(yǎng)實(shí)驗(yàn),分別培養(yǎng)72 h。SU-DHL-2/4細(xì)胞和PBMCs的細(xì)胞濃度均為1×106個(gè)/孔,IL-17A濃度為0.1 ng/mL,利妥昔單抗?jié)舛葹?0 μg/mL,華蟾素用量為注射液原液0.2 mL。分組具體如下:實(shí)驗(yàn)一:分成2大組,各6小組,分組如下:SU-DHL-2單獨(dú);SU-DHL-2+華蟾素;SU-DHL-2+利妥昔單抗;SU-DHL-2+利妥昔單抗+華蟾素;SU-DHL-2+利妥昔單抗+IL-17A;SU-DHL-2+利妥昔單抗+IL-17A+華蟾素;SU-DHL-4單獨(dú);SU-DHL-4+華蟾素;SU-DHL-4+利妥昔單抗;SU-DHL-4+利妥昔單抗+華蟾素;SU-DHL-4+利妥昔單抗+IL-17A;SU-DHL-4+利妥昔單抗+IL-17A+華蟾素。實(shí)驗(yàn)二:將SU-DHL-2/4細(xì)胞、PBMCs按1∶1的比例共培養(yǎng),并使用Transwell小室間接培養(yǎng),加或不加華蟾素,其中SUDHL-2或SU-DHL-4細(xì)胞置于小室中,其他細(xì)胞置于小室外。分組如下:PBMCs+SU-DHL-2;PBMCs+SU-DHL-2+華蟾素;PBMCs+SU-DHL-4;PBMCs+SUDHL-4+華蟾素。
1.3 Western blot 本研究使用western blot檢測(cè)各組SU-DHL-2或SU-DHL-4細(xì)胞中cleaved PARP、cleaved caspase-3和GAPDH蛋白的表達(dá),步驟與方法同文獻(xiàn)[13]。
1.4 流式細(xì)胞術(shù) 調(diào)整細(xì)胞密度為2×106個(gè)/mL。Th17細(xì)胞檢測(cè):在37℃和5%CO2條件下,在培養(yǎng)基中加入50 ng/mL的佛波酯、10 μg/mL的Brefeldin A和1 μg/mL的離子霉素,刺激細(xì)胞5 h。然后用抗CD3-FITC、抗CD8-PE和抗IL-17A-APC抗體在室溫下對(duì)細(xì)胞進(jìn)行染色1 h。Treg細(xì)胞檢測(cè):在室溫下用抗CD25-PE-Cy7、抗CD4-FITC、抗Foxp3-PE和IL-17A-APC抗體進(jìn)行染色1 h。然后上機(jī)分析,使用Flowjo 10軟件分析數(shù)據(jù)。CD3+CD8-IL-17A+細(xì)胞定義為T(mén)h17細(xì)胞,CD4+CD25+Foxp3+IL-17A+細(xì)胞定義為IFT細(xì)胞。
1.5 CCK-8、ELISA和細(xì)胞凋亡測(cè)定 步驟與方法同文獻(xiàn)[13]。
1.6 統(tǒng)計(jì)學(xué)方法 采用SPSS 22.0進(jìn)行分析。計(jì)量資料以均數(shù)±標(biāo)準(zhǔn)差表示。采用Two-tailed independent-sample Student′s t/t檢驗(yàn)對(duì)兩組之間進(jìn)行比較。單因素方差分析和Bonferroni檢驗(yàn)(每?jī)山M之間)用于多組之間的比較。P<0.05認(rèn)為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 華蟾素逆轉(zhuǎn)IL-17A引起的DLBCL細(xì)胞株對(duì)利妥昔單抗的耐藥 前期已經(jīng)證實(shí)IL-17A可引起DLBCL細(xì)胞株對(duì)利妥昔單抗的耐藥[8],本研究旨在探索華蟾素能否逆轉(zhuǎn)IL-17A引起的耐藥。見(jiàn)圖1,華蟾素并不能直接抑制SU-DHL-2或SU-DHL-4細(xì)胞的增殖(SU-DHL-2:P > 0.99;SU-DHL-4:P >0.99);利妥昔單抗可顯著抑制SU-DHL-2或SU-DHL-4細(xì)胞的增殖(SU-DHL-2:P<0.01;SU-DHL-4:P<0.01);而IL-17A明顯減弱了利妥昔單抗抑制SU-DHL-2或SU-DHL-4細(xì)胞增殖的作用,引起耐藥(SU-DHL-2:P<0.01;SU-DHL-4:P<0.01);最后,華蟾素逆轉(zhuǎn)IL-17A引起的SU-DHL-2或SU-DHL-4細(xì)胞對(duì)利妥昔單抗的耐藥(SU-DHL-2:P<0.01;SU-DHL-4:P<0.01)。
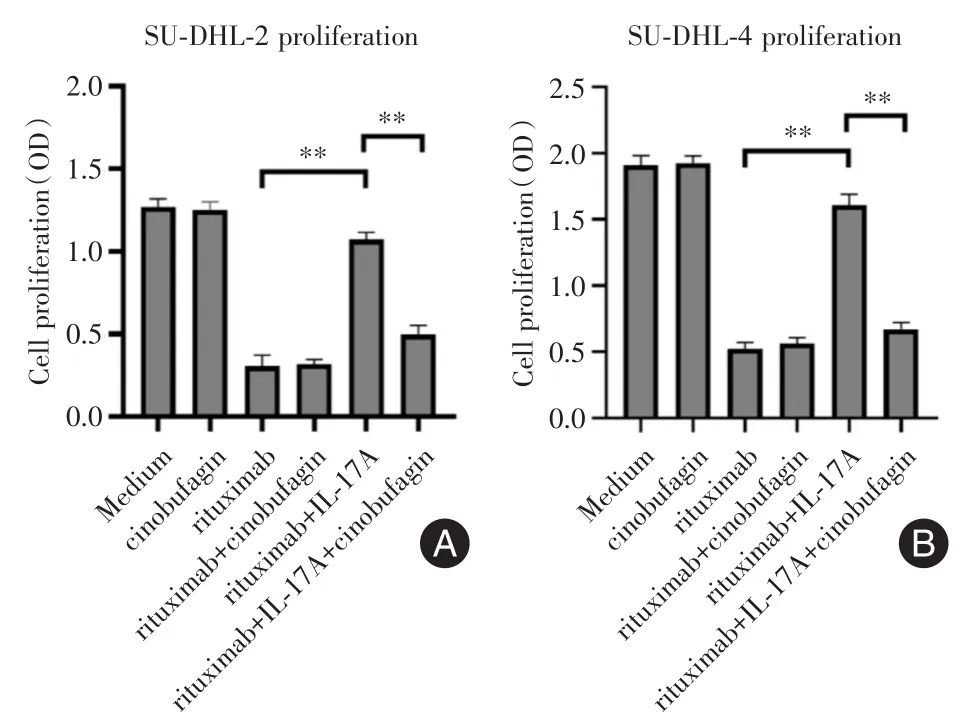
圖1 華蟾素逆轉(zhuǎn)IL-17A引起的DLBCL細(xì)胞株對(duì)利妥昔單抗的耐藥Fig.1 Cinobufagin reversed the rituximab resistance of DLBCL cell lines induced by IL-17A
2.2 華蟾素逆轉(zhuǎn)IL-17A引起的DLBCL細(xì)胞株凋亡率減少 為了進(jìn)一步探討華蟾素逆轉(zhuǎn)IL-17A引起DLBCL細(xì)胞株對(duì)利妥昔單抗耐藥的機(jī)制,筆者檢測(cè)了華蟾素對(duì)DLBCL細(xì)胞株凋亡的影響。圖2A為不同分組中SU-DHL-2或SU-DHL-4細(xì)胞的具有代表性的凋亡流式圖。如圖2B-C所示,利妥昔單抗顯著增加了SU-DHL-2或SU-DHL-4細(xì)胞的凋亡率(SU-DHL-2:P<0.01;SU-DHL-4:P<0.01);而IL-17A加入后,顯著抑制了利妥昔單抗誘發(fā)的SUDHL-2或SU-DHL-4細(xì)胞的凋亡率(SU-DHL-2:P<0.01;SU-DHL-4:P<0.01);而華蟾素又逆轉(zhuǎn)了IL-17A這一作用,增加了SU-DHL-2或SU-DHL-4細(xì)胞的凋亡率(SU-DHL-2:P<0.01;SU-DHL-4:P<0.01)。這些結(jié)果表明華蟾素是通過(guò)增加DLBCL細(xì)胞株的凋亡來(lái)改善IL-17A引起的對(duì)利妥昔單抗的耐藥。
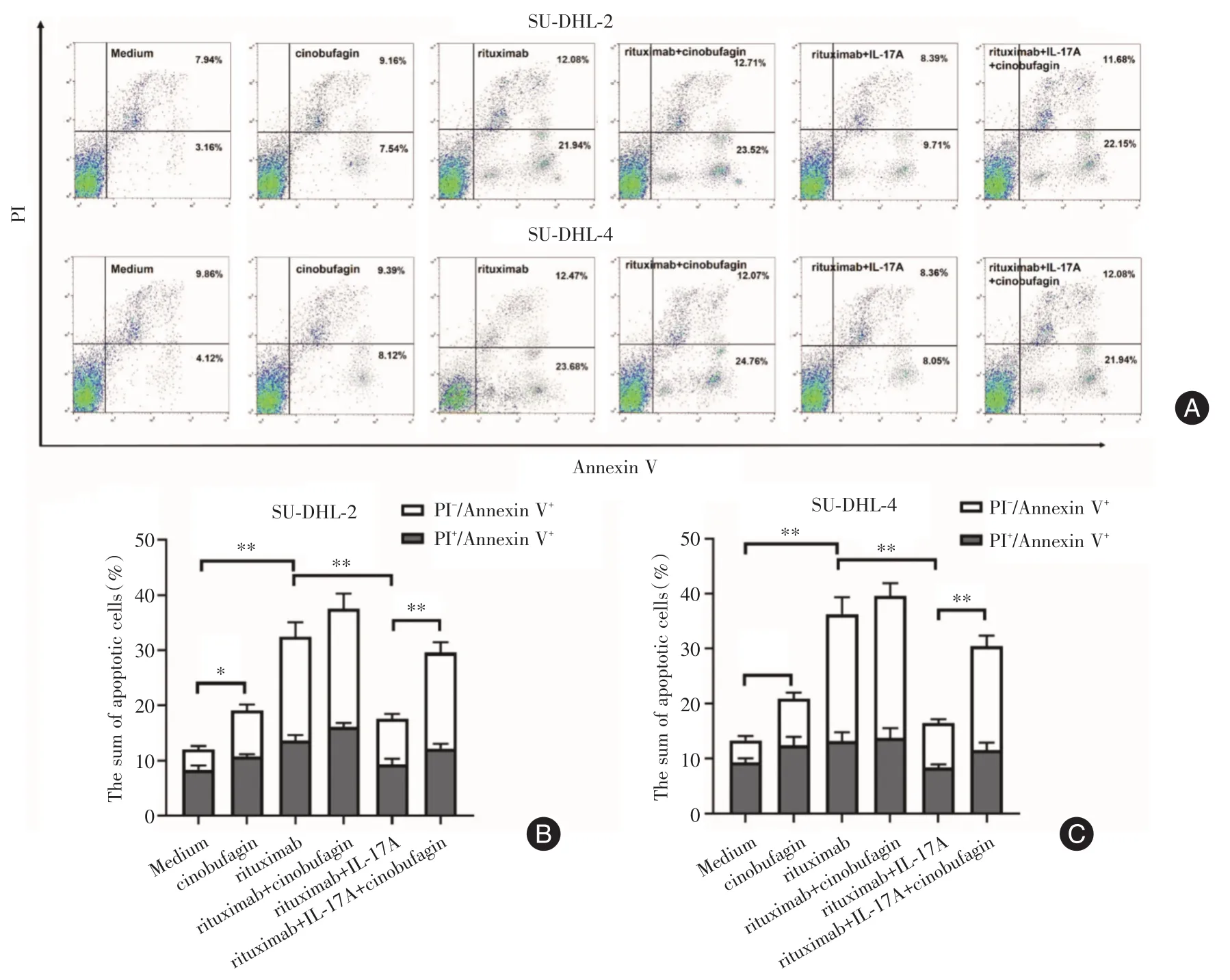
圖2 華蟾素逆轉(zhuǎn)IL-17A引起的DLBCL細(xì)胞株凋亡率減少Fig.2 Cinobufagin reversed the reduced apoptosis rate of DLBCL cell lines induced by IL-17A
2.3 華蟾素通過(guò)升高Cleaved PARP和Cleaved caspase-3的表達(dá)促進(jìn)DLBCL細(xì)胞株的凋亡 進(jìn)一步檢測(cè)華蟾素對(duì)DLBCL細(xì)胞株中常見(jiàn)凋亡信號(hào)通路中的常見(jiàn)蛋白的影響。收集各組中的SUDHL-2或SU-DHL-4細(xì)胞,使用Western blot法檢測(cè)cleaved PARP和cleaved caspase-3的蛋白水平。圖3結(jié)果顯示,與對(duì)照組相比,華蟾素組輕微升高了DLBCL細(xì)胞株內(nèi)cleaved PARP和cleaved caspase-3的蛋白水平,且華蟾素+IL-17A+利妥昔單抗組比IL-17A+利妥昔單抗組DLBCL細(xì)胞株內(nèi)的cleaved PARP和cleaved caspase-3的蛋白水平顯著升高。這些結(jié)果提示,華蟾素可能通過(guò)升高cleaved PARP和cleaved caspase-3表達(dá)促進(jìn)DLBCL細(xì)胞株的凋亡。
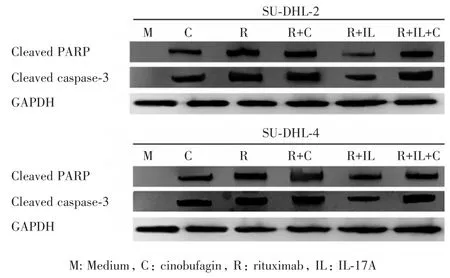
圖3 華蟾素通過(guò)升高SU-DHL-2和SU-DHL-4細(xì)胞中cleaved PARP和cleaved caspase-3的表達(dá)Fig.3 Cinobufagin increased the expressions of cleaved PARP and cleaved caspase-3 in SU-DHL-2 and SU-DHL-4 cells
2.4 華蟾素抑制腫瘤微環(huán)境中Th17和IFT細(xì)胞的分化,降低IL-17A水平 除了直接影響DLBCL細(xì)胞株的凋亡以外,還進(jìn)一步研究華蟾素對(duì)腫瘤微環(huán)境中Th17和IFT細(xì)胞的分化及IL-17A水平的影響。見(jiàn)圖4B、D,華蟾素顯著抑制SU-DHL-2或SU-DHL-4細(xì)胞微環(huán)境中 Th17(SU-DHL-2:P=0.011;SU-DHL-4:P=0.025)和IFT細(xì)胞(SU-DHL-2:P<0.01;SU-DHL-4:P=0.017)的分化。而且,華蟾素也顯著減低SU-DHL-2或SU-DHL-4細(xì)胞微環(huán)境中IL-17A的水平(SU-DHL-2:P<0.01;SUDHL-4:P<0.01)(圖4E),但對(duì)TGF-β和IL-10水平無(wú)影響(圖4F-G)。
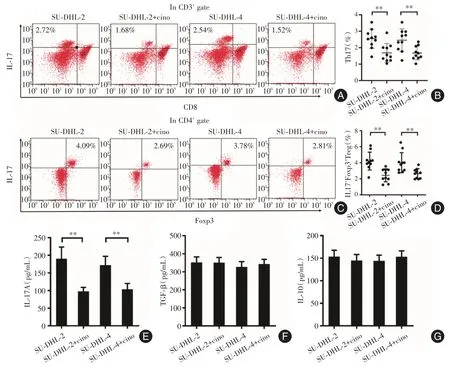
圖4 華蟾素抑制腫瘤微環(huán)境中Th17和IFT細(xì)胞的分化,降低IL-17A水平Fig.4 Cinobufagin inhibited the differentiation of Th17 and IFT cells in tumor microenvironment,and then decreased the level of IL-17A
3 討論
初治DLBCL患者中有約40%最終會(huì)復(fù)發(fā)或進(jìn)展,這些患者的3年無(wú)疾病進(jìn)展生存率僅為37%,總生存率僅為49%,預(yù)后非常差,而獲得性的利妥昔單抗耐藥是其中的重要原因[14]。因此,探索并闡明利妥昔單抗耐藥的機(jī)制以及找到逆轉(zhuǎn)利妥昔單抗耐藥的藥物非常重要。導(dǎo)致利妥昔單抗耐藥的原因很多,主要包括以下三方面:CD20結(jié)構(gòu)功能異常、補(bǔ)體和抗凋亡蛋白異常表達(dá)抑制利妥昔單抗作用和腫瘤微環(huán)境的改變等[15]。前期研究[8,16]證實(shí)利妥昔單抗可促進(jìn)DLBCL腫瘤微環(huán)境中IL-17A水平升高,IL-17A導(dǎo)致DLBCL細(xì)胞株凋亡減少,引起利妥昔單抗耐藥。
本研究結(jié)果證實(shí),外源性IL-17A在體外可構(gòu)建DLBCL細(xì)胞株對(duì)利妥昔單抗的耐藥模型,而華蟾素通過(guò):(1)升高cleaved PARP和cleaved caspase-3的表達(dá)促進(jìn)DLBCL細(xì)胞株的凋亡;(2)抑制腫瘤微環(huán)境中Th17和IFT細(xì)胞的分化降低IL-17A水平這兩方面作用,最終逆轉(zhuǎn)IL-17A引起的DLBCL細(xì)胞株對(duì)利妥昔單抗的耐藥。
IL-17A是IL-17家族6個(gè)成員(IL-17A-F)中之一,主要來(lái)源于Th17細(xì)胞,部分來(lái)源于IFT細(xì)胞,IL-17A是構(gòu)成腫瘤微環(huán)境的重要成分之一[17]。IFT細(xì)胞是Treg和Th17細(xì)胞之間的一種中間形態(tài),早已被證實(shí)能分泌IL-17A[18]。IL-17A已被多項(xiàng)研究證實(shí)能促進(jìn)卵巢癌、結(jié)腸癌等腫瘤的化療或靶向藥物耐藥[19-20]。而且,前期研究[8,16]已經(jīng)證實(shí)IL-17A可引起DLBCL對(duì)利妥昔單抗的耐藥。本研究中通過(guò)外源性IL-17A順利構(gòu)建DLBCL細(xì)胞株對(duì)利妥昔單抗的耐藥模型,與之前的研究結(jié)論一致。因此,如何能降低腫瘤微環(huán)境中IL-17A水平或拮抗IL-17A作用成為改善DLBCL對(duì)利妥昔單抗耐藥的關(guān)鍵因素。
華蟾素是我國(guó)中藥瑰寶之一,是我國(guó)蟾蜍科動(dòng)物中華大蟾蜍的全皮陰干后,經(jīng)提取加工處理,制成的水溶性成分,主要成分包括蟾毒內(nèi)酯類(lèi)、吲哚生物堿類(lèi)、多肽、膽固醇等[21]。華蟾素已被廣泛應(yīng)用于肺癌、肝癌、乳腺癌、結(jié)直腸癌等惡性腫瘤中,均取得明顯抑瘤作用[22]。相比于西醫(yī)藥物,華蟾素優(yōu)勢(shì)在于其具有抑制腫瘤細(xì)胞增殖、誘導(dǎo)腫瘤細(xì)胞凋亡、放化療增敏及逆轉(zhuǎn)耐藥等作用[22]。LIU等[23]發(fā)現(xiàn)華蟾素能逆轉(zhuǎn)鼻咽癌對(duì)順鉑藥物化療的耐藥性,王玲等[24]也發(fā)現(xiàn)華蟾素能逆轉(zhuǎn)人乳腺癌細(xì)胞對(duì)阿霉素的耐藥。而且,華蟾素能降低肺癌患者外周血中IL-17等Th17細(xì)胞相關(guān)細(xì)胞因子的表達(dá)[12],可調(diào)控肺癌患者Th17和Treg細(xì)胞及IL-17的表達(dá)[9]。cleaved PARP和cleaved caspase-3是細(xì)胞凋亡通路中的兩種重要蛋白,這兩者水平升高,提示細(xì)胞凋亡率增高[25]。ZHANG等[26]研究發(fā)現(xiàn)華蟾素能升高cleaved PARP和cleaved caspase-3蛋白的表達(dá)而促進(jìn)葡萄膜黑色素瘤細(xì)胞凋亡。與上述前期研究一致,本研究體外實(shí)驗(yàn)證實(shí)華蟾素升高cleaved PARP和cleaved caspase-3的表達(dá)促進(jìn)DLBCL細(xì)胞株的凋亡,抑制腫瘤微環(huán)境中Th17和IFT細(xì)胞的分化降低IL-17A水平,最終逆轉(zhuǎn)IL-17A引起的DLBCL對(duì)利妥昔單抗的耐藥。這個(gè)結(jié)果進(jìn)一步證實(shí)了華蟾素在逆轉(zhuǎn)化療耐藥上具有獨(dú)特的優(yōu)勢(shì)。
綜上所述,本研究證實(shí)華蟾素在體外升高cleaved PARP和cleaved caspase-3的表達(dá)促進(jìn)DLBCL細(xì)胞株的凋亡,抑制腫瘤微環(huán)境中Th17和IFT細(xì)胞的分化降低IL-17A水平,最終逆轉(zhuǎn)IL-17A引起的DLBCL對(duì)利妥昔單抗的耐藥。未來(lái)希望能進(jìn)一步在動(dòng)物實(shí)驗(yàn)或者人體試驗(yàn)中證實(shí)華蟾素逆轉(zhuǎn)利妥昔單抗耐藥的作用,為未來(lái)臨床上應(yīng)用華蟾素聯(lián)合傳統(tǒng)免疫化療藥物治療DLBCL患者提供更充實(shí)的證據(jù)。華蟾素未來(lái)有望成為DLBCL治療的聯(lián)合用藥之一。

