血清外泌體miR-24水平與老年進展性腔隙性腦梗死、頸動脈硬化的關系*
張選琴,羅 丹
重慶醫科大學附屬第一醫院大足醫院/重慶市大足區人民醫院神經內科,重慶 402360
腔隙性腦梗死屬于缺血性腦梗死的一種亞型,部分呈亞急性或進展性。腔隙性腦梗死患者因穿支動脈供血區閉塞、急性壞死而缺血,在大腦半球深部或腦干形成病灶,其特點是易形成圓形或卵圓形、直徑為3~15 mm、充滿液體的腔隙。根據病變部位不同,腔隙性腦梗死可出現多種并發癥,如血管性認知功能障礙。多數腔隙性腦梗死患者病情較輕,預后良好,但仍有部分患者,尤其是老年患者,由于合并多種危險因素,易在發病數小時至1周內發生神經功能進一步損傷加重,即發展為進展性腔隙性腦梗死,而國內外尚缺乏有效的治療手段阻止這一疾病進展[1]。頸動脈粥樣硬化斑塊是引起腦梗死的可能原因之一,在狹窄部位下游的血管區域易引起腔隙性血管病變,而且頸動脈硬化對進展性腔隙性腦梗死也有一定的預測價值。JIANG等[2]學者通過建立大鼠大腦中動脈閉塞模型,發現miR-24在大鼠大腦中動脈閉塞模型中表達降低,且該模型的腦梗死面積百分比和血清總膽固醇(TC)、三酰甘油(TG)、高密度脂蛋白膽固醇(HDL-C)水平也升高。故本研究通過分析血清外泌體miR-24水平與老年進展性腔隙性腦梗死、頸動脈硬化的關系,為腔隙性腦梗死進展機制和預防治療提供循證醫學證據。
1 資料與方法
1.1一般資料 選擇本院2018年5月至2020年6月收治的急性腔隙性腦梗死患者120例為研究對象,其中男75例,女45例;年齡65~89歲,平均(73.40±6.85)歲;根據病情是否進展將患者分為進展組32例,非進展組88例。納入標準:(1)首次發病;(2)經頭顱MRI彌散加權序列技術確診,符合第四屆腦血管學術會議制定的腔隙性腦梗死診斷標準;(3)完善頭顱三維時間飛躍磁共振血管成像(3D TOF-MRA)和(或)頭顱電子計算機斷層掃描(CT)檢查,證實有與癥狀、體征相符的出血病灶;(4)發病至入院時間≤48 h;(5)患者年齡≥65歲。排除標準:(1)心源性梗死、大動脈炎引發的腦梗死或再發腦梗死;(2)合并腦外傷、腦出血或顱內占位性病變;(3)合并感染性疾病、惡性腫瘤或心、肝、腎功能障礙。所有研究對象均自愿參與本研究,并簽署知情同意書,本研究經本院醫學倫理委員會批準,且遵循《赫爾辛基宣言》。
1.2方法
1.2.1收集基礎資料 收集所有患者的基線資料,包括年齡、性別、美國國立衛生研究院卒中量表(NIHSS)評分(入院當天及入院后7 d)、腦血管疾病危險因素(包括吸煙史、飲酒史、糖尿病史、高血壓史、高脂血癥史);入院1 d內進行體格檢查;采用全自動血細胞計數儀(日本希森美康XS-900i型)進行血常規檢測,包括白細胞計數(WBC)、血小板計數(PLT)、中性粒細胞絕對值(NEU#)、淋巴細胞絕對值(LYM#)等;采用全自動生化分析儀(日本日立3100型)檢測TC、TG、低密度脂蛋白膽固醇(LDL-C)、HDL-C和空腹血糖(FBG)。
1.2.2病情進展判斷 患者入院后7 d復查NIHSS評分相較入院時增加≥2分,視作病情進展。
1.2.3頸動脈超聲檢查 所有患者入院時,使用高分辨率的Philips ie33彩色多普勒超聲儀評估雙側頸總動脈(CCA)、頸總動脈分叉部(BIF)、頸內動脈顱外段(ICA)的頸內動脈中層厚度(IMT),每組3次,平均IMT取左右兩側CCA遠端1 cm處的平均值。以局限性內膜增厚≥1.2 mm或≥50%周圍IMT,且局部隆起,向管內突出,定義為斑塊形成。根據超聲檢查結果顯示的回聲性質確定斑塊的穩定性:易損斑塊(局部低回聲、等回聲或混合回聲)、穩定斑塊(高、強回聲)。根據Crouse積分法評估斑塊嚴重程度,評分為雙側頸動脈CCA、BIF、ICA部分的近端、遠端分數總和(0~12分)。
1.2.4血清外泌體提取及鑒定 所有患者入院時采集清晨空腹外周靜脈血5 mL,3 000 r/min離心10 min,分離血清,在—80 ℃低溫冰箱中儲存待測。外泌體根據外泌體分離試劑盒(Invitrogen Life Technologies公司)說明書分離,將血清離心(30 min,8 000 r/min)去除細胞和碎片,然后將獲得的上清液與外泌體分離試劑充分混合,在4 ℃下孵育30 min,再在室溫下離心(10 min,10 000 r/min)去除上清液,試管底部的外泌體用磷酸鹽緩沖液重懸。將提取的血清外泌體置于透射電子顯微鏡下觀察。采用Western blot法檢測CD61、CD9、TSG101、CYC1和GRP94蛋白表達情況。方法如下:利用RIPA蛋白酶裂解液(上海聯邁生物科技有限公司)提取外泌體總蛋白,使用二喹啉甲酸標準曲線法定量蛋白水平,取蛋白30 μg進行十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳(8%)分離并轉移至聚偏二氟乙烯膜上。應用含5%脫脂奶粉的洗膜緩沖液室溫封閉1 h后,加入CD61(1∶1 000)、CD9(1∶1 000)、TSG101(1∶1 500)、CYC1(1∶1 000)和GRP94(1∶2 000)一級抗體(英國Abcam公司),4 ℃孵育過夜,然后用TBST沖洗3次,每次10 min。再加入二級抗體抗孵育1 h,用TBST沖洗3次,每次10 min。利用Odyssey雙色紅外熒光成像系統(美國LI-COR公司)分析蛋白電泳條帶的灰度值,計算蛋白表達量,使用甘油醛-3-磷酸脫氫酶(GAPDH)作為內參。所有試驗均重復 3 次,取平均值。
1.2.5血清外泌體miR-24水平檢測 將外泌體標本與TRIzol試劑(賽默飛世爾科技公司)混合,裂解提取總RNA。采用Agilent 2100生物分析儀檢測RNA標本的完整性和水平。用PrimeScriptTMRT試劑盒(大連Takara Biotechnology公司)和5 μL RNA標本配制15 μL反轉錄反應體系,反應條件:16 ℃ 30 min,42 ℃ 30 min和85 ℃ 5 min。將獲得的cDNA標本儲存在—20 ℃低溫冰箱中。miR-24引物片段擴增使用SYBR PrimeScript miRNA RT-PCR試劑盒(大連Takara Biotechnology公司),選擇小分子U6作為內源性參考基因。PCR擴增條件:95 ℃預變性10 min,1個循環;95 ℃變性15 s,60 ℃退火1 min,72 ℃延伸30 s,共40個熱循環。所有反應均平行進行3次,取均值表示。測定Ct值,以2—ΔΔCt法計算結果,用參考基因U6 mRNA作為血清表達的內部標準化控制。miR-24引物序列:正向5′-TGTTCCTGCTGAACTGAGCC-3′,反向5′-CTCTGCCTCCCGTGCCTA-3′;U6 mRNA引物序列:正向5′-CGCTTCGGCAGCACATATAC-3′,反向5′-CAGGGCCATGCTAATCTT-3′。

2 結 果
2.1非進展組和進展組基線資料比較 非進展組與和進展組的年齡、性別、體質量指數、危險因素(吸煙史、飲酒史、糖尿病史、高血壓史、高脂血癥史)、入院時NIHSS評分、PLT、LYM#、TG、HDL-C等指標比較,差異均無統計學意義(P>0.05)。進展組WBC、NEU#、TC、LDL-C、FBG水平均明顯高于非進展組,差異有統計學意義(P<0.05)。見表1。

表1 兩組患者基線資料比較
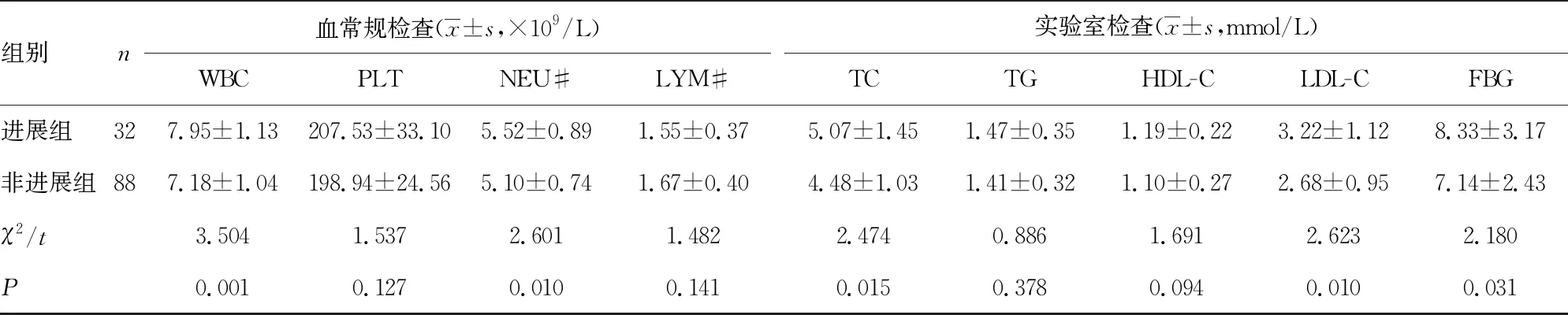
組別n血常規檢查(x±s,×109/L)WBCPLTNEU#LYM#實驗室檢查(x±s,mmol/L)TCTGHDL-CLDL-CFBG進展組327.95±1.13207.53±33.105.52±0.891.55±0.375.07±1.451.47±0.351.19±0.223.22±1.128.33±3.17非進展組887.18±1.04198.94±24.565.10±0.741.67±0.404.48±1.031.41±0.321.10±0.272.68±0.957.14±2.43χ2/t3.5041.5372.6011.4822.4740.8861.6912.6232.180P0.0010.1270.0100.1410.0150.3780.0940.0100.031
2.2血清外泌體提取及鑒定結果 將提取的血清外泌體置于透射電子顯微鏡下觀察,典型的顯微照片顯示囊泡呈圓形或橢圓形,直徑為30~150 nm,見圖1。經Western blot法檢測,在分離出的外泌體顆粒標本中出現外泌體蛋白標記CD61、CD9、TSG101蛋白特異性條帶,而在外泌體缺失的上清液中沒有特異性條帶;此外,CYC1和GRP94蛋白呈陰性表達。見圖2。
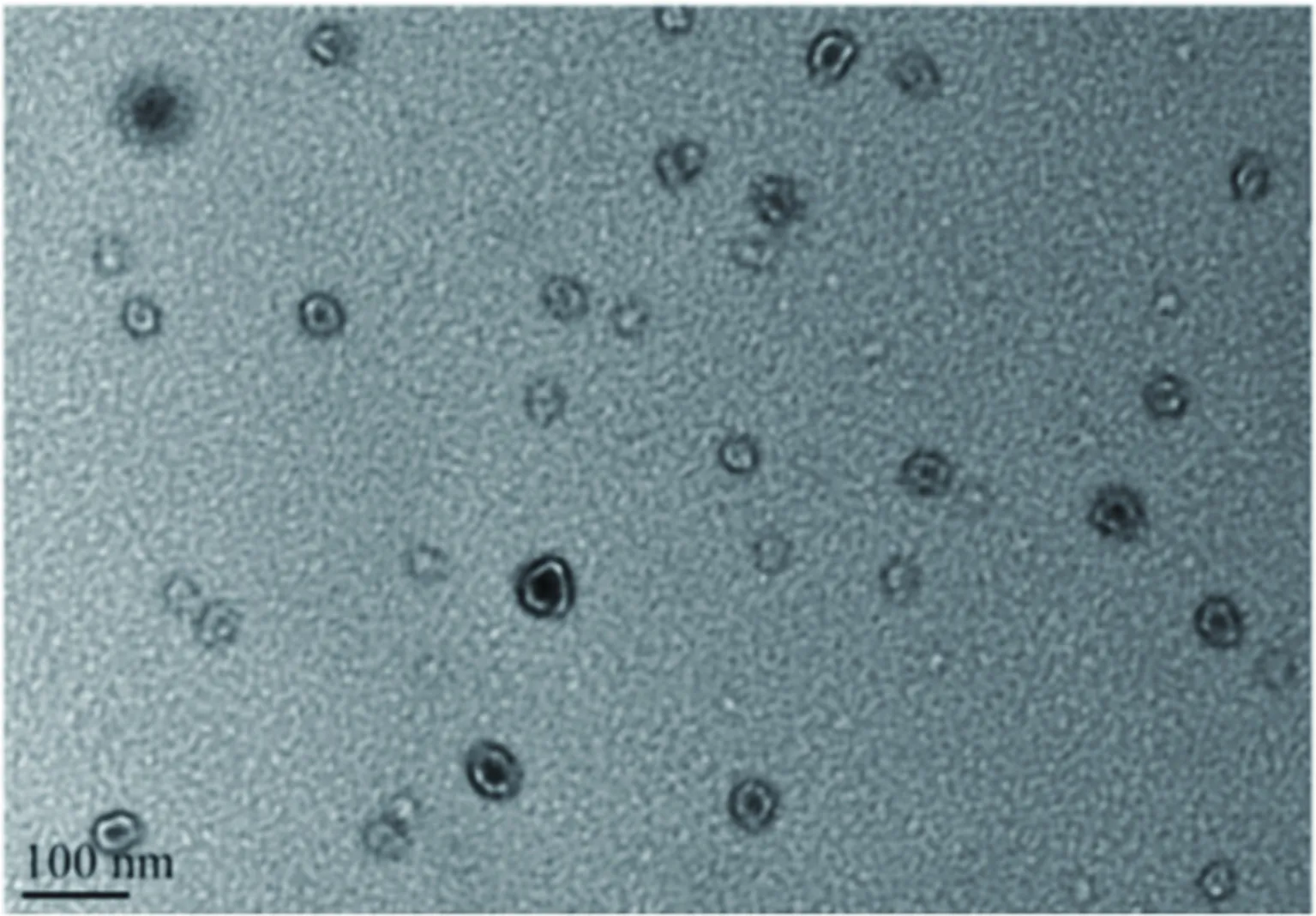
圖1 血清外泌體透射電鏡下觀察囊泡形態(×12 000)
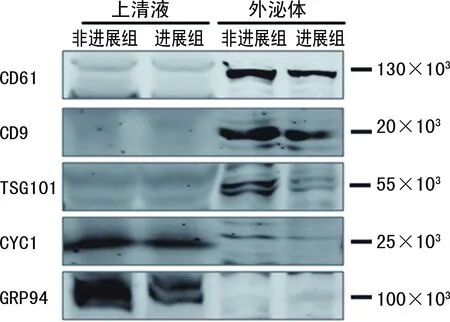
圖2 外泌體標志蛋白表達情況
2.3非進展組和進展組血清外泌體miR-24水平比較 入院時非進展組和進展組血清外泌體miR-24水平分別為1.00±0.09和0.76±0.21,進展組血清外泌體miR-24水平明顯低于非進展組,差異有統計學意義(P<0.05)。
2.4進展性腔隙性腦梗死發生的影響因素分析 以進展性腔隙性腦梗死(進展=1,未發生進展=0)作為因變量,將WBC、NEU#、TC、LDL-C、FBG、血清外泌體miR-24作為自變量,對進展性腔隙性腦梗死的影響因素進行多因素Logistic回歸分析,結果顯示血清外泌體miR-24降低,NEU#和LDL-C水平升高是急性腔隙性腦梗死患者發生進展的獨立危險因素(P<0.05)。見表2。
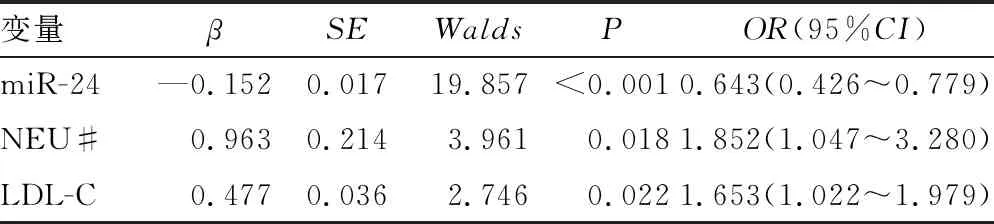
表2 多因素Logistic回歸分析進展性腔隙性腦梗死的影響因素
2.5入院時血清外泌體miR-24水平對進展性腔隙性腦梗死的預測價值 ROC曲線分析結果顯示,入院時血清外泌體miR-24預測進展性腔隙性腦梗死的AUC為0.793(95%CI:0.650~0.861),cut-off值為0.805,在該閾值下,特異度和靈敏度分別為92.5%和58.6%。見圖3。
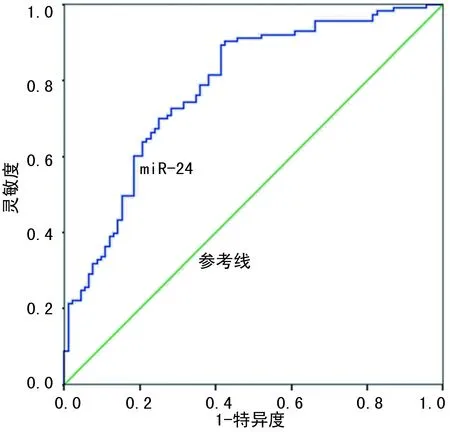
圖3 血清外泌體miR-24預測進展性腔隙性腦梗死的ROC曲線
2.6兩組頸動脈斑塊檢出情況、IMT、Crouse積分比較 進展組和非進展組患者分別檢出65塊和123塊頸動脈斑塊,進展組斑塊檢出率高于非進展組,且易損斑塊檢出率更高,差異有統計學意義(P<0.05);另外,進展組Crouse積分高于非進展組,差異有統計學意義(P<0.05)。見表3。

表3 兩組頸動脈斑塊檢出情況、IMT、Crouse積分比較
2.7血清外泌體miR-24水平與頸動脈斑塊Crouse積分的關系 經Pearson相關分析,miR-24水平與頸動脈斑塊Crouse積分呈負相關(r=—0.793,P<0.001)。見圖4。
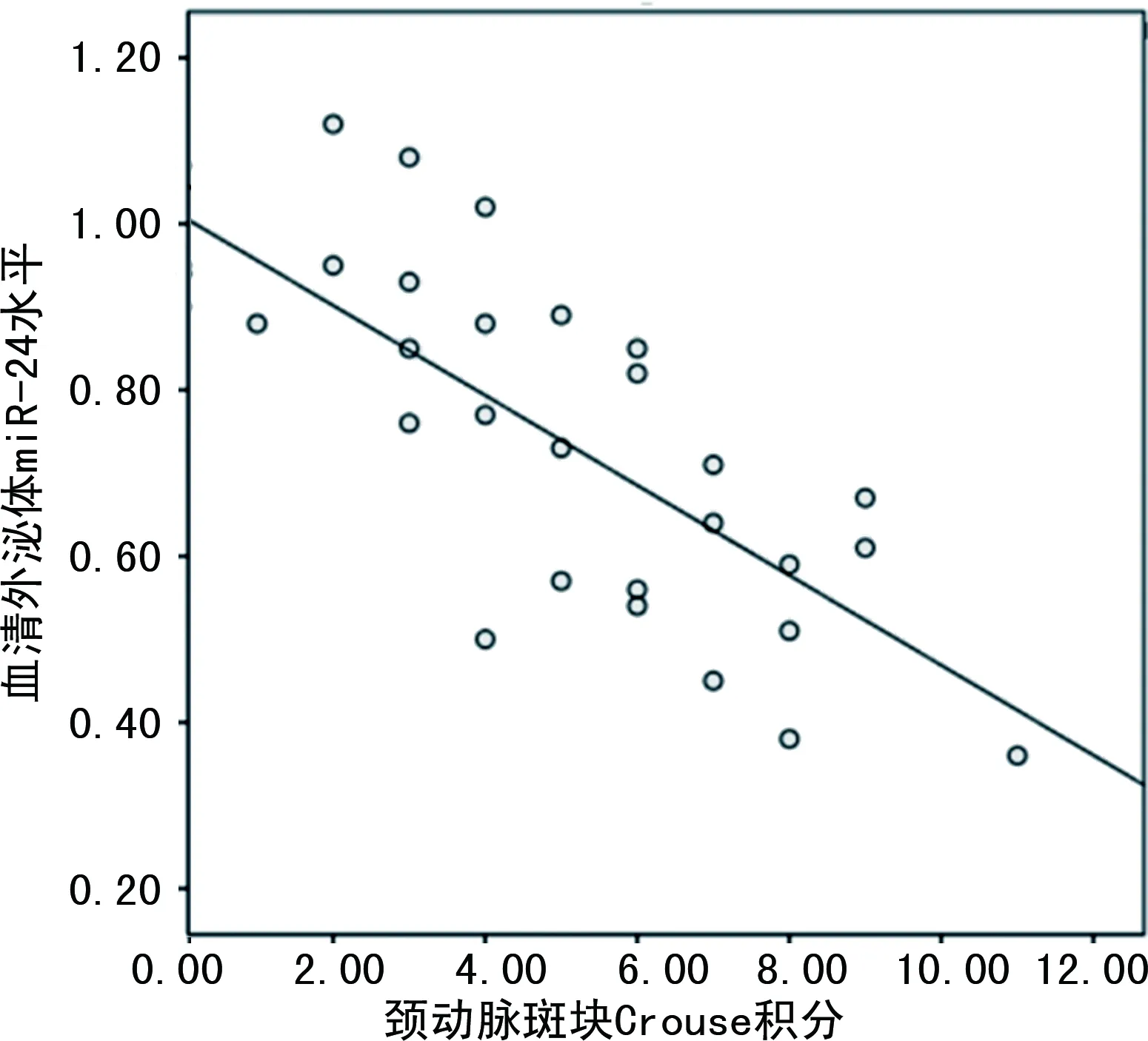
圖4 血清外泌體miR-24水平與頸動脈斑塊Crouse積分的相關性
3 討 論
本研究分析了急性腔隙性腦梗死患者血清外泌體中miR-24水平與疾病進展之間的關系,結果表明發生腔隙性腦梗死且癥狀出現7 d內發生疾病進展的患者入院時血清外泌體miR-24水平低于未發生進展的腔隙性腦梗死患者,經多因素Logistic回歸分析,發現miR-24水平降低是進展性腔隙性腦梗死發生的獨立危險因素,說明miR-24可能與急性腔隙性腦梗死的疾病進展有關。既往研究證實,頸動脈硬化和斑塊形成是急性腦梗死疾病進展的獨立危險因素,但是單純的頸動脈彩超檢測往往不能準確預測腔隙性腦梗死的進展,并發現檢測急性腔隙性腦梗死患者入院時血清外泌體miR-24水平對腔隙性腦梗死患者的病情進展有一定的預測價值,且外泌體中的miRNA可有效避免被血清中的RNA酶降解,因此,檢測血清外泌體中的miR-24水平預測進展性腔隙性腦梗死更加準確[1-2]。
在我國,腦梗死具有很高的發病率、病死率和致殘率,且目前尚缺乏十分有效的治療手段和控制神經功能惡化的有效措施。因此,明確與腦梗死發生、進展相關的危險因素具有重要的醫學價值。動脈粥樣硬化被認為是腦梗死最重要的病理性基礎[3-4]。LORENZ 等[5]的前瞻性研究發現,頸動脈IMT可以獨立預測未來的腦血管事件。因此,頸動脈粥樣硬化斑塊的形成及引起的頸動脈狹窄已被廣泛用作預測腦梗死疾病發生的指標,并且也是疾病治療中控制的關鍵因素。除此以外,頸動脈粥樣硬化斑塊與腦梗死神經功能惡化的相關性及其臨床意義也逐漸被證實。神經系統惡化是急性腔隙性腦梗死患者最嚴重的并發癥之一[6]。多種因素被認為會導致急性腔隙性腦梗死神經系統惡化,包括大血管閉塞、頸動脈粥樣硬化斑塊的形成、斑塊易損性、出血轉化、顱內壓升高、感染等。潘維花等[7]證實,24 h收縮壓標準差、頸動脈硬化Crouse積分與腦梗死密切相關,是腔隙性腦梗死發生、進展的有效預測指標。作為一種廉價、無創、非電離的成像技術,頸動脈超聲檢查斑塊是目前唯一能實時觀察動脈壁形態、血流動力學和彈性特征的成像方法,但是對于無急性癥狀發作的腔隙性腦梗死患者或疾病進展評估,其靈敏度和臨床應用范圍有限。
本研究通過多因素Logistic回歸分析證實,miR-24水平降低是腔隙性腦梗死發生疾病進展的獨立危險因素,且ROC曲線分析結果顯示,檢測血清外泌體miR-24水平對于預測進展性腔隙性腦梗死的發生具有較高的靈敏度。miR-24在眼、腎、腦、心、肺等多種組織中均有表達,特別是在血管組織中。有研究表明,miR-24可以通過抑制Importin-α3表達,調節內皮細胞的增殖、遷移、凋亡及炎性反應來抑制動脈粥樣硬化[8-12]。方丹等[13]證實在不穩定性動脈斑塊中存在高水平的YKL-40及低水平的miR-24。目前,進展性腔隙性腦梗死的可能發病機制有穿支血管動脈硬化性疾病、血流動力學變化、興奮性氨基酸毒性和炎性反應等,此外,大血管病變也極有可能引起動脈-動脈栓塞或穿支動脈入口被斑塊阻塞,從而引發腔隙性腦梗死。OHIRA等[14]和靳宗偉等[15]均通過研究證實CCA-IMT、Crouse積分升高與缺血性腦梗死的相關性相較于其他型腦梗死更大,尤其與腔隙性腦梗死關系密切。本研究中患者入院時進展組斑塊檢出率高于非進展組,且易損斑塊檢出率更高,差異均有統計學意義(P<0.05);另外,進展組Crouse積分明顯高于非進展組,差異有統計學意義(P<0.05),說明頸動脈斑塊硬化程度越嚴重,腔隙性腦梗死患者發生疾病進展的風險越高。相關分析發現,血清外泌體miR-24水平與頸動脈斑塊Crouse積分呈負相關,提示miR-24與頸動脈斑塊的形成機制有關,檢測miR-24水平可反映頸動脈粥樣硬化的嚴重程度。
綜上所述,miR-24水平可以反映腔隙性腦梗死患者頸動脈斑塊硬化嚴重程度,而且其降低是急性腔隙性腦梗死發生疾病進展的獨立危險因素,檢測血清外泌體miR-24水平對預測老年進展性腔隙性腦梗死的發生具有較高的價值。

