西藏牦牛多殺性巴氏桿菌的分離鑒定及藥敏分析
王玉恒,吉哈利,彭燕娟,索朗卓嘎,于子淇,鄧 愧,周海娟,其美央宗,丹真次旦,包玉花*
(1.西藏自治區獸醫生物藥品制造廠,西藏 拉薩 850000;2.西藏蓮莖生物科技有限公司,西藏 拉薩 850000)
牦牛主要生活在西藏高海拔地區,具有耐嚴寒、耐疲勞、善于走陡坡險路等優點,對西藏畜牧業發展具有重要作用[1]。近年來,牦牛的細菌病感染率、死亡率逐漸增加,已嚴重影響到牦牛健康及養殖戶經濟收入。因此,研究牦牛細菌性傳染病非常必要。
多殺性巴氏桿菌是一種兩端鈍圓、中央微凸的革蘭氏陰性短桿菌,能引起牛、羊、雞、兔等多種動物患急性敗血型、炎性出血型等癥狀為主的傳染病。該病主要以呼吸道、消化道、皮膚黏膜損傷及吸血蚊蟲叮咬等方式傳播。截至目前,對多殺性巴氏桿菌分離鑒定、診斷、治療以及防控的研究越來越多[2-4]。如1954年廖延雄[5]首次研究了牦牛多殺性巴氏桿菌的培養特性及生化特性;1979年郭大和等[6]從我國水牛、黃牛組織中分離出了多殺性巴氏桿菌,經鑒定均為B型;1985年肖克宇等[7]發現了培養多殺性巴氏桿菌的新方法;1995年魏天文等[8]研究了一種檢測實驗動物的多殺性巴氏桿菌的ELISA競爭抑制法;2001年Townsend等[9]根據Pm莢膜編碼基因設計特異性引物,建立了一套分子生物學的鑒定及分型方法;2016年李春生等[10]研究了青海牦牛A型多殺性巴氏桿菌的分離鑒定;2018年蔡其剛等[11]研究了牦牛出血性敗血癥的病原分離及鑒定;2019年闞威等[12]在青海病死牛組織中分離出了4株病原菌,并鑒定為莢膜血清A型多殺性巴氏桿菌。本試驗對病死牦牛的內臟組織進行了細菌分離,并通過涂片鏡檢、生化鑒定、熒光定量PCR法對分離細菌株進行鑒定,再利用17種抗菌藥物對該細菌株進行藥敏分析,以期為該病的診斷、治療以及防控提供理論依據。
1 材料與方法
1.1 主要試劑
細菌基因組DNA提取試劑盒,購自天根生化科技(北京)有限公司;SYBR? Green Master Mix試劑,購自賽默飛世爾科技(中國)有限公司;胎牛血清,購自北京索萊寶科技有限公司;細菌培養基、細菌微量生化鑒定管、抗菌素藥敏片,均購自杭州微生物試劑有限公司;分析純均為國產。
1.2 主要儀器
熒光定量PCR儀(QS1,賽默飛世爾科技(中國)有限公司),體視顯微鏡(CX21FS1C,奧林巴斯(廣州)工業有限公司),生化培養箱(SHP-300,上海鴻都電子科技有限公司),高速冷凍離心機(TGL16,湖南星科科學儀器有限公司),電熱恒溫水浴鍋(HH-2A,北京科偉永興儀器有限公司),電子天平(0.001 g)(SY204C,上海佑科儀器儀表有限公司),其余試驗耗材均為國產。
1.3 樣品來源
樣品來源于西藏自治區那曲市安多縣某養殖戶的一頭病死牦牛,無菌采集心臟、肝臟、腎臟、脾臟、喉管及淋巴結等組織樣品,共計11份。2020年12月24日送至西藏自治區獸醫生物藥品制造廠獸醫實驗室。
1.4 試驗方法
1.4.1 病料觸片鏡檢 將采集的病料心臟、肝臟、肺臟、淋巴結等組織的病變部位觸片,革蘭氏染色,鏡檢。
1.4.2 病原菌分離及培養 將組織病料接種于含有5%血清的肉湯中進行增菌,37℃條件下培養24 h。再將血清肉湯劃線接種于營養瓊脂平皿、血清瓊脂平皿、麥康凱瓊脂平皿和三糖鐵瓊脂斜面,37℃條件下培養24 h,觀察菌落形態。隨機挑選單菌落接種于血清肉湯,培養24 h,涂片染色鏡檢。
1.4.3 生化鑒定 按照細菌微量生化鑒定管說明書,將血清肉湯培養物接種至生化反應管,觀察顯色反應。結果判定參照《獸醫微生物學》中多殺性巴氏桿菌生化鑒定標準,詳見表1。

表1 多殺性巴氏桿菌生理生化指標
1.4.4 細菌基因組DNA提取 取純化后血清肉湯培養物1 ml,參照細菌基因組DNA提取試劑盒說明書進行細菌DNA提取。
1.4.5 引物合成 參考Townsend K M等[9]研究文獻,設計多殺性巴氏桿菌鑒定引物,由北京擎科生物科技有限公司合成,引物序列及大小見下表2。
表2 Real-time PCR引物信息
1.4.6 熒光定量PCR反應體系及條件 多殺性巴氏桿菌熒光定量PCR反應體系為20 μl,具體操作如下:SYBR? Green Master Mix 10 μl,上游引物和下游引物(10 μmol/L)各1 μl,DNA模板1 μl,ddH2O 7 μl。PCR擴增條件:50℃ 2 min,95℃ 2 min,95℃ 15 s,退火溫度(表2)15 s,72℃ 1 min,共35個循環,每個循環結束時采集熒光信號;溶解曲線:測量溫度為50~95℃。每組樣品重復檢測3次,分析擴增曲線及擴增溶解曲線。
1.4.7 藥敏試驗 取已鑒定培養后菌液200 μl滴加至血清瓊脂平皿,用無菌涂菌棒涂布菌液,保證涂布均勻。再用鑷子取藥敏片貼至血清瓊脂平皿表面并壓平,37℃條件下培養18 h后,測量抑菌圈直徑。每種藥物3個重復,計算平均值,判定敏感程度。藥敏試驗抑菌圈直徑判定標準見表3。
表3 藥敏試驗抑菌圈直徑判定標準
2 結果
2.1 病料鏡檢結果
在肺臟、肝臟病料組織中,鏡檢到短小桿菌。經革蘭氏染色,結果為革蘭氏陰性桿菌,見圖1。
圖1 病料組織的革蘭氏染色
2.2 病原分離培養結果及菌落形態特征
將病料組織的5%血清肉湯培養液接種于血清瓊脂平皿,培養24 h,形成了表面光滑、濕潤、邊緣較整齊的半透明灰白色菌落,無溶血情況;接種于營養瓊脂平皿上菌落貧瘠,且直徑小于血清瓊脂平皿上的菌落;接種于麥康凱瓊脂平皿上未見生長;三糖鐵瓊脂斜面底部變為黃色。挑取血清瓊脂平皿上的菌落,涂片鏡檢為革蘭氏陰性短桿菌,見圖2。
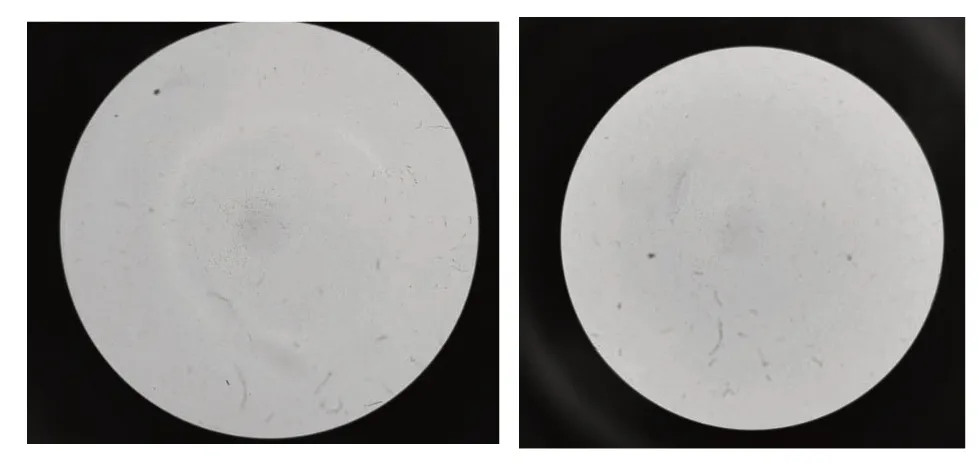
圖2 細菌液的革蘭氏染色
2.3 生化鑒定結果
經細菌微量生化鑒定,該細菌株產酸不產氣,可分解葡萄糖、蔗糖和甘露醇,不發酵乳糖、麥芽糖,氧化酶、觸酶、鳥氨酸脫羧酶、吲哚試驗均為陽性,脲酶試驗為陰性,表明該細菌株符合多殺性巴氏桿菌生化鑒定標準。
2.4 熒光定量PCR擴增結果
以細菌組DNA為模板,利用熒光定量PCR檢測法對多殺性巴氏桿菌鑒定引物進行擴增。由圖3、圖4可知,Kmt1基因的擴增曲線有明顯的S型指數增長曲線,且溶解曲線為單峰;由圖5、圖6可知,16S rRNA的擴增曲線有明顯的S型指數增長曲線,且擴增溶解曲線為單峰。表明該細菌株DNA基因組中能擴增出多殺性巴氏桿菌鑒定基因。
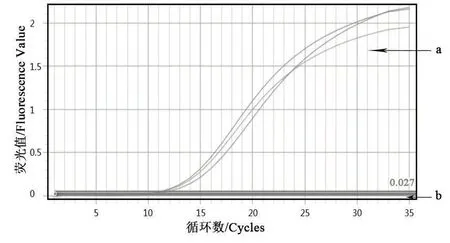
圖3 Kmt1基因的擴增曲線
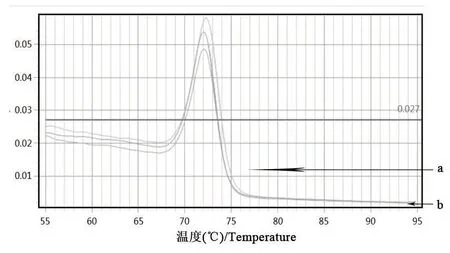
圖4 Kmt1基因的溶解曲線
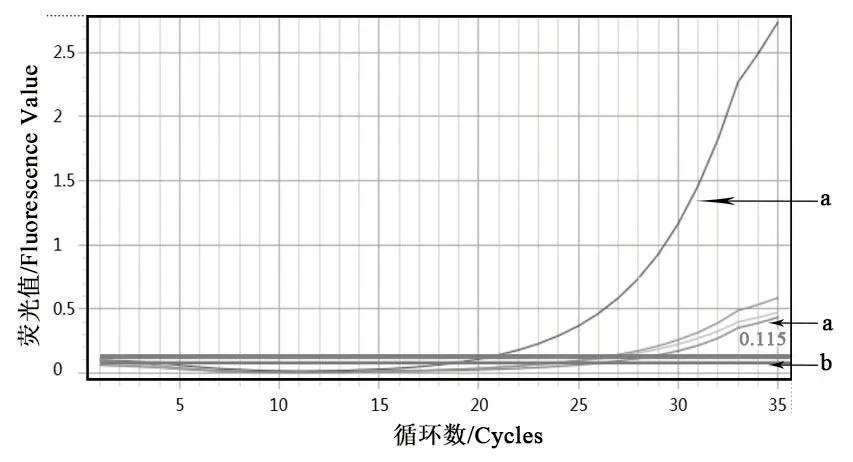
圖5 16S rRNA的擴增曲線
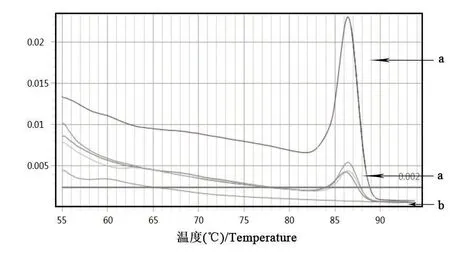
圖6 16S rRNA的溶解曲線
2.5 藥敏試驗結果
藥敏試驗檢測了該細菌株對鏈霉素、頭孢類等17種抗菌藥物的敏感程度。由表4可知,該細菌株對頭孢曲松、頭孢他啶、氧氟沙星、麥迪霉素等13種抗菌藥物表現為敏感,對氨曲南、頭孢噻肟、哌拉西林、鏈霉素等4種抗菌藥物表現為中介,無抗菌藥物表現為耐藥。
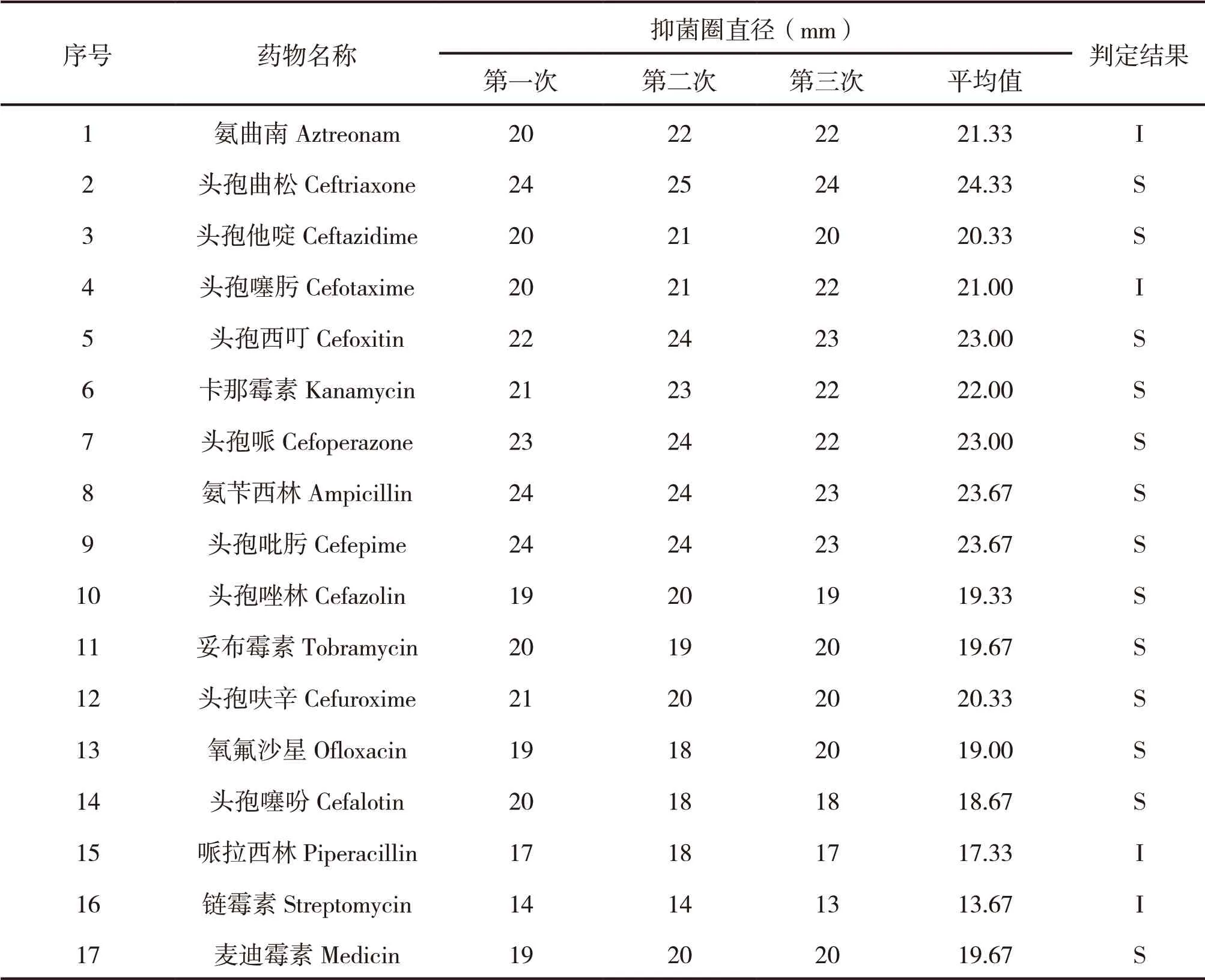
表4 藥敏試驗結果
3 討論
受西藏地區空氣稀薄、氣壓低、含氧量少等因素影響,大多數牦牛的呼吸系統易遭受損傷。多殺性巴氏桿菌主要侵襲呼吸系統、局灶性感染以出血性敗血癥為主要特征,是影響西藏牦牛健康的主要細菌之一。
首先,本研究無菌采取病死牦牛組織樣品11份,觸片鏡檢發現大量革蘭氏陰性短桿菌,再利用5%血清肉湯培養液復壯,接種于血清瓊脂平皿、營養瓊脂平皿、麥康凱瓊脂平皿等平皿,結果顯示該細菌株在血清瓊脂平皿可形成表面光滑、濕潤、邊緣較整齊的半透明灰白色菌落,無溶血情況;在營養瓊脂平皿上菌落貧瘠,且直徑小于血清瓊脂平皿的菌落;在麥康凱瓊脂平皿上未見生長;三糖鐵瓊脂斜面底部變為黃色,菌液鏡檢為革蘭氏陰性短桿菌,因此初步懷疑為巴氏桿菌。
其次,利用微量生化鑒定管對該細菌株進行了生化鑒定,結果顯示該細菌株符合多殺性巴氏桿菌生化鑒定標準。
再次,以細菌組DNA為模板,用熒光定量PCR檢測法對多殺性巴氏桿菌鑒定引物進行擴增,結果顯示該細菌株DNA基因組中能擴增出多殺性巴氏桿菌鑒定基因,進一步表明該細菌株為多殺性巴氏桿菌株。
最后,利用17種抗菌藥物對該細菌株進行了藥敏分析,結果顯示鏈霉素、頭孢類等17種抗菌藥物中13種抗菌藥物對該細菌株有抑制作用。
4 結論
本試驗對病死牦牛內臟組織進行了細菌分離,再通過涂片鏡檢、生化鑒定、熒光定量PCR法對分離細菌株進行了鑒定,結果表明分離細菌株為多殺性巴氏桿菌株。通過藥敏試驗發現,頭孢曲松、頭孢他啶、氧氟沙星、麥迪霉素等13種抗菌藥物對該細菌株有顯著抑制作用,但其抑菌機理還需進一步研究。對氨曲南、頭孢噻肟、哌拉西林、鏈霉素等4種抗菌藥物表現為中介,無抗菌藥物表現為耐藥。

