甲狀腺微小乳頭狀癌及術后頸部轉移淋巴結的超聲介入治療研究進展
黃凱峰,鄭 悠,張旭旭,馬蘇美
1. 重慶大學附屬腫瘤醫院超聲醫學科,重慶 400030;
2. 重慶醫科大學附屬第二醫院放射科,重慶 400010;
3. 甘肅省人民醫院超聲醫學科,甘肅 蘭州 730000;
4. 蘭州大學第一醫院超聲醫學科,甘肅 蘭州 730000
甲狀腺癌已成為發病率上升最快的癌癥,病理學分型為乳頭狀癌、濾泡狀癌、髓樣癌及未分化癌,其中75%為甲狀腺微小乳頭狀癌(papillary microcarcinoma of the thyroid,PTMC),即直徑<10 mm的甲狀腺乳頭狀癌[1]。PTMC生物學特征同乳頭狀癌一樣,雖總體趨于惰性,預后較好,但頸部淋巴結易轉移,中央區淋巴結轉移率為20%~90%[2],即使術中進行預防性清掃頸部淋巴結,仍有15%~30%的患者術后發生淋巴結轉移,影響患者長期生存率[3]。PTMC和頸部轉移淋巴結的治療方式首選手術切除,但針對部分患者,有醫療機構嘗試超聲引導下介入治療消除病灶,而對此方式爭議較大,不同的科室及機構所得出的結論不盡相同,同時也存在濫用介入技術導致過度治療的趨勢,故有必要探討超聲介入治療在PTMC及轉移淋巴結中的規范運用。
1 PTMC及頸部轉移淋巴結治療現狀
1.1 頸部開放手術和腔鏡手術治療PTMC
PTMC對放化療不敏感,首選治療方式為手術切除,國內大多同時行頸部中央區淋巴結預防性清掃術,患者10年生存率達90%以上[4]。但外科開放手術創傷較大,頸部常留有L型切口瘢痕,即使采用低領式小切口,頸部仍留有瘢痕,同時頸部淋巴結清掃發生并發癥風險較高,甲狀腺全切患者術后常需終身服用甲狀腺激素,使得一部分患者不接受或不能耐受外科開放手術。
近幾年用于PTMC切除的腔鏡甲狀腺手術分為腔鏡輔助下頸部小切口手術(改良Miccoli手術)和全腔鏡下手術。改良Miccoli手術選取頸下正中≤2 cm的切口,而全腔鏡下根治手術主要為經乳暈入路,術后切口隱蔽,兩種腔鏡術式均利用高清監視系統放大了局部解剖,能很好地保護喉返神經、甲狀旁腺等重要組織器官,并降低術后并發癥風險,同時術后瘢痕相較傳統開放手術更為美觀[5],但操作難度大,手術時間長,術中出血量較大,患者術后疼痛感明顯,改良Miccoli手術美容效果不理想,全腔鏡手術存在需器械牽引切除腺體,易損傷血管等不足。而2014年起中國開展的機器人甲狀腺手術多采用雙側乳暈腋窩入路,相較傳統腔鏡手術而言,因操作臂更靈活,使得清掃更為全面,對比傳統腔鏡手術,對雙側甲狀腺癌患者處理優勢更明顯[6],但耗時費力,手術時間更長,難以在臨床中推廣。甲狀腺缺乏生理性腔隙,各種腔鏡手術易引起皮下軟組織損傷,目前還不能代替傳統外科開放手術。
1.2 低危PTMC的積極監控觀察策略
有研究[7-8]認為,PTMC可能并非高危癌發展的早期階段,匯總PTMC隨訪研究結果,PTMC相關死亡率低于0.3%,因此無淋巴結轉移和組織侵犯的PTMC可被認為是一種低危的分化型甲狀腺癌。進而有學者[9]提出對PTMC進行積極監控觀察,即不立即手術切除,而采用密切隨訪和超聲檢查的方式觀察PTMC進展,結果顯示,10年隨訪期內15.9%患者結節體積增大(最大徑增長超過3 mm),僅5.6%患者因結節體積增大(最大徑增長超過10 mm)和頸部淋巴結轉移而被建議轉行手術治療。鑒于PTMC的惰性,美國甲狀腺協會(American Thyroid Association,ATA)指南指出[4],對于手術高風險以及無轉移表現的PTMC,推薦行積極監控觀察。盡管積極監控觀察能避免PTMC的過度治療,使得大部分低危PTMC患者受益,但其納入標準嚴格,需排除PTMC高危病理學亞型和頸部淋巴結轉移,而無論術前細針抽吸活組織檢查(fine-needle aspiration biopsy,FNAB)還是超聲掃查均不能有效地排查高危細胞病理學亞型和隱匿性頸部淋巴結轉移,致使部分不宜采用積極監控觀察的患者病情延誤,不得不行搶救性手術,而因結節進展引起的組織粘連和轉移使得手術風險和治療難度增加[10]。因此積極監控觀察較適用于全身情況較差,不能耐受手術,結節直徑<5 mm且經全面評估后屬低危癌的老年患者,對于年齡<40歲的年輕患者,疾病進展風險更高,如需行積極監控觀察,可同時進行促甲狀腺激素(thyroidstimulating hormone,TSH)抑制治療,而在積極監控觀察中,若結節直徑增長超過3 mm,出現頸部淋巴結轉移,或患者改變監控觀察策略,要求手術時,應結束積極監控觀察,轉為外科手術治療[11]。
1.3 術后頸部轉移淋巴結的治療
甲狀腺乳頭狀癌為激素依賴性腫瘤,對于高危PTMC術后采用TSH抑制治療和放射性核素治療可有效地防止其術后復發[11],但有研究[12]表明,即使采用甲狀腺全切術加淋巴結預防性清掃及放射性核素治療,術后頸部淋巴結轉移率仍高達16.5%。2015年版ATA指南指出,甲狀腺癌術后頸部轉移淋巴結首選手術治療,但術后頸部瘢痕形成,組織粘連常使解剖結構分界不清,再次開放手術并發癥風險和處理難度較大[13]。而術后轉移淋巴結的清掃至關重要,目前用于開放手術的淋巴結定位方法較多,但導絲鉤針定位法、γ探針探測法及亞甲藍染料定位法等均存在各種不足,有研究[14]在超聲引導下將納米炭注入轉移淋巴結,使再次手術時轉移淋巴結能充分暴露,得以完全清掃,成功地引入超聲介入技術指導再次手術清理操作。近幾年超聲不僅用于指導手術定位,而且較多用于術后轉移淋巴結的介入治療,成功滅活轉移淋巴結,同時避免了再次手術帶來的創傷和風險。
1.4 新興的超聲介入治療
超聲引導下介入治療兼具微創及主動干預的特點,即超聲引導穿刺消融針經皮進入并損毀目標病灶,達到治療目的。超聲介入技術多用于甲狀腺良性結節的減容治療,對于甲狀腺良性結節及高功能腺瘤療效確切,而近年來對PTMC及頸部轉移淋巴結的超聲介入治療報道逐漸增多,目前運用到的介入治療技術包括熱消融、化學消融,放射性粒子植入。
2 超聲引導下介入治療技術
2.1 超聲引導下熱消融
射頻消融(radiofrequency ablation,RFA)利用電極產生震蕩電場產熱,針尖溫度達60℃以上,造成組織凝固性壞死,外周形成45~60℃的熱療區,可在殺滅原位及交界處腫瘤組織的同時盡量保存正常組織。
微波消融(microwave ablation,MWA)是通過交變電磁場引起極性分子碰撞運動產熱,造成腫瘤壞死,因減少血管熱沉效應而擁有比RFA更高的熱效率,可減少并發癥風險。激光消融(laser ablation)采用激光穿透組織產熱,與RFA、MWA相比,溫度更高,達300 ℃以上,可導致腫瘤組織快速滅活,同時伴隨組織氣化。激光消融針較為纖細,操作中更易避開血管及神經,消融范圍較小,更適于治療風險較大的微小病灶。
2.2 超聲引導下化學消融技術
甲狀腺化學消融以無水乙醇消融為主,最早用于小肝癌,后逐漸運用于肺、腎、甲狀腺、淋巴結轉移瘤等。在95%~99%純度乙醇的滲透作用下,靶細胞脫水、蛋白質變性,發生凝固性壞死。乙醇在結節內的彌散程度決定療效好壞,一般在實性結節中彌散不均勻,多用于囊性成分為主結節的治療。
2.3 超聲引導下放射性碘粒子植入技術
甲狀腺的放射性粒子治療主要是在計算機體層成像(computed tomography,CT)引導下進行,但對于直徑<1 cm的淋巴結,CT顯示不清[15]。毗鄰氣管、食管等重要臟器結構部位的淋巴結,CT不能實時引導,植入風險較高,因而超聲引導成為淺表淋巴結粒子植入的新選擇,原理是在超聲引導下將131I或125I植入瘤體內,通過微小放射源發出持續的低劑量γ射線和X射線,破壞腫瘤細胞DNA分子結構,同時電離水分子,造成腫瘤細胞水腫、變性至壞死。因劑量較低,可在殺傷腫瘤組織同時,較少損傷正常組織。
3 超聲介入治療PTMC的進展
3.1 熱消融治療初診PTMC
目前的指南[4,11,16-18]均不推薦使用熱消融治療初診PTMC,僅部分指南推薦對于部分不宜二次手術的復發病灶及轉移淋巴結可行熱消融治療。其主要原因:① 熱消融為局部治療手段,不符合甲狀腺癌最小切除單位為一側葉的原則,術后易復發;② 超聲對頸部淋巴結的識別仍然存在不足,即使低危PTMC仍存在中央區淋巴結隱匿性轉移風險,而熱消融無法預防性清掃淋巴結;③ 消融術后復發灶行二次手術難度較大,消融組織變性壞死,與周邊頸部肌肉及組織粘連嚴重,只能參考局部晚期甲狀腺癌的手術原則進行處理[19];④ 有針道轉移的相關報道[20],因甲狀腺體積較小且腺毗鄰眾多重要組織器官,在退針時可能因安全距離不足導致針道消融不完全,從而增加了種植轉移的風險。但已有的指南均對不能耐受手術及不愿接受手術的初診患者PTMC熱消融治療持觀察態度。近幾年,國內外多個醫療機構開展了針對PTMC的熱消融治療(表1),3種熱消融技術均有涉及,以RFA、MWA為主,激光消融較少,研究報道主要來源于中國。總結這些研究可見:① 大部分經熱消融治療的PTMC病灶體積被有效控制,部分病灶完全消除;② 相關并發癥發生率較低,主要為術后暫時聲音嘶啞和輕微疼痛,均于術后幾分鐘至數月內緩解,無永久性喉返神經損傷、氣管食管頸動脈損傷等嚴重并發癥,患者術后甲狀腺、甲狀腺旁腺功能正常;③ 大部分研究隨訪期較長,最長平均隨訪期達到72個月,隨訪期內病灶復發及轉移率低,均無遠處轉移報道。除1例發現對側腺體轉移行甲狀腺雙側葉全切術外,其余均采用二次熱消融治療,經隨訪轉移病灶均完全消除;④ MWA并發癥發生率對比其他消融方式更高,主要為暫時性聲音嘶啞,這可能與MWA針較粗、消融半徑更廣、更易造成腺體內喉返神經熱損傷有關;⑤ 回顧性研究較多,前瞻性研究較少,缺乏多中心研究以及隨機對照試驗比較不同消融方式及熱消融與外科手術之間的差異;⑥ 歐美開展相關研究較少,僅意大利一家機構開展臨床試驗,結果顯示,結節體積縮減率及并發癥發生率與中國、韓國兩國研究結果差距較大,除了此研究患者數較少、開展較晚等因素,人種差異亦可能帶來影響,因此熱消融是否有益于治療其他人種PTMC尚需更多驗證。
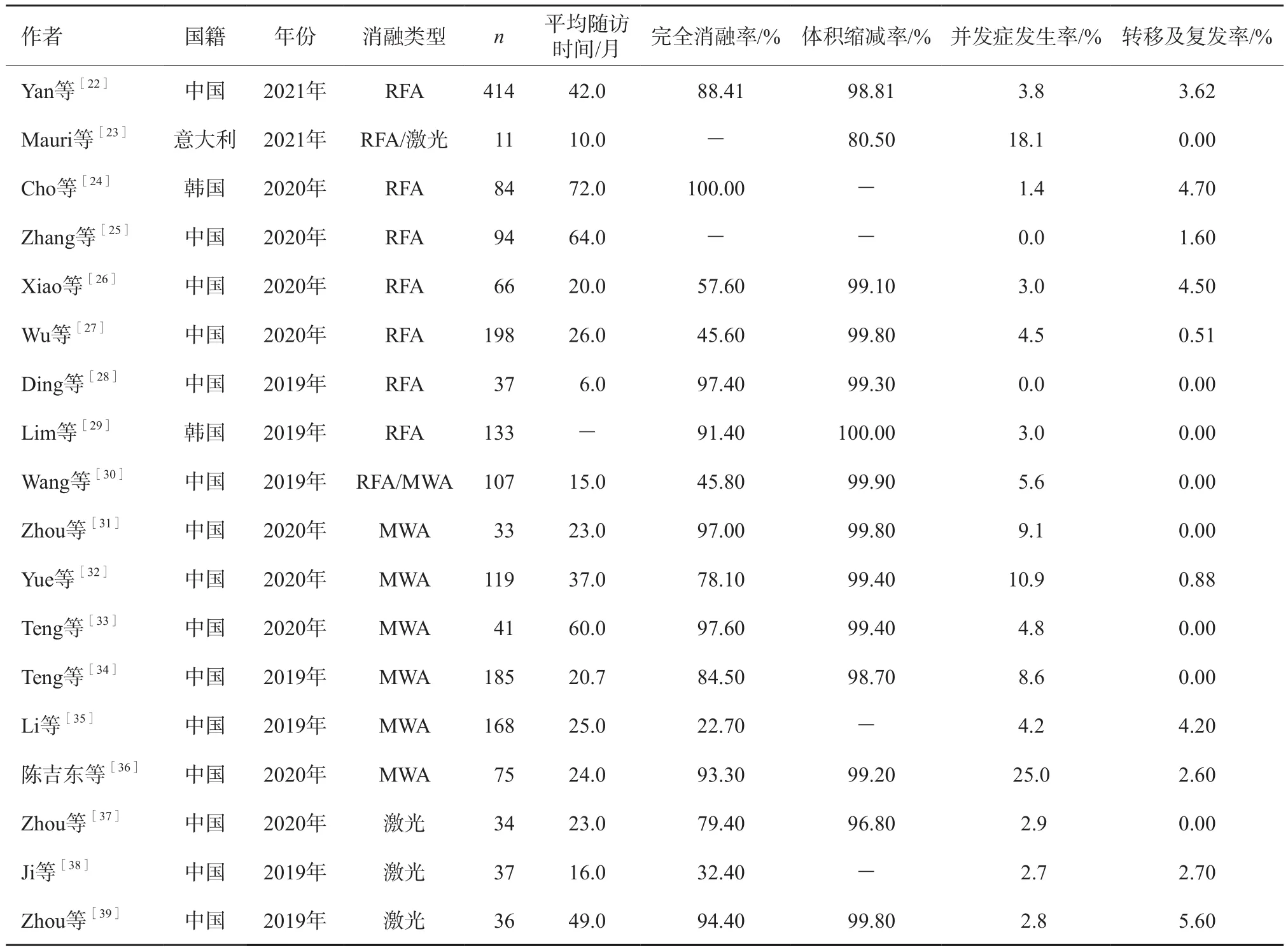
表1 2019—2021年不同國家及機構熱消融治療PTMC結果
目前未見對比熱消融和積極監控觀察PTMC的研究報道,熱消融是否有益于控制低危組PTMC進展不得而知。而總結熱消融和外科手術的對比研究(表2)可見:① 在手術時間、術中出血量、住院天數、總花費、并發癥發生率方面熱消融治療明顯低于外科手術,且所有的熱消融治療均未產生永久性損傷,而部分研究外科手術造成部分患者永久性喉返神經損傷和甲狀腺功能減退;② 術后復發率未作為重點進行對比,僅少數研究長期隨訪復發轉移情況,而是否能降低復發率才是評價一個治療手段療效最重要的指標;③ 研究總量較少,暫無隨機對照試驗研究比較兩者差異。
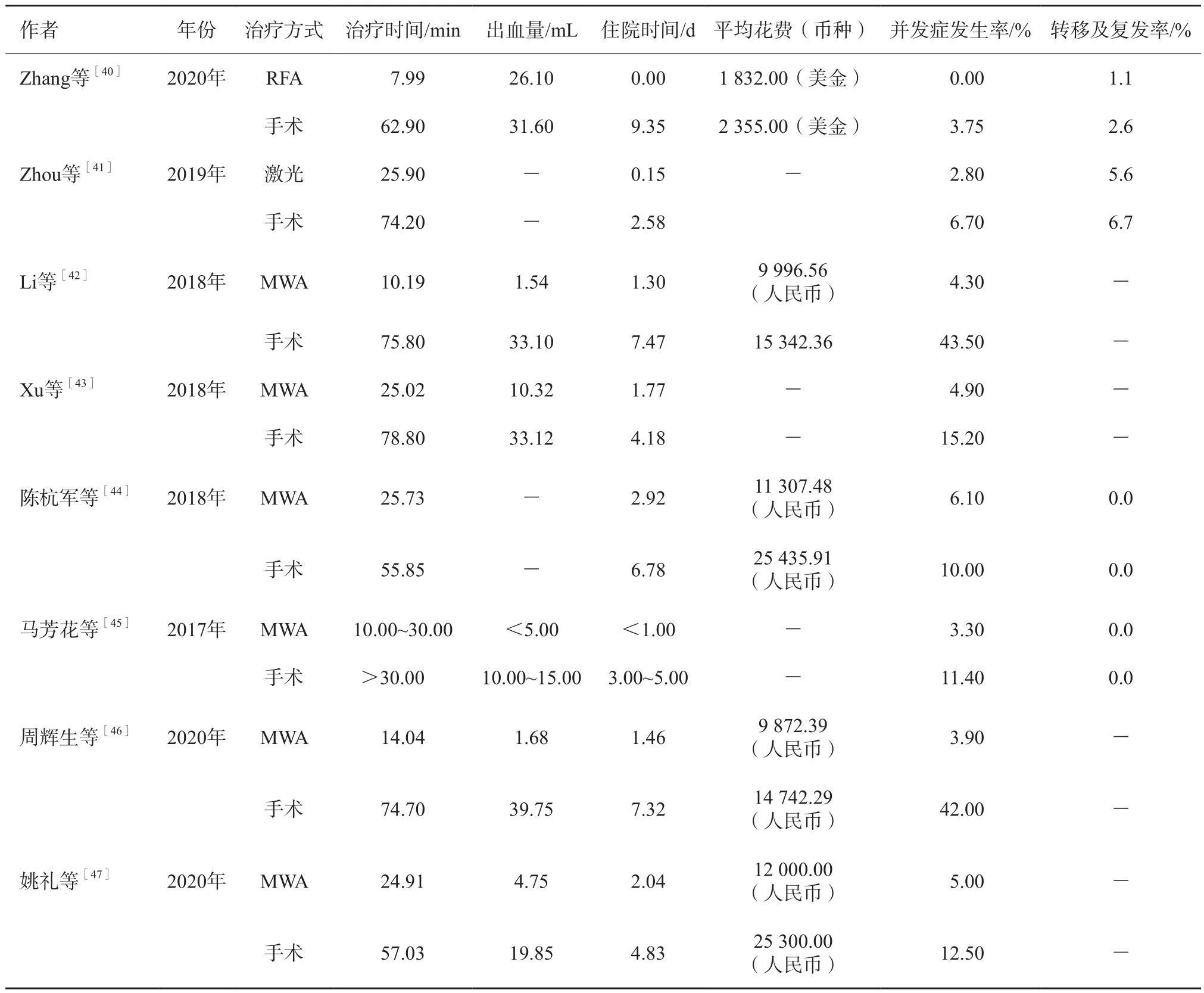
表2 熱消融同外科手術治療PTMC的對比研究結果
3.2 其他超聲介入手段治療初診PTMC
化學消融目前主要用于甲狀腺囊性結節的治療,周超等[21]對92例完全囊性或囊性成分大于50%的結節行無水乙醇消融,術后12個月結節體積縮小率達(93.83±6.48)%。乙醇在治療PTMC原位病灶方面的研究甚少,且均為熱消融技術不成熟時的姑息療法,療效較差,復發率及并發癥發生率較高。因此指南[19]明確反對使用化學消融治療初診PTMC,目前運用到初診PTMC治療的超聲介入技術僅為熱消融。
4 超聲介入治療術后頸部轉移性淋巴結
4.1 放射性碘離子和化學消融治療
目前超聲介入治療頸部轉移淋巴結的主要指征:① 術前行穿刺證實轉移且病情不適合再次進行外科手術或患者拒絕再次進行外科手術;② 轉移淋巴結≤3個;③ 不存在長徑>2 mm的粗大鈣化。ATA指南[4]指出,對于PTMC術后頸部轉移淋巴結,可進行碘離子放射治療,作為傳統的術后治療手段,131I治療甲狀腺癌轉移性淋巴結取得了良好的臨床效果,但仍有2%~5%的病灶在傳統131I治療和TSH抑制治療下難以取得較好療效[48],趙瑋等[49]采用超聲引導下125I粒子植入治療甲狀腺癌術后轉移淋巴結,分別于術后1、3、6、12個月觀測患者甲狀腺球蛋白(thyroglobulin,TG)水平、淋巴結體積及內部血流變化,結果顯示TG水平在治療后12個月中位水平由25.14μ g/L降至0.45 μ g/L,低于完全緩解期TG<1 μ g/L的標準,淋巴結血流等級明顯降低,而淋巴結體積未見明顯縮小。
有研究[50]對甲狀腺術后淋巴結轉移灶采用無水乙醇治療,淋巴結最大徑及TG水平均明顯減低。但并非所有乙醇消融治療均能減小轉移淋巴結最大徑,Kim等[51]對46個病灶進行治療,隨訪顯示僅24個病灶體積縮小,病理解剖表明,盡管消融后體積未明顯縮減,但乙醇破壞了淋巴結內的轉移性PTC細胞,仍有助于控制甲狀腺癌進展。綜上,盡管超聲引導的放射性碘離子治療以及化學消融治療后淋巴結體積縮減率較低,但仍能有效地抑制術后頸部轉移淋巴結侵襲進展,是一種安全、有效的姑息性治療方式。
4.2 熱消融治療
熱消融治療頸部轉移淋巴結以Ⅲ、Ⅳ、Ⅵ區淋巴結為主[2,52-53],能在短時間內(平均10~15 s)有效地損毀單個轉移淋巴結,具備較高的淋巴結體積縮減率,有助于控制淋巴結復發,同時并發癥發生率相較二次手術更低。在靠近頸總動脈行頸部Ⅱ、Ⅲ、Ⅳ區轉移淋巴結熱消融時,應當注意辨別并保護迷走神經,有研究[2]在對3例轉移淋巴結治療時,因淋巴結與迷走神經分界不清,未能避開迷走神經,引發迷走神經反射,致使患者心率血壓降低,此時應立即終止消融,待患者心率血壓恢復正常,可通過縮短單次消融時間及增加消融次數來徹底消融淋巴結。
5 總結及展望
超聲為甲狀腺疾病的首選檢查,同樣超聲引導下的介入治療也是甲狀腺介入治療的主要手段。依靠超聲的實時、動態監控,操作者能在頸部精密、復雜的解剖環境中制造隔離帶,并按照設計的方案布針,加之超聲造影對于消融范圍的精密把控,使得超聲介入在控制并發癥和結節清除率方面表現優異。并且近幾年開展的初診PTMC及頸部轉移淋巴結的超聲介入治療研究因納入指征更嚴格、操作流程更規范、隨訪時間更長取得了更可信的療效,得到了更為廣泛的認可[54-55]。人們對于部分甲狀腺惡性腫瘤超聲介入治療的認知也經歷了一個從不認可、從視為姑息療法至逐漸成為一線療法的過程。從有限的對比研究中可以看出,對于初診PTMC的治療,超聲介入和外科手術均有較低的復發概率,而超聲介入治療復發轉移淋巴結的研究中,絕大部分為外科術后復發患者,可見初診PTMC的治療并不是“一刀切”或“一消了之”,而是一個多學科協作的長期治療過程。PTMC的生物學特性還未完全闡明,因此以腫瘤復發來否定超聲介入治療顯然不可取。同時超聲介入是一項有門檻的技術,要達到理想治療效果,操作者必須有優秀的超聲操作技巧,較好的介入穿刺基礎,以及處理不同程度并發癥的臨床能力,因而對于甲狀腺惡性腫瘤的介入治療,應在具備良好超聲介入資質的科室進行,以避免濫用。值得一提的是,熱消融免疫效應以及熱增敏技術的研究已在肝癌等實質性臟器腫瘤中開展,是否適用于甲狀腺惡性腫瘤的熱消融有待進一步探索。

