團簇Ti4P的異構化反應及極化率研究
井潤田,方志剛,秦 渝,廖 薇,曾鑫漁
(遼寧科技大學化學工程學院,中國 鞍山 114051)
非晶態(tài)合金材料是近年來出現(xiàn)的具有新型微觀組織結構的金屬功能材料,其原子在形成材料時來不及按周期排列,形成了長程無序的非結晶狀態(tài)。與普通晶態(tài)金屬及合金相比,非晶態(tài)合金具有良好的催化性能[1,2]、電化學性能[3,4]、磁學性能[5],因而獲得國內外科學家的廣泛關注。過渡金屬Ti具有良好的催化性能[5]以及耐腐蝕性能[6],可大大延長材料的使用壽命,具有半導體性質的類金屬P具有優(yōu)異的電磁學性質[7],因此非晶態(tài)合金Ti—P二元體系具有更多突出的性能,例如由于過渡態(tài)金屬Ti原子的化學吸附,磷烯納米帶表現(xiàn)出優(yōu)良的自旋極化運輸性質,對于制備多功能電子和自旋電子器件具有極重要的意義[8]。近幾年Ti—P體系的相關文獻表明,團簇Ti4P在自旋極化運輸中顯出高度的各向異性[9],且磷原子摻雜于鈦基納米中提高了團簇整體的穩(wěn)定性[10]。為了進一步了解非晶態(tài)合金Ti—P二元體系的穩(wěn)定性以及各向異性,從團簇的異構化反應出發(fā),根據(jù)活化絡合理論,從空間結構、化學熱力學和化學動力學3個角度研究團簇Ti4P的穩(wěn)定性,從極化率和極化率的各向異性不變量兩個角度研究團簇Ti4P的變形性。團簇Ti4P的空間結構多樣化,各優(yōu)化構型的穩(wěn)定性也各不相同,一般來說,能量高的不穩(wěn)定構型總是趨于向能量較低較為穩(wěn)定的構型進行轉化,而研究過渡態(tài)則可以很好地判斷反應發(fā)生的途徑,通過理論判斷化學反應過程的反應途徑可以較好地為實踐研究提供參考價值。而極化率則是研究團簇分子在外界條件下抗擊形變的能力,對其研究可以找到穩(wěn)定狀態(tài)較好的構型,從理論上指導宏觀實驗。
1 模型設計和計算方法
依據(jù)拓撲學原理,設計出團簇Ti4P在平面和空間上所有可能存在的構型,對二、四重態(tài)下的構型采用密度泛函理論[11](Density functional theory,DFT)中的B3LYP/Lanl2dz量子水平進行全參數(shù)優(yōu)化、頻率計算及其驗證,排除虛頻和相同的構型,最終得到包括三角雙錐、戴帽三角錐和四棱錐在內的7種優(yōu)化構型,并基于密度泛函理論中的B3LYP雜化的Lanl2dz贗勢基組,在Gaussian 09中將關鍵字opt的參數(shù)設置為QST2,optcyc的參數(shù)設置為500,scf的參數(shù)設置為qc,采用QST方法對優(yōu)化構型在異構化反應中的過渡態(tài)結構進行搜索和優(yōu)化,并采用二次收斂自洽場的方法計算其能量,同時對其頻率進行優(yōu)化計算,最終得到7種優(yōu)化構型的過渡態(tài)結構,通過內稟反應坐標(IRC)驗證過渡態(tài)構型是否僅有一個虛頻,最終得到4種結構均為戴帽三角雙錐的過渡態(tài)構型。計算時對Ti原子采用Hay等人[12]提出的含相對論校正的有效核電勢價電子從頭計算基組,即18-eECP的雙ξ基組;對類金屬P原子采用Dunning/Huzinaga雙ξ基組,且對P加極化函數(shù)ξP.d=0.55[13]。以上運算的全部過程均在啟天M7150微機上的Gaussian09程序中運行。另外,根據(jù)活化絡合理論(Transition state theory),對團簇Ti4P異構化反應的正逆反應速率進行計算。
2 討論與結果
2.1 優(yōu)化構型及過渡態(tài)空間結構
采用上述理論方法對團簇Ti4P進行程序運行及計算,最終得到如圖1所示的7種優(yōu)化構型,其中二重態(tài)下的優(yōu)化構型共有3種(空間構型包括三角雙錐和戴帽三角錐);四重態(tài)下的優(yōu)化構型共有4種(空間構型包括戴帽三角錐、三角雙錐和四棱錐)。為方便比較,以能量最低的戴帽三角錐構型1(4)作為能量零點,設其能量值為0 kJ·mol-1,并將各優(yōu)化構型按相對能量由低到高的順序排列(各相對能量數(shù)值在其優(yōu)化構型圖下方標出)。與此同時,各優(yōu)化構型的對稱群在其下方括號內標出。構型圖下方小括號內2和4分別為所屬重態(tài)。將7種優(yōu)化構型各原子間的鍵長列于表1。如圖2所示,過渡態(tài)構型圖用TS(Transition state)表示各優(yōu)化構型在進行異構化反應時舊鍵斷裂和新鍵生成的具體情況,白色實線表示異構化過程中基本沒有變化的鍵,雙直線表示異構化過程中生成的鍵,虛線表示異構化過程中斷裂的鍵。同樣取能量最低的構型1(4)為能量零點,其余各過渡態(tài)構型圖按照能量由低到高的順序排列(各相對能量數(shù)值在其過渡態(tài)構型圖下方標出)。通過內稟反應坐標驗證及頻率計算分析,可知這4種過渡態(tài)構型有且僅有一個虛頻,因此將其作為團簇Ti4P各優(yōu)化構型間異構化反應時的過渡態(tài)構型。

表1 團簇Ti4P優(yōu)化構型的鍵長 (單位:nm)Tab. 1 Bond length of the optimized configurations of Ti4P clusters (Unit:nm)

圖1 團簇Ti4P的優(yōu)化構型Fig. 1 Schematic illustration of the optimized configurations of Ti4P clusters
由圖2可知,團簇Ti4P在發(fā)生異構化反應時的各過渡態(tài)構型較為單一,4種過渡態(tài)構型的空間結構均為戴帽三角雙錐,這說明異構化反應的優(yōu)勢結構為戴帽三角雙錐型。另外通過分析過渡態(tài)構型與反應物構型的化學鍵變化,發(fā)現(xiàn)4種過渡態(tài)構型的形成均由相應反應物的Ti4—P鍵斷裂以及Ti1—Ti4鍵生成而來,且過渡態(tài)構型單一,由此可推斷在異構化過程中各優(yōu)化構型均朝著利于Ti4—P鍵的斷裂以及Ti1—Ti4鍵生成的空間構型轉化。

圖2 團簇Ti4P異構化的過渡態(tài)構型Fig. 2 Schematic illustration of the transition state configuration for the isomerization reaction of Ti4P clusters
2.2 化學反應過渡態(tài)的熱力學研究
2.2.1 團簇Ti4P異構化反應過程的熱力學分析 為了便于分析團簇Ti4P在異構化過程中的熱力學基本性質,列出如表2所示的異構化構型的各項能量參數(shù)。其中SCF能量表示團簇Ti4P的4種過渡態(tài)構型在異構化反應過程中各物種由自洽場近似得到的能量,總能量則為SCF能量與零點能二者之和,而活化能分為正反應活化能EaF和逆反應活化能EaB,EaF和EaB可分別通過公式:EaF=ETS-E(反應物),EaB=ETS-E(生成物)計算得到。
活化能定義為團簇分子從常態(tài)轉變?yōu)槿菀装l(fā)生化學反應的活躍狀態(tài)所需的能量,由此可知活化能越小,反應越容易進行。由表2數(shù)據(jù)可知,在進行異構化反應時,所有過渡態(tài)轉化的過程均是正反應活化能小于逆反應活化能,說明團簇Ti4P在進行異構化反應時朝著正向反應的趨勢更大,同時根據(jù)生成物構型可以判斷能量較低即穩(wěn)定性較好的構型1(2),1(4)及2(2)更容易生成。較為特殊的是,除過渡態(tài)構型3(2)-1(2)外,其余3種過渡態(tài)構型均是不同重態(tài)間轉化的中間產物,且根據(jù)活化能數(shù)據(jù)分析,過渡態(tài)構型3(2)-1(2)的正逆反應活化能(EaF=90.549,EaB=141.526)均高于其余3種過渡態(tài)構型,因此推斷在團簇Ti4P各優(yōu)化構型異構化過程中,反應更容易朝著不同重態(tài)的構型進行轉化。對于反應物相同的異構化反應3(2)-1(2)和3(2)-1(4),后者正逆反應活化能較小,且構型1(2)與構型1(4)相比能量較低,結構較為穩(wěn)定。同樣的方法分析異構化反應4(4)-1(2)和4(4)-2(2),所得到的結果相同,這說明目的構型的能量越低,結構越穩(wěn)定,則越易于發(fā)生異構化反應。

表2 團簇Ti4P化學反應異構化過程的能量和活化能 (單位:kJ·mol-1)Tab. 2 Energy and activation energy for the isomerization reaction of Ti4P clusters (Unit:kJ·mol-1)
為了便于分析,將團簇Ti4P各優(yōu)化構型間異構化反應的轉化程度繪制成如圖3所示的異構化能壘圖,圖中縱坐標是以構型1(4)為零點的相對能量。從圖3可以看出,構型3(2)與1(4)能量差最大,相隔距離最遠,但是對比距離相對較近的構型3(2)與1(2),同時結合表2中數(shù)據(jù)來看,異構化反應3(2)-1(4)正逆反應活化能均小于異構化反應3(2)-1(2)的正逆反應活化能,且過渡態(tài)構型3(2)-1(4)能量較低,說明能量較低的過渡態(tài)構型比較容易進行異構化反應。從能量的角度分析,隨著過渡態(tài)能量的升高,可以發(fā)現(xiàn)相對應的正逆反應活化能均對應升高,同樣可以說明過渡態(tài)構型能量越低越容易進行異構化反應。

圖3 團簇Ti4P異構化反應各優(yōu)化構型能壘圖Fig. 3 Energy barrier diagram for the optimized isomerization configurations of Ti4P clusters
2.3 團簇Ti4P異構化反應的化學動力學研究
2.3.1 異構化轉化的程度及限度 為了更加透徹地了解團簇Ti4P的異構化過程,從動力學方面對其進行分析。表3為各過渡態(tài)構型在常溫(298.15 K)和常壓(101.325 kPa)下的正反應速率k+、逆反應速率k-以及平衡常數(shù)K。通過分析表3數(shù)據(jù)可知,4種異構化反應正反應速率均遠大于逆反應速率,同時平衡常數(shù)均遠大于1,說明這4種異構化反應過程均是正向進行且反應都較為徹底。其中異構化反應4(4)-1(2)正反應速率值(3.28)最大,但因其逆反應速率(6.0×10-8)也是最大的,因此其平衡常數(shù)在所有異構化反應中僅高于異構化反應4(4)-2(2),這說明此異構化反應比較容易進行,但是其反應限度不是最大的。將反應速率與活化能結合分析,異構化反應3(2)-1(2)的正逆反應活化能在所有異構化反應中均是最高的,且據(jù)表3數(shù)據(jù)來看,該異構化反應正逆反應速率也均是所有異構化反應中最小的,這在一定程度上可以證明活化能較大的反應其反應速率較慢。另外,分析TS(3(2)-1(2))和TS(3(2)-1(4))以及TS(4(4)-1(2))和TS(4(4)-2(2)),異構化反應由同一反應物轉化為不同生成物,但是異構化反應的正逆反應速率相差不大,二者的平衡常數(shù)也非常接近;再對比TS(3(2)-1(2))與TS(4(4)-1(2)),可發(fā)現(xiàn)由不同反應物轉化為同一生成物,二者的正逆反應速率相差較大,因此可以推斷反應物對異構化反應的正逆反應速率以及平衡常數(shù)的影響較大。

表3 常溫常壓下團簇Ti4P異構化過程的正逆反應速率及平衡常數(shù)Tab. 3 Forward and reverse reaction rates and equilibrium constants for the isomerization reaction of Ti4P clusters at room temperature and atmospheric pressure
2.4 團簇Ti4P的極化率
極化率作為衡量原子、分子或離子在電場作用下極化強度的微觀參數(shù),可以反映出極化過程的難易程度。表4列出了有關極化率的各項參數(shù),其中〈α〉代表極化率。極化率一方面可以用來描述光與團簇間的相互作用,另外其對于團簇的形狀和結構非常敏感,同樣也是分析團簇形變程度的重要指標之一[14]。〈α〉值越大,代表團簇間的相互作用越弱,即說明該團簇越容易發(fā)生形變。Δα代表極化率的各向異性不變量,它可以表征團簇在外加電場中的響應,Δα值越大,構型越容易受到外電場的影響,說明構型的各向異性越大。〈α〉和Δα可分別通過公式計算得到,相應計算公式為:
〈α〉=(αxx+αyy+αzz)/3,
由表4可知,構型4(4)的極化率(283.537)以及極化率各向異性不變量(19.928)均大于其余優(yōu)化構型,說明該構型在外電場作用下內部電子分布變化較大,多數(shù)電子受到外電場影響從而引起松動,構型的變形性較大,原子間的排斥作用使得構型的結構拉長。為了更加直觀地觀察團簇Ti4P的7種優(yōu)化構型之間極化率的關系,基于表4數(shù)據(jù)繪制出如圖4所示的團簇Ti4P各優(yōu)化構型的極化率變化趨勢圖。根據(jù)圖4可以看出,構型1(2)和2(4)的極化率(238.470和238.612)非常接近,這可能與兩構型的空間結構有關,二者均為三角雙錐型且原子位置相同,且二者的極化率在數(shù)值上均較小,說明這兩種構型結構較為緊密,原子間的相互作用相對較強,在相同條件下二者不容易發(fā)生形變,同時也可以推斷空間結構對極化率有一定的影響。

表4 團簇Ti4P的極化率Tab. 4 Polarizability of Ti4P clusters
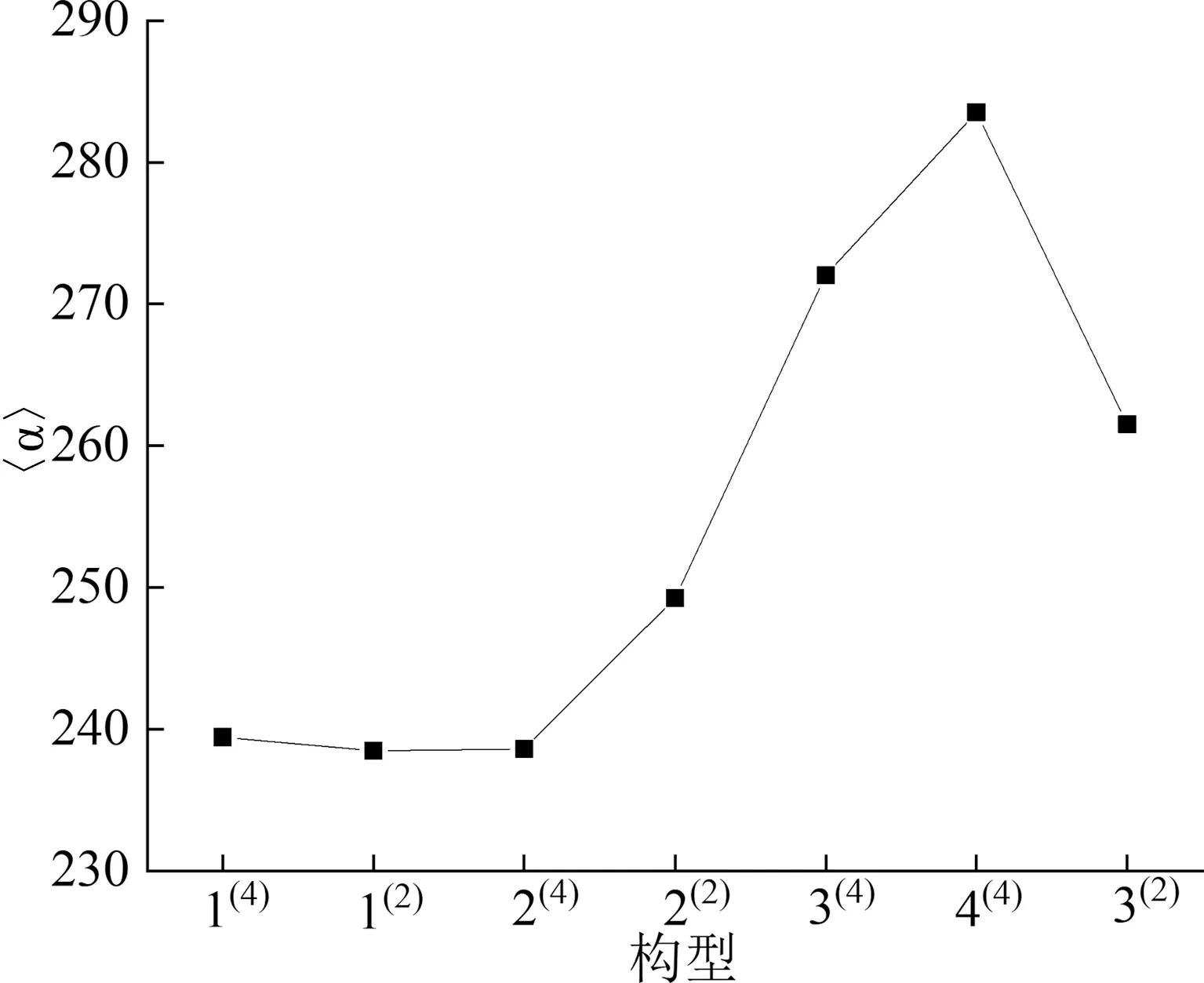
圖4 團簇Ti4P各優(yōu)化構型的極化率Fig. 4 Polarizabilities of the optimized configurations of Ti4P clusters
3 結論
依據(jù)拓撲學原理和密度泛函理論,筆者設計出Ti4P可能存在的構型并且對其進行量子化學計算,得到優(yōu)化構型后,依據(jù)過渡態(tài)相關理論,分別從過渡態(tài)空間結構、化學熱力學以及化學動力學3個主要方面展開研究。從空間結構來看,團簇Ti4P在異構化反應過程中各優(yōu)化構型均朝著利于Ti4—P鍵斷裂以及Ti1—Ti4鍵生成的空間構型轉化,且過渡態(tài)結構較為單一,均為戴帽三角雙錐型。從化學熱力學分析,通過比較團簇Ti4P化學反應異構化過程的能量和活化能,可以得到團簇Ti4P在異構化過程中朝著正向反應的趨勢更大,同時也證明了能量較低即穩(wěn)定性較好的構型更容易生成。隨著過渡態(tài)能量的升高,相對應的正逆反應活化能均對應升高,說明過渡態(tài)構型能量越低越容易進行異構化反應。從化學動力學角度來看,4種異構化反應過程均是正向進行且反應都較為徹底,在一定程度上可以說明活化能較大的反應其反應速率較慢;另外根據(jù)分析可以推斷反應物對異構化反應的正逆反應速率以及平衡常數(shù)的影響較大。
通過對團簇Ti4P極化率的分析可以得到構型1(2)和2(4)結構較為緊密,原子間的相互作用較強,說明在相同條件下二者不容易發(fā)生形變,因此推斷空間結構對極化率有一定的影響。

