有機磷化合物的膽堿酯酶動力學研究進展
李克新,劉艷芹,劉玉龍,郭 磊,謝劍煒
(軍事科學院軍事醫學研究院毒物藥物研究所,抗毒藥物與毒理學國家重點實驗室,北京 100850)
包括軍用制式神經性毒劑(nerve agents,NA;又稱有機膦神經性毒劑)和有機磷農藥在內的有機磷化合物(organophosphorus compounds,OP)是一類典型的強膽堿酯酶抑制劑[1],其按照骨架結構可劃分為13類(圖1),包括磷酸鹽、膦酸鹽、次膦酸鹽、硫逐磷酸酯、硫逐膦酸酯、硫趕磷酸酯、硫趕膦酸酯、二硫代磷酸酯、三硫代磷酸酯、氨基磷酸酯、硫代氨基磷酸酯、氟磷酸酯和氟膦酸酯[2]。事實上,NA的研發肇始于二戰期間德國對殺蟲劑的開發,曾用于局部軍事沖突或恐怖襲擊,對人員健康造成了嚴重威脅。
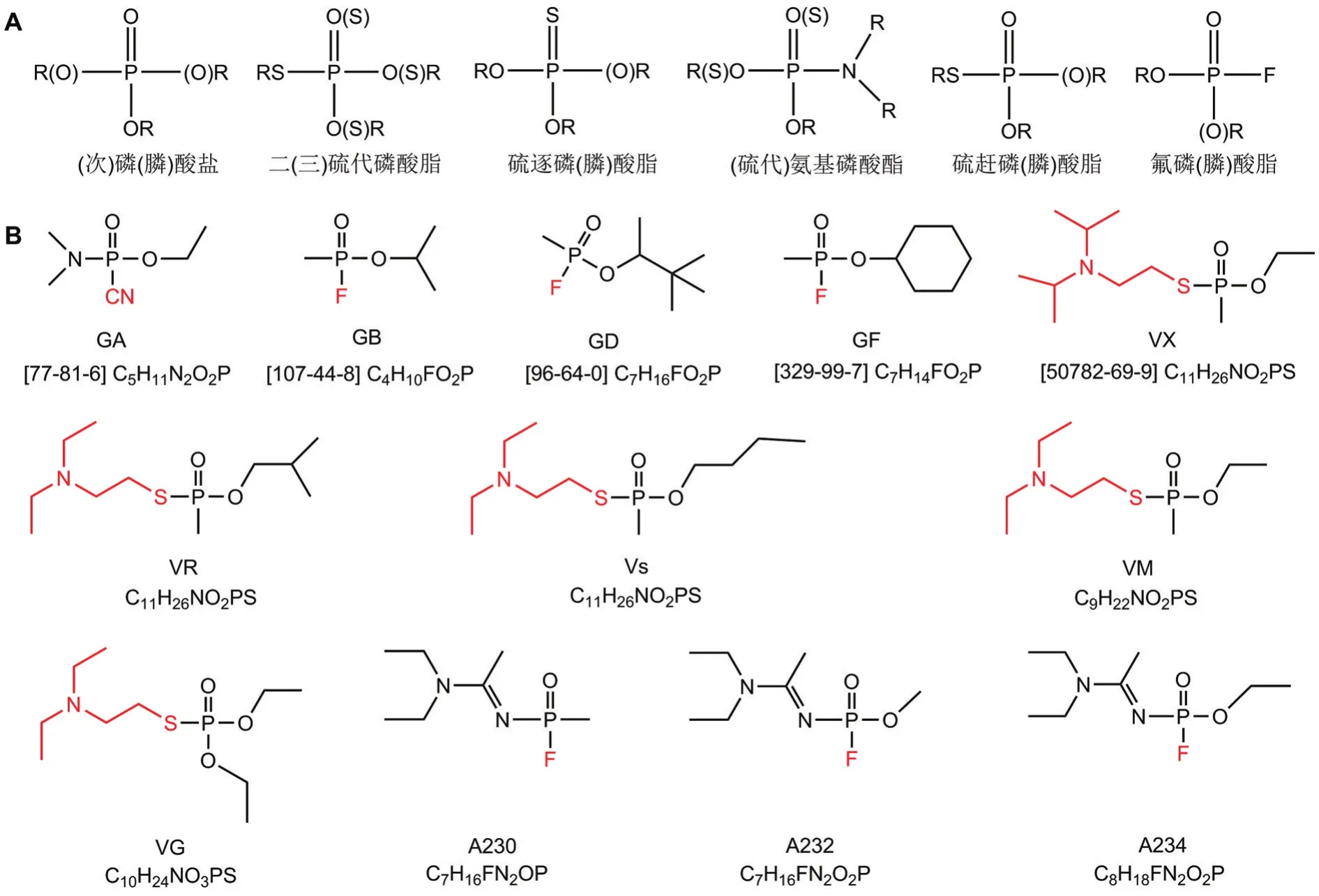
圖1 有機磷化合物(OP)骨架結構(A)與神經性毒劑(NA)結構式(B).GA:塔崩;GB:沙林;GD:梭曼;GF:環沙林;VX:維埃克斯;VR:俄羅斯維埃克斯;Vs:維埃斯.
OP對膽堿酯酶(cholinesterase,ChE)的動力學研究是所有OP毒性機制和抗毒藥物研究的重要基礎。過去幾十年來積累了大量針對不同結構OP和不同種屬ChE的抑制、老化和重活化的動力學數據,為OP毒性研究和重活化劑重活化作用的構效關系分析提供支持,也為尋找更有效的重活化劑奠定了基礎[3-4]。目前,雖然已合成了上千種重活化劑,仍未發現一種重活化劑能有效對抗不同結構OP導致的ChE中毒;且對于梭曼(soman,GD)等導致ChE快速老化的抑制劑,還未發現十分有效的重活化劑。本文針對特定重活化劑對不同結構OP的重活化作用不一及老化酶難于重活化等難點問題,從酶動力學角度全面綜述了NA和部分OP對ChE的抑制、老化與重活化動力學研究,以期為全面了解OP的毒性特征、有效評估ChE重活化劑,以及開發更有效的治療方案等提供有益參考。
1 OP種類及毒作用機制
NA主要包括G類和V類2大類,G類毒劑包括塔崩(tabun,GA)、沙林(sarin,GB)、GD和環沙林(cyclosarin,GF)等,多具有較強揮發性和低持久性;V類毒劑包括維埃克斯(VX)、俄羅斯維埃克斯(VR)、維埃斯(Vs)、VM和VG等,揮發性較差,但在環境中持久性較強[5]。2020年6月,禁止化學武器組織首次正式修訂《禁止化學武器公約》,將諾維喬克類(novichoks)毒劑在化學品禁控清單1中增列為1A13-1A15[6]。諾維喬克類毒劑被定義為第四代化學戰劑,又被稱為A類NA。有報道顯示,其毒性是VX的5~8倍[7],但也有報道其毒性略低于VX[8]。
有機磷農藥種類繁多,按照毒性強弱可分為高毒、中毒和低毒3類,高毒類農藥包括對硫磷、內吸磷和磷胺等,中毒類農藥包括敵敵畏和甲基對硫磷等,低毒類農藥包括敵百蟲、樂果和馬拉硫磷等。其中甲胺磷、甲基對硫磷、對硫磷、久效磷和磷胺等有機磷農藥已于2007年起在國內全面禁止生產、銷售和使用;此外,氧樂果、甲拌磷和克百威等毒性較大的農藥也將被進一步被淘汰。而毒死蜱由于其廣譜、高效、低殘留,是替代高毒有機磷農藥的首選,在我國市場占據重要地位[9]。
在機體中,OP主要通過對乙酰膽堿酯酶(acetyl?cholinesterase,AChE)活性的抑制發揮毒性作用。AChE主要存在于中樞神經系統、外周神經系統、神經肌肉連接處和紅細胞膜等部位,位于突觸間隙的AChE負責催化神經遞質乙酰膽堿迅速水解為膽堿和乙酸,終止神經信號傳導。但當OP存在時,OP與AChE反應形成磷(膦)酰化酶(中毒酶),導致神經突觸間隙ACh過度累積,進而導致膽堿能受體過度激活,使膽堿能神經系統功能亢進,產生毒蕈堿樣、煙堿樣和中樞神經系統中毒癥狀,甚至造成機體死亡。中毒治療即主要根據中毒癥狀,采用重活化劑、抗膽堿能藥物和抗驚厥藥物等聯合用藥[10]。
2 膽堿酯酶動力學文獻計量聚類分析
在中國知網以“膽堿酯酶動力學”“有機磷化合物”和“神經性毒劑”等為主題詞,在Web of Science核心合集下分別以“cholinesterase kinetics”、“organophosphorus”“nerve agent”和“enzyme kinetics”等為關鍵詞,對1995-2021年的ChE動力學文獻進行檢索,文獻題錄導入Endnote X9文獻管理軟件,去重后共得到669篇文獻,使用文獻計量分析軟件 VOSviewer[11],進行國家、作者和關鍵詞聚類分析(圖2),并對ChE動力學的發展按年代進行梳理分析(圖3)。
對Web of Science核心合集的文獻進行國別分析,設置發表文獻數>5的國家,發現美國、德國和法國依次占據前三位,我國發表文獻數量排在第9位,而總被引次數排在第18位(圖2A)。
其次進行作者分析,在57位發表篇數>5篇的作者中,德國聯邦國防軍藥理毒理研究所的Thiermann Horst和Worek Franze課題組、及俄羅斯喀山聯邦大學神經藥理學實驗室Masson Patrick等在該領域具有較深入研究(圖2B)。
關鍵詞聚類分析時,設置顯示出現次數>15次的關鍵詞,進行同義詞合并、去除無用關鍵詞后得到58個關鍵詞和4個聚類(圖2C)。聚類Ⅰ集中于ChE自身的酶動力學機制及活性位點分析;聚類Ⅱ集中于OP抑制ChE的老化和重活化動力學研究;聚類Ⅲ集中于以分子對接手段發現新型重活化劑或用于治療阿爾茨海默癥的膽堿酯酶抑制劑;聚類Ⅳ則集中于有機磷農藥的分析毒理學等。此外,雖然AChE貫穿這4個聚類,但丁酰膽堿酯酶(butyryl?cholinesterase,BChE)的研究也不容忽視。
按照年份進行分析,近年來ChE動力學研究主要集中于通過分子對接手段尋找新型重活化劑,繼而集中于OP抑制ChE的重活化動力學研究等方面(圖2D,圖3)。
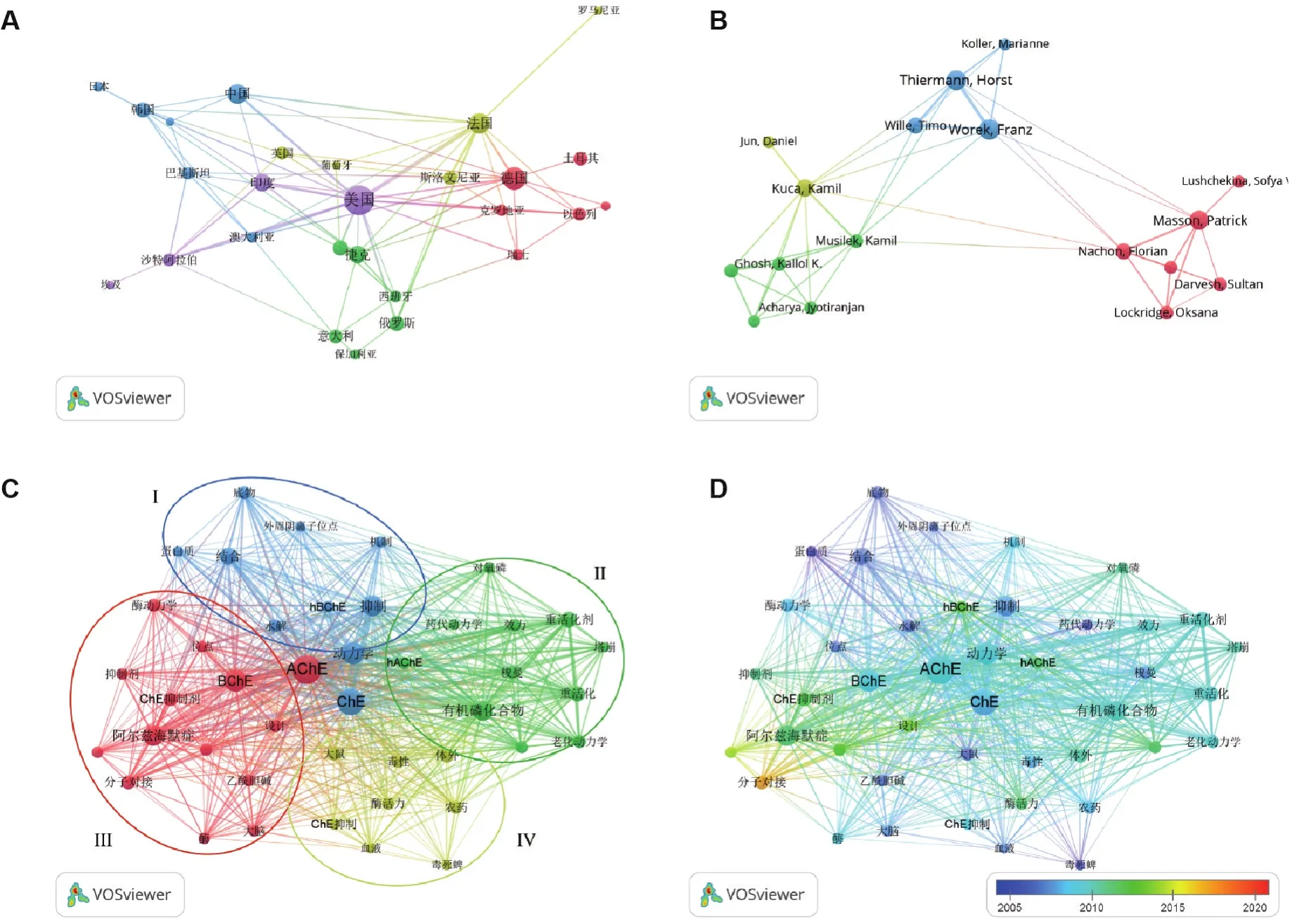
圖2 采用文獻計量軟件VOSviewer對膽堿酯酶(ChE)動力學研究文獻的分析結果.(A)國別分析;(B)作者分析;(C)關鍵詞聚類分析;(D)年份分析.AChE:乙酰膽堿酯酶;hAChE:人乙酰膽堿酯酶;BChE:丁酰膽堿酯酶;hBChE:人丁酰膽堿酯酶.圖C中聚類I~IV分別用藍色、綠色、紅色和黃色表示.
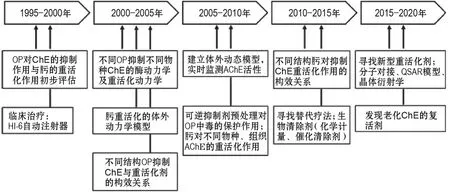
圖3 ChE動力學研究發展趨勢.HI-6:酰胺磷定;QSAR:定量構效關系.
3 OP的膽堿酯酶動力學研究
3.1 OP抑制ChE的反應機制
OP主要通過強抑制AChE活性發揮毒性作用,在此以氟膦酸酯類結構為代表,繪制了OP抑制ChE的反應機制(圖4)。在生理條件下,位于AChE活性位點的絲氨酸-組氨酸-谷氨酸(Ser-His-Glu)催化三聯體的電子由Glu殘基、His殘基連續轉移至Ser殘基的羥基基團,隨后親核進攻OP的磷原子,此時氟離子離去、膦酰化酶形成。該膦酰化酶可進行自發水解(自發重活化)而恢復活性,然而由于OP的磷原子與AChE的Ser羥基之間形成了共價鍵,其自發重活化過程非常緩慢(圖4,途徑A)。
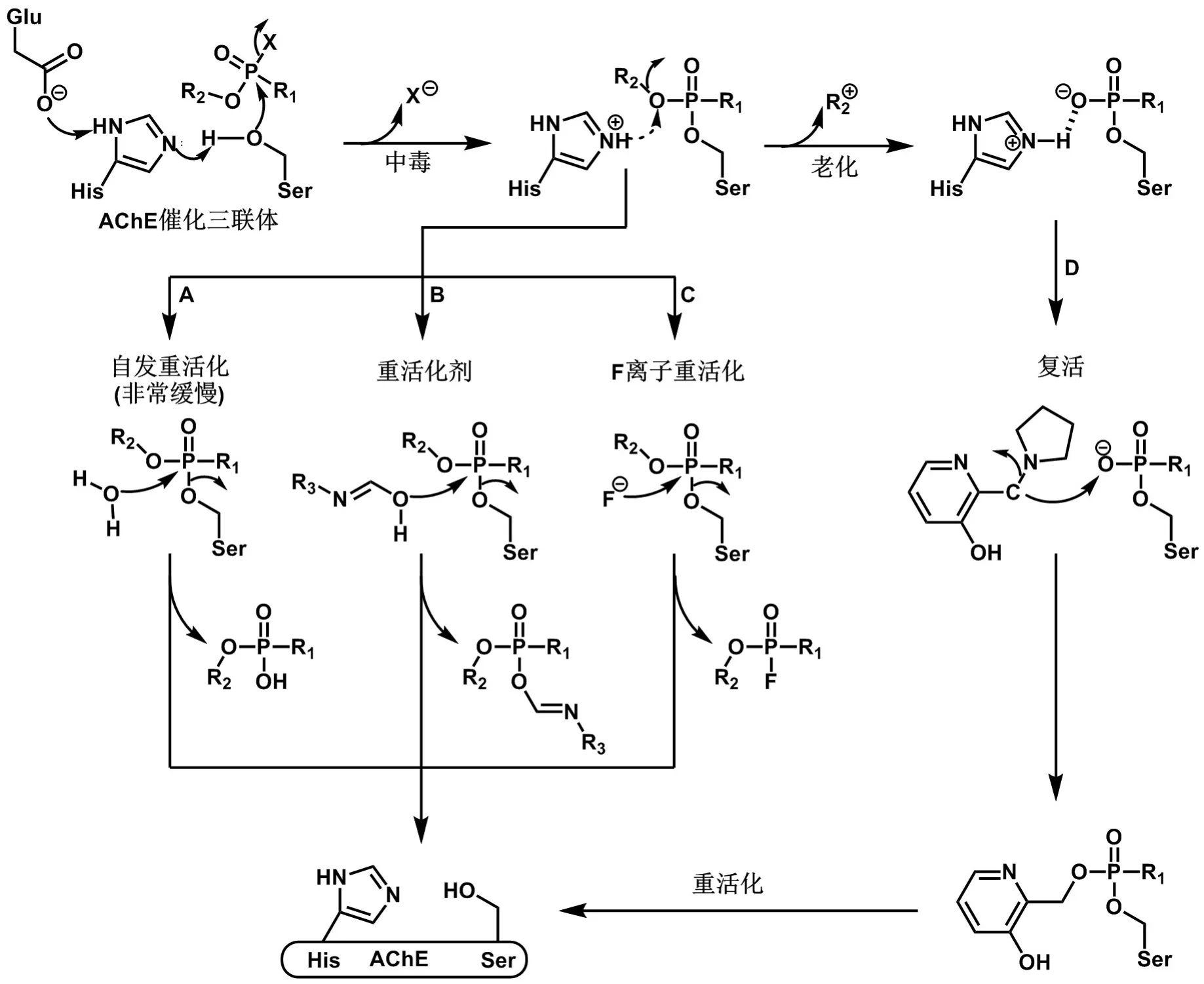
圖4 OP中毒、老化和重活化與復活機制.
一般而言,除難于重活化的少部分膦酰化酶外,膦酰化酶可通過重活化劑(如肟,圖4,途徑B)或氟離子(圖4,途徑C)重活化而恢復活性,此時重活化劑或氟離子進攻該膦酰化酶的磷原子形成膦酰化肟和氟膦酸酯離去,從而恢復AChE活性,該進程較自發重活化更為迅速。此外,該膦酰化位點會發生脫烷基反應,這一過程稱為“老化”,老化酶的羥基氧原子與催化三聯體中的質子化His形成鹽橋得以穩定。原來的觀點曾認為,由于老化后磷原子的正電性較弱,會阻止肟類重活化劑的負電性親核基團進攻該磷原子,該酶將永久失活。然而,2018年Hada等[12]揭示了一種曼尼希堿類重活化劑,該類重活化劑能夠進攻老化酶中膦酰化基團的羥基氧原子,使該膦酰化基團重烷基化,再通過重活化劑的重活化作用恢復AChE的活性。這一通過重烷基化作用恢復老化AChE活性的過程稱為復活(resur?rection)(圖4,途徑D)。
3.2 ChE動力學研究方法
近70年來,已積累了大量ChE的抑制、老化和自發重活化與重活化動力學研究數據,主要包括抑制速率常數(ki)、自發重活化速率常數(ks)、老化速率常數(ka)以及重活化速率常數,其中重活化速率常數包括解離常數(KD),最大一級重活化速率常數(kr),和總二級重活化速率常數(kr2)。KD與中毒酶對重活化劑的親和力成反比,近似于中毒酶的解離常數。
Ellman法是ChE動力學研究的經典方法,通過測定OP抑制和重活化后的ChE活性,從而對OP的毒性及重活化劑的重活化能力進行評價[13-14]。基本原理為,底物碘化乙酰硫代膽堿在AChE作用下發生分解反應生成硫代膽堿,顯色劑5,5′-二硫代雙(2-硝基苯甲酸)與硫代膽堿迅速反應生成黃色的5-巰基-2-硝基苯乙酸,針對該產物在其最大紫外吸收波長(412 nm)處的變化進行測定。
在Ellman法基礎上,目前已發展了多種不同底物〔如3-(乙酰氨基)-N,N,N-三甲基苯胺和苯甲酰基硫代膽堿[15]〕和不同熒光探針(如能與含硫醇的化合物快速發生親核反應的香豆素衍生物Calbio?chem Probe Ⅳ[16])等,從而拓展方法適用范圍。此外,對于ChE活力測定,還有Test-mate ChETM法、Michel(△pH)法、WRAIR WB法和Amplex Red AChE檢測試劑盒等,主要用于OP暴露人員的篩查與確證。其中,WRAIR WB法以4,4′-聯吡啶二硫醚作為硫代膽堿顯色劑,可最大程度地避免血紅蛋白對吸光度的影響,針對4℃保存或-80℃凍存的微量人全血能夠同時測定紅細胞(red blood cell,RBC)AChE和血漿BChE酶活力[17]。
雖然ChE動力學研究已發展了數十年,但尚需注意和綜合考量多種因素,如酶的種屬、類型、濃度、溫度,甚至緩沖液類型等,以及適用的擬合方式、評價目的等,方能獲得可靠結果。例如,OP抑制ChE動力學研究大多在磷酸鹽類緩沖液(0.1 mol·L-1)中進行,但磷酸鹽類緩沖液會加速OP水解[18],而包括三羥基甲基氨基甲烷和三羥甲基甲胺基乙磺酸在內的“Good′s buffer”緩沖液會與OP形成加合物[19],因此使用上述類型的緩沖液時,尚需根據使用目的和分析物等進行選擇,以排除其不利影響。另外,在重活化動力學實驗中,不同來源的ChE存在顯著差異,與嚙齒類動物和豬源相比,人源ChE對OP更加敏感,且更易重活化[20]。
然而,即使在緩沖液體系與ChE類型均一致的條件下,各研究工作的重活化動力學數據也難于直接進行比較。首先是溫度的影響,37℃下重活化劑對中毒酶的重活化作用優于25℃;其次,當中毒酶濃度<5 nmol·L-1時,反應性常數kr隨其濃度升高而降低,導致了各實驗數據間的不可比較性,而當中毒酶濃度> 5 nmol·L-1時,kr值基本不變,因此應將中毒酶濃度控制在該濃度范圍內[21]。考慮到重活化劑kr與KD的測定受中毒酶和重活化劑濃度影響均較為顯著,一般通過比較kr2來評估重活化劑對中毒酶的重活化作用。在kr2的評估過程中,依賴于最大重活化率的非線性回歸方法容易造成在任何給定重活化劑條件下的一級重活化速率常數(Kobs)的高估,此時可采用初始部分的線性回歸方法。在重活化率較差(<20%)的情況下,一般通過比較最大重活化率和達到最大重活化率的時間對重活化劑的重活化能力進行評價。
目前主要使用的酶包括人紅細胞(human RBC,hRBC)AChE、重組人AChE(recombinant human AChE,rhAChE)、腦AChE和hBChE等。Herkert等[22-23]發現RBC AChE可作為OP中毒后突觸AChE的合適替代生物標志物,且腦AChE和RBC AChE的抑制和重活化動力學具有高度可比性。對于有機磷農藥中毒患者,RBC AChE的體外動力學數據也與體內AChE狀態存在密切相關性[24]。雖然BChE的生理功能尚不清楚,但由于血漿BChE是OP的生物清除劑[25],多數研究中均開展了AChE和BChE間動力學參數的差異比較研究。重活化劑作用的主要機制是從ChE的Ser活性位點上去除磷(膦)酰化基團,一般而言,BChE對OP和重活化劑的敏感性低于AChE,且自發重活化速率較低[26],因此對于重活化劑療效的評估,測定AChE的活性較BChE更為可靠[27]。
3.3 ChE抑制動力學
關于不同結構OP對ChE的抑制、老化與自發重活化動力學研究,匯總了NA和部分有機磷農藥對hAChE和hBChE的ki,ka和ks值(表1)。Worek等[28]深入研究了G類和V類NA對于hAChE的抑制動力學,測定了抑制速率常數ki。兩類NA對hAChE均存在極強抑制作用,ki值在106~108L·mol-1·min-1之間。對OP結構與ki值的構效關系進行分析,有助于深入了解OP毒性特征。如針對hAChE體系,帶有C1-C5側鏈基團的系列GB類似物,隨正烷基鏈和異烷基鏈延長(除GB外),其ki值逐漸增加,毒性逐漸增強[29]。

表1 不同結構OP對ChE的抑制(ki)、老化(ka)和自發重活化(ks)速率常數
有機磷農藥的毒性較NA低,部分農藥的ki值遠低于NA,大多在1×102~1×106L·mol-1·min-1之間[30-31]。此外,Schopfer等[32]研究了生物素化有機磷酸酯(FP-biotin)抑制hAChE和hBChE的酶動力學,FP-biotin結構特征為O-乙基氟膦酰化基團與生物素標簽共價結合,雖然體積較大,但所得到的酶動力學參數與GB和GF較為相近。另外,FP-biotin可用于鑒定與OP反應的蛋白質,適用于尋找OP暴露的新生物標記物。
3.4 ChE老化與重活化動力學
一般而言,以適當濃度的OP與hAChE作用一定時間(抑制率達95%~98%),采用透析法除去過量OP后,可用于中毒酶的老化與重活化動力學研究。對于NA,除GD可使hAChE在數分鐘內快速老化外,GB在數小時內老化,GA和GF在1 d內老化,V類毒劑的老化速度較慢,一般為數天;自發重活化動力學方面,hAChE除與V類毒劑和丁基沙林作用后能檢測到自發重活化外,與其他G類毒劑作用后均未檢測到自發重活化[28]。此外,由有機磷農藥抑制產生的二甲基和二乙基磷酰化hAChE的老化和自發重活化可以同時發生[30-31]。中毒酶的重活化動力學研究主要圍繞幾種臨床常用的肟類藥物展開,包括奧比醛肟(雙復磷,obidoxime,OBI)、酰胺磷定(asoxime,HI-6)、醛肟吡胺(解磷定,prali?doxime,2-PAM)、甲肟(methoxime,MMB-4)、雙解磷(trimedoxime,TMB-4)和雙吡啶二肟(HL?7)等。采用連續程序進行重活化動力學研究時,為避免肟對AChE的抑制作用,使用肟的最大濃度一般不超過 100 μmol·L-1;在肟重活化作用較低的情況下,可采用不連續程序進行重活化動力學研究,此時允許使用的肟濃度最高可達5 mmol·L-1。
對于hAChE,不同OP和肟之間相互作用的動力學參數存在顯著差異[28],代表性OP抑制hAChE的肟致kr2如圖5所示。對除GA外的G類和V類NA抑制hAChE,重活化作用HL?7>HI-6>OBI,HL?7和HI-6的kr2值均>10 L·mmol-1· min-1,OBI的kr2值均>5 L·mmol-1·min-1(除 GD 和 GF);2-PAM 和MMB-4的重活化作用較差,對G類毒劑抑制hAChE的kr2值幾乎均<1 L·mmol-1·min-1,對V類毒劑抑制hAChE的kr2值在1~10 L·mmol-1·min-1之間[38-39]。對GA抑制hAChE(>80%抑制),OBI,TMB-4和HL?7作用30 min后重活化百分比>50%,而HI-6,2-PAM和MMB-4作用30 min后重活化百分比<20%[40]。對有機磷農藥抑制的 hAChE,OBI的重活化作用較強,HL?7次之,HI-6和2-PAM的重活化能力一般,MMB-4的重活化作用較差[28]。一般認為,2-PAM和MMB-4是大多數OP抑制hAChE的弱重活化劑;HI-6對氨基磷酸酯類OP抑制的hAChE重活化作用較弱,對其他NA抑制的hAChE的重活化作用較強;OBI能有效重活化包括氨基磷酸酯在內的大部分OP抑制的hAChE;HL?7可認為是對OP具有廣泛重活化作用的廣譜重活化劑,但該肟在溶液中很不穩定。
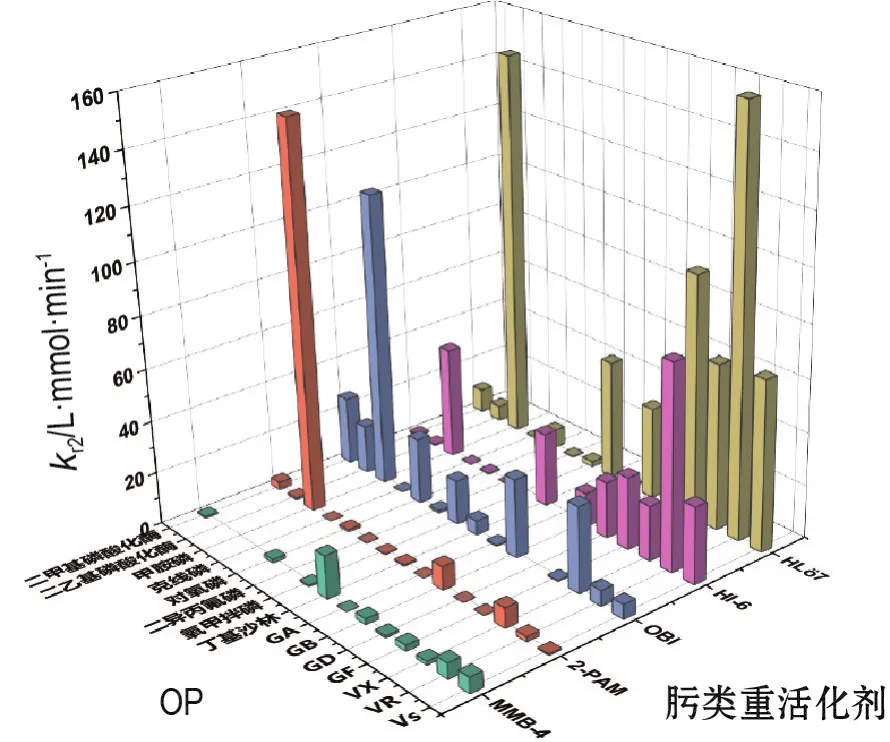
圖5 OP抑制hAChE的肟致總二級重活化動力學常數(kr2)[28,30,33-35,37,45,56].MMB-4:甲肟;OBI:奧比醛肟;HI-6:酰胺磷定;HL?7:雙吡啶二肟.
3.5 不同物種的ChE動力學研究
為了加深對物種差異的理解,使動物數據更可靠地外推到人類,對不同物種ChE動力學常數的準確測定十分必要[41]。多數研究以小鼠、大鼠、豚鼠和兔等為模型展開,但越來越多的證據表明,嚙齒類動物和人類AChE的動力學特性存在顯著差異,并不適合作為評估重活化劑重活化作用的動物模型[36,42],而大型動物模型更為適用。Dalton等[43]在腹部拉皮術中,在患者(38~63歲)完全知情同意情況下,獲取了人腹部皮膚。利用豚鼠、豬和人的皮膚比較了VX的體外皮膚吸收動力學,發現豬和人的皮膚通透性無顯著性差異,對VX的穩態滲透速率常數分別為333±226 和(207±62)μg·cm-2·h-1,因此豬是人體VX經皮暴露的合適動物模型。此外,由于與人類的相似性,非人靈長類動物如恒河猴已成為針對OP中毒醫療對策研發中最常用的大型動物模型,用于評估OP毒性和重活化劑的重活化作用。非人靈長類動物血液循環中的AChE活性水平與人相似,且不同NA如GB和VX抑制AChE的ki值和半數抑制濃度(median inhibition concentration,IC50)與人類一致[41,44];Luo等[45]使用3種NA和4種肟研究發現非人靈長類動物和人類AChE的老化及重活化動力學結果一致。
3.5.1 體外動力學模型
ChE抑制劑的毒代動力學、解毒劑的藥動學性質和劑量以及重活化劑的重活化能力間的物種差異,阻礙了動物數據向人類的外推。Worek等[46]開發了一種體外動力學模型,可以計算不同OP抑制和肟重活化時的hAChE活性隨時間變化情況;并通過農藥中毒患者相關數據驗證了該模型,同時使用公開數據對靜脈內GB、GF和樂果暴露,經皮VX和VR暴露,以及不同重活化劑(OBI,HI-6和2-PAM)治療進行模擬[47-48];進一步還涵蓋了氨基甲酸酯預處理hAChE的藥動學和酶動力學[49]。該模型所提供的基于物種特異性的動力學數據,預計可將動物數據更可靠地外推至人類,是定義重活化劑有效濃度和優化治療的有效工具。
3.5.2 體外動態模型
體外靜態實驗中,對于膜上AChE活性測定,大多采用表面活性劑溶解的酶進行酶動力學測定。為了研究不同物種、不同組織AChE的酶動力學,Eckert等[50]發展了一種通用的體外動態模型,即將AChE固定在生物反應器中,再以OP連續灌流,能夠實時監測不同物種、不同組織AChE的活性,以揭示物種依賴的動力學相互作用。通過該體外動態模型,Herkert等[51]測定了GB或對氧磷抑制獼猴、豬和豚鼠RBC AChE的肟致重活化作用,結果與體外靜態實驗吻合,證實了該模型可用于人和動物RBC AChE、OP和肟之間的相互作用研究;此外,該模型還可用于闡釋包括氨基甲酸酯類在內的ChE可逆抑制劑的預處理對OP中毒的保護作用[52]。利用該體外動態模型研究不同組織AChE的酶動力學特性,發現人RBC、肌肉和腦AChE的米氏常數幾乎相同(人肋間肌條來自胸外科手術患者,人腦組織樣本來自腦癌手術患者);在所有受試物種中,腦AChE和RBC AChE的抑制和重活化動力學具有高度可比性[23]。
對于GD、N,N-二乙基GA和N,N-二正丙基GA等難于重活化的NA,體外動態模型能夠排除其他因素,降低副反應影響,是研究抑制hAChE的肟致重活化動力學的良好策略之一[42]。如Worek等[53]在體外動態模型上研究了GA及2種類似物抑制hAChE的肟致重活化動力學,因為該體外動態模型可實現連續灌流,因此推測GA及其類似物抑制hAChE難于被肟重活化的原因仍然可能是其與hAChE峽谷中的殘基發生相互作用,阻止了肟的進攻,從而難以有效重活化,而非由于膦酰化肟的再次抑制。
4 新型重活化劑
自1955年發現第一個供臨床使用的肟類藥物2-PAM以來,科學家已經合成了數千種肟類化合物,但仍沒發現一種能夠重活化被所有不同結構OP抑制的ChE,新型重活化劑的研究方興未艾[54]。早期工作主要集中于荷電型季銨鹽類單吡啶肟和雙吡啶肟的合成與評價,例如,為深入了解與被抑制AChE具有足夠親和力和反應性的肟類化合物的結構要求,Kuca等[55]對肟的季銨鹽結構、吡啶環間連接鏈的長度和剛性、肟基結構、肟基所在位置及數量這五大因素進行比較分析,發現雙吡啶肟重活化作用更強,且肟基位置對不同OP影響較明顯。Sahu等[56]分析了一系列丁烯基連接的雙吡啶單肟對GA,GB,VX和對氧磷抑制AChE的重活化作用,結果顯示,含不同功能基團的丁烯基連接的雙吡啶單肟是良好重活化劑。Winter等[57]和Horn等[58]對具有不同連接基、肟基不同位置和部分附加取代基的雙吡啶單肟和雙吡啶二肟進行研究,發現肟基在雙吡啶環上的位置及OP的種類對肟的重活化效能起決定性作用,如在吡啶環4位上的2個肟基對GA抑制AChE的重活化是必需的;連接基團如亞甲基、氧基二亞甲基或三亞甲基對肟的重活化作用影響并不一致[59]。
由于單種肟治療對不同結構OP抑制ChE缺乏廣譜重活化作用,在發現更有效的重活化劑之前,可將聯用多種重活化劑作為解決方案。Worek等[60]通過體外動態實驗發現OBI與HI-6雖無協同作用,但可拓寬重活化范圍。Kassa等[61]通過體內實驗深入研究了經典肟OBI和HI-6與新型雙吡啶肟K727和K733聯用對不同OP中毒動物的治療作用,表明肟的聯用可降低OP的急性毒性,提高動物存活率。
由于血腦屏障的存在,季銨鹽肟類重活化劑無法進入中樞,因而難以恢復中樞系統內中毒AChE的活性,因此近年來研究主要集中于向非荷電型肟類和非肟類重活化劑中引入不同取代基來改善其作用特征[62-63],使利于進入并恢復中樞系統內中毒AChE的活性。目前4-氨基-2-(吡咯烷-1-基甲基)苯酚是已報道的重活化作用最強的非肟類重活化劑,但其本身對hAChE存在一定抑制作用(IC50值為 6.3 μmol·L-1);對不同 NA 抑制的 hAChE,4-氨基-2-(吡咯烷-1-基甲基)苯酚 100 μmol·L-1作用30 min可分別重活化50%(GB)、75%(GF或對氧磷),甚至100%(VX)[64]。
中毒AChE的老化問題一直難以通過任何治療方法來解決,直到2018年,Zhuang等[12]提出老化AChE的重烷基化可能恢復老化AChE活性,這一過程稱為復活。對老化的甲基膦酰化和異丙基膦酰化電鰩AChE,曼尼希堿類重活化劑〔2-(吡咯烷-1-基甲基)吡啶-3-醇〕作用4 d能使其活性恢復至32.7%和20.4%,但該過程僅在pH9條件下快速進行。此外,老化AChE的復活和重烷基化仍具有挑戰性,例如底物必須以活性構象選擇性地結合在活性位點上,從而產生關鍵的反應性中間體,以實現所需的重烷基化,然后重烷基化的膦酰化Ser才能被良好的親核試劑重活化。
為開發更有效的廣譜重活化劑,研究與ChE催化活性位點和外周陰離子位點同時作用的重活化劑是一個重要方面[5,65]。同時,結合晶體衍射學及分子對接等方法,可以尋找重活化劑結構與ChE活性位點間的關系,從而更好地進行結構篩選[66-67]。通過新型藥物劑型,將重活化劑遞送至中樞等亦是一種有效的努力方向。
5 生物清除劑
目前仍未找到任何一種重活化劑能對不同結構OP抑制的ChE進行重活化,且機體暴露于大劑量的或持久性較強的OP時,也會導致重活化劑的治療效果不足,因此其他替代療法亦具有重要價值。
化學計量生物清除劑和催化清除劑等可以防止全身性OP中毒、降低體內OP濃度。血漿BChE作為化學計量清除劑,較其他肟類重活化劑及抗驚厥藥物在血漿中停留時間較長,可提供較強保護作用[68]。其缺點在于需要大量血漿BChE來結合低濃度OP,且只有在OP到達目標組織之前給藥才能發揮作用。而催化清除劑顯示出預防和治療OP中毒的可行性,其不會被OP消耗,可以在較低劑量下使用。目前對OP解毒最有前途的酶是來自缺陷假單胞菌的磷酸三酯酶,已經篩選了多種不同突變體來提高其對毒性較高OP對映異構體的立體選擇性,并可將催化活性提升4個數量級[69]。然而催化清除劑仍存在底物特異性高和催化活性低、體內穩定性差、和免疫原性等問題,具有反向立體選擇性的酶突變體是一種改善催化活性的有效途徑[70]。
此外,Zandona等[71]發現肟類重活化劑〔4-溴芐基-3-(羥基亞氨基)喹啉溴化銨〕與血漿BChE結合,可發揮催化清除劑的作用,在2 h內降解GF的速率比血漿BChE高100倍。Zhang等[72]通過原子轉移自由基聚合與“點擊”反應合成了BChE-聚合物-肟偶聯物,其中肟能夠重活化被抑制的BChE,從而加速OP消除。加入OP達到完全抑制后,該BChE-聚合物-肟偶聯物在5~6 h能自發重活化55%~84%。即使經歷了3個抑制-自發重活化循環,也依然具有較好的酶活力,能夠有效清除游離OP。
6 結語
OP作為AChE的強抑制劑,對人類生命安全構成顯著威脅。OP的ChE動力學研究,目前研究挑戰在于ChE動力學研究方法、不同物種ChE動力學常數的準確測定及外推、體內外評價模型的可比性和可靠性等方面。針對這些問題,①可發展適用范圍廣(如涵蓋全血)、高靈敏、抗干擾的新ChE動力學研究方法;②引入多參量實驗設計全面考察多因素影響,以獲得高可信度的準確結果;③綜合考慮包括羧酸酯酶等其他酯酶的催化清除作用;④發展更準確的體內外動力學動態測定及擬合模型等。考慮到不同結構OP抑制ChE的動力學差異較明顯,仍需獲取更多種類OP的ChE動力學參數,并在定量構效關系等方面加強研究。OP抑制ChE的重活化動力學研究仍是主要研究方向。包括新型復活劑——曼尼希堿類非肟類重活化劑在內的新型重活化劑是近年的研究熱點,但老化AChE的復活仍具有挑戰性。在現有重活化劑基礎上,通過結構改造和修飾、或經由適當的藥物劑型改善作用效果等手段,研發理想的新型重活化劑,使其具有易穿透血腦屏障、廣譜、起效快、或能復活老化ChE等特點將是今后努力的方向。

