高級別腦膠質瘤患者復發因素及相關參數研究
萬俊呈,陳潔
1.徐州醫科大學醫學影像學院,江蘇徐州 221004;2.徐州醫科大學附屬醫院放療科,江蘇徐州 221004
腦膠質瘤是由于大腦和脊髓膠質細胞癌變所產生的、最常見的中樞神經系統腫瘤, 發病率約占所有原發性腦惡性腫瘤的70%[1]。 據腦膠質瘤診療規范(2018 年版),我國腦膠質瘤年發病率為5~8/10 萬,5年病死率在全身腫瘤中僅次于胰腺癌和肺癌,且具有較高的復發率,較低的治愈率,嚴重威脅人們的生命安全。 此疾病患者臨床主要表現為嘔吐、復視、頭痛、局限性癲癇等,嚴重者甚至出現神經功能缺失癥狀,如癱瘓等,對其生活質量造成消極影響,目前,病因尚不明確,臨床醫學家研究分析,或許與腫瘤本身有著直接相關的聯系。 對于此疾病患者,為了緩解臨床癥狀,減輕其痛苦,延長生存時間,臨床主要運用放射、手術、化學治療等。現回顧性分析2013 年1 月—2019年5 月徐州醫科大學附屬醫院就診的77例患者,探討腫瘤分區、腫瘤最大徑與患者各項指標間的聯系,以及免疫組化的內在聯系,同時觀察患者腫瘤的復發時間影響因素。 現報道如下。
1 資料與方法
1.1 一般資料
選取在徐州醫科大學附屬醫院就診的77例腦膠質瘤術后復發患者為研究對象,其中男38例,女39例;年齡24~76 歲,平均(48.67±3.01)歲。 所有患者均進行了腫瘤切除或全近切除手術治療,腫瘤復發時間1~16 個月,平均(8.24±2.03)個月;腫瘤復發時間≤12個月51例,>12 個月26例。 同時77例患者均經病理組織學確診,WHOⅢ級37例,Ⅳ級40例;位于額頂葉37例,顳枕葉26例,基底節丘腦區6例,島葉3例,幕下小腦腦干區5例。 同時,其中有Ki-67 詳盡數據的有44例,有MGMT 詳盡數據的有36例,有IDH-1詳盡數據的有33例,有P53 詳盡數據的有35例。 該文參與研究的所有對象均屬于自愿參與,具有知情權,并簽署知情同意書;該研究經該院倫理委員會審批批準。
1.2 方法
所有患者均進行了腫瘤切除或全近切除手術治療,部分患者隨后進行了放化療或者γ 刀治療。 其中手術38例,手術+放療/手術+伽馬刀/手術+放化療39例。手術+放療的方式為術后2~4 周同步放療,1~42 d同步放療54~60 Gy/30 F。 手術+放化療的方式為術后2~4 周開始同步放化療,1~42 d 同步放療54~60 Gy/30 F,同步使用替莫唑胺(國藥準字H20060880)治療,用藥劑量每次為150 mg/m2,口服使用,1 次/d。 然后鞏固替莫唑胺6 周期,第1 周期150 mg/m2,1~5 d,第2~6 周期200 mg/m2,1~5 d,28 d 為1 個周期。 手術+γ 刀治療的方式為: 術后瘤床區7~9 Gy/f×2 f,口服替莫唑胺劑量與放療期間相同。
1.3 觀察指標
性別、年齡、腫瘤分區、手術入路、腫瘤直徑、病理級別、Ki-67、MGMT、IDH-1、P53。
免疫組化結果分級:MGMT -、+(<10%)、++(10%~30%)、++(>30%);Ki-67 -(<5%)、+(5%~25%)、++(25%~50%)、++(≥50%);P53-(<5%)、+(5%~10%)、++(11%~50%)、++(≥5~50%);EFGR -、+;IDH-1 -、+。
1.4 統計方法
采用SPSS 24.0 統計學軟件進行數據處理,計數資料采用[n(%)]表示,進行χ2和Fisher 檢驗,組間相關性采用Sperman 檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 腫瘤最大徑(<3 cm,3~6 cm,>6 cm)
腫瘤最大徑與患者的性別,年齡,腫瘤分區,病理級別及各項免疫組化參數均無關,差異無統計學意義(P>0.05)。 腫瘤最大徑不被其他因素所影響。 腫瘤最大徑<3 cm 有9例,占比11.7%,腫瘤最大徑3~6 cm有60例,占比77.9%,腫瘤最大徑>6 cm 有8例,占比10.4%。
2.2 腫瘤分區(額頂葉,顳枕葉,基底節丘腦區,島葉,幕下小腦腦干區)
腫瘤分區與患者的性別,年齡,病理級別及各項免疫組化參數均無關,差異無統計學意義(P>0.05)。腫瘤最大徑是獨立的因子,不受患者的各項指標影響。 額頂葉有37例,占比48.1%,顳枕葉有26例,占比33.8%,基底節丘腦區有6例,占比7.8%,島葉有3例,占比3.9%,幕下小腦腦干區有5例,占比6.5%。
2.3 免疫組化
IDH-1 與年齡、病理級別方面,差異有統計學意義(P<0.05);MGMT、Ki-67、P53 與性別、年齡、病理級別無關,差異無統計學意義(P>0.05)。 同時免疫組化參數之間,Ki-67 與P53 組別比較,差異有統計學意義(P=0.008)。
2.4 復發時間的相關影響因素
復發時間與年齡是否>65 歲、手術方式、病理級別、IDH-1 方面,差異有統計學意義(P<0.05)。見表1。
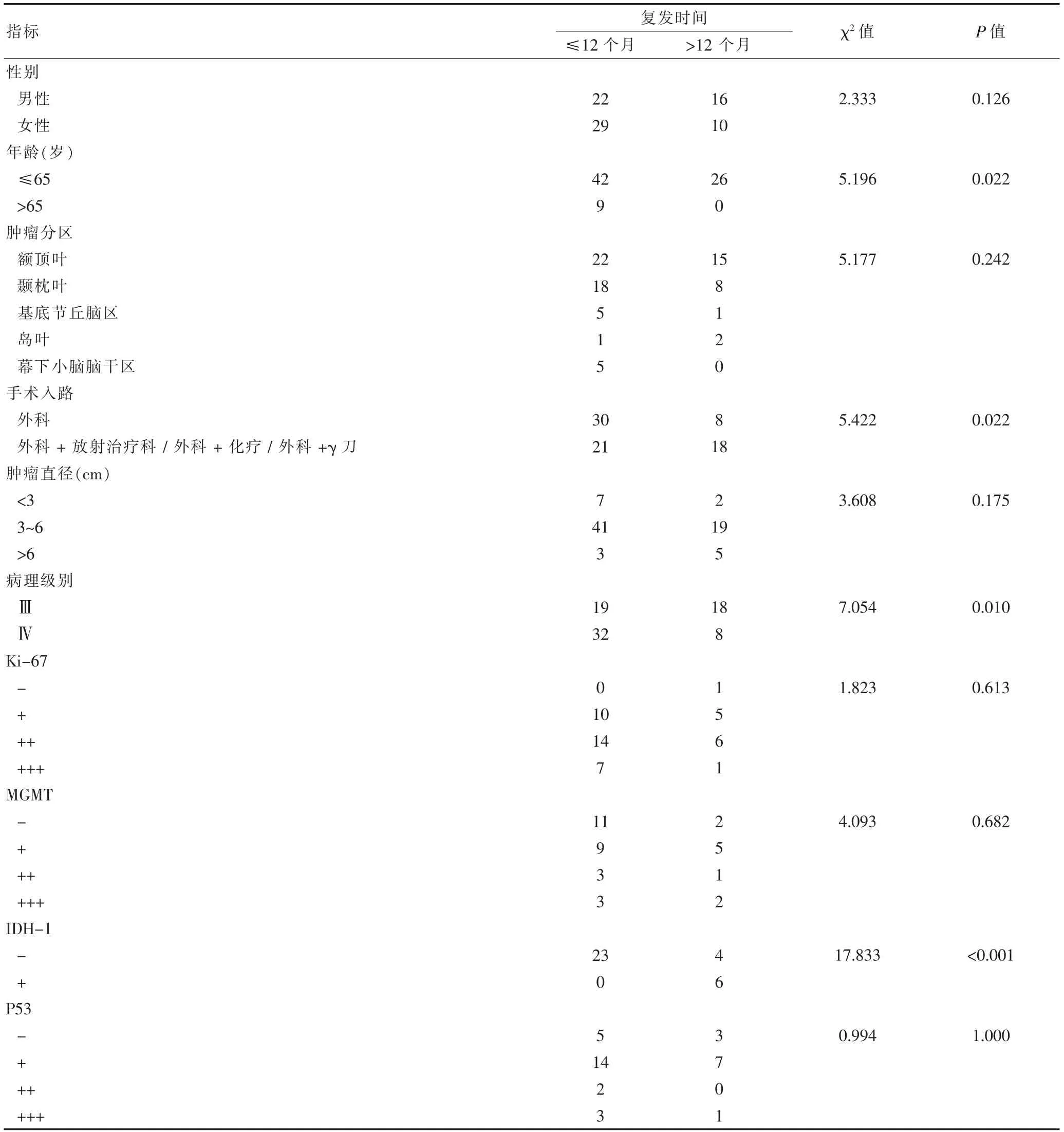
表1 復發時間的相關影響因素
2.5 免疫組化、復發時間的Sperman 分析
IDH-1 與年齡無關(P>0.05),與病理級別有關(P<0.05),Ki-67 與P53 有關(P<0.05);復發時間與年齡、病理級別、IDH-1 具有相關性(P<0.05),與手術方式無關(P>0.05)。 見表2。
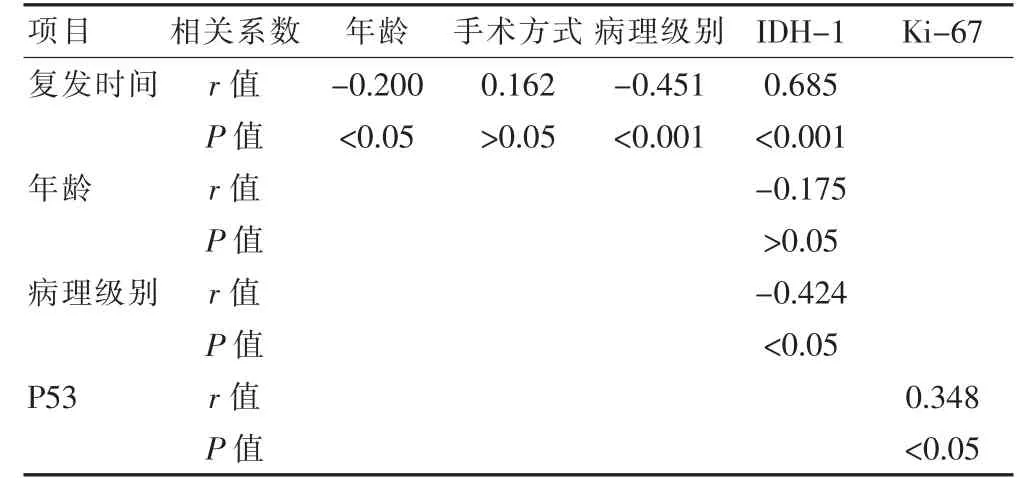
表2 免疫組化、復發時間的Sperman 分析
3 討論
Ki-67 免疫組化檢查在腦膠質瘤檢查中主要用于標記腫瘤細胞中處于增殖周期的細胞,隨著腫瘤惡性程度即腦膠質瘤級別升高,其在Ⅲ、Ⅳ級腦膠質瘤的陽性表達率上升,在Aboushousha T 等[2]的研究中,因為Ki-67 在活動期表達,在休眠期不表達,被看做評價腫瘤增殖水平的指標;P53 主要調節細胞周期,調節腫瘤的分化。MGMT 分子甲基化是主要的分子水平預后因素,影響高級別腦膠質瘤患者化療敏感性,甲基化發生率越高,MGMT 含量越低,預后越差。異檸檬酸脫氫酶(IDH)是三羧酸(TCA)循環中細胞呼吸的必需酶,IDH 突變影響著患者的腫瘤復發時間和預后情況。 經Sperman 分析,IDH-1 相對其他免疫組化條件,能更好地反映腦膠質瘤病理級別的變化,與腫瘤級別呈負相關。 在腫瘤細胞的三羧酸循壞的當中,突變型的IDH 可能有著相對更低的酶活性,因此不利于腫瘤細胞的發展,有利于腫瘤分級的降低。 同時Ki-67與P53 也呈一定的相關性。 在乳腺癌病例中,周興等[3]也曾報道過Ki-67 與P53 呈正相關的關系。在Nuran Süngü 等[4]的研究中Ki-67 和P53 在基底細胞癌上標記物染色率呈線性相關(r= 0.420,P=0.015)。 這當中極有可能是由于Ki-67 是一個顯示增殖的標志物,而P53 與侵襲性進展相關,因此當中這兩者同時反映了腫瘤的侵襲性進展,因此可能存在一定的相關性。 而在該文中,Ki-67 與P53 具有相關性(r=0.348,P<0.05),且也呈正相關,但在該文中發現相關系數r=0.348,低于上述研究中的r=0.420,分析可能與地域有關。
復發時間≤12 個月的一共有51例,占比為66.2%;>12 個月一共有26例,占比大約為33.8%,相關影響因素分別為年齡,病理級別,IDH-1,在Sperman 分析中均有相關性[5]。
年齡是腫瘤復發的相關因素之一,通過Sperman單因素相關性分析,年齡>65 歲是腦膠質瘤的不良預后因素之一,這與王海靜等[6]所報道的高級別膠質瘤年齡>65 歲是不良預后因素相符合;與潘鋒等[7]所報道的>60 歲的老年組預后最差相類似。 Xiong L 等[8]認為這與老年患者的代謝和免疫功能降低,并且他們對手術,術后放療和化療的耐受性降低有關,因此導致了老年人腦膠質瘤預后不良,復發時間更短的情況。
復發時間與腦膠質瘤分級呈現負相關趨勢,Ⅲ級腦膠質瘤復發時間相對于Ⅳ級腦膠質瘤在統計學上有明顯減少,符合其他學者的報道[9],這體現復發時間與腫瘤的浸潤程度有關,腫瘤的浸潤程度影響著腫瘤切除術以及腫瘤的放療的效果。
IDH 是TCA 循環中細胞呼吸的必需酶,IDH 突變主要導致精氨酸132 處的組氨酸取代,首次在神經膠質瘤中發現[10]。IDH1 或IDH2 的反復突變在幾種癌癥中普遍存在,包括神經膠質瘤、急性髓細胞白血病(AML)、膽管癌和軟骨肉瘤。 分析Sperman 統計結果時,發現IDH-1 的陽性率與復發時間顯著相關(r=0.685,P<0.001)。 同時χ2檢驗也顯示IDH-1 在復發時間中,陽性組(野生型腦膠質瘤)和陰性組(突變型腦膠質瘤)明顯的有統計學差異。 張維波等[11]研究顯示,這當中的原因可能為神經膠質瘤細胞可以刪除或擴增突變型或野生型等位基因,從而改變野生型和突變型IDH1 的平衡比例,并導致2HG 的產生被破壞或廢除,從而增加2HG 的下游效應或抑制異檸檬酸代謝,導致有利于細胞癌癥機制的細胞代謝變化[12-13]。 Silvia Raineri 等[14]則表示IDH1/2 突變被認為會導致組蛋白和脫氧核糖核酸的高度甲基化,進而改變基因表達并推動癌癥的發展。 另有研究顯示,腫瘤分子標志物IDH1 的突變狀態(χ2=33.790, P<0.05) 也與高分級腦膠質瘤患者術后復發有關[15-21]。 該文分析結果可得出,IDH1 是否為陽性與復發時間的長短呈明顯正相關,因此IDH1 可被視為影響腦膠質瘤患者預后情況的獨立影響因素,從而為腦膠質瘤患者術中的方案制訂和術后放療的規劃提供參考依據。
綜上所述,額枕葉是腦膠質瘤的高發部位,IDH-1 是衡量腦膠質瘤的重要指標,與病理級別和復發時間都有明顯的相關性,對腫瘤預后情況的預估有著重要的作用,同時,Ki-67 與P53 也有著明顯的相關性,IDH-1,病理分級以及年齡是復發時間的影響因素,可以通過這些因素來進一步預計患者預后情況和復發時間,從而為術后放療的靶區勾畫提供一定的參考依據。

