基于肝臟時鐘基因bmal1、clock和per2探討清達顆粒降壓的作用機制
褚劍鋒,王天一,魯竹青,王乙連,盧 妍,彭美中,彭 軍,陳可冀
《內經》記載:“闕,在下者肝也”“肝大則逼胃迫咽,迫咽則苦膈中,且脅下痛”。“闕”指胸廓,“在下”指季肋部,可見,古人已確定肝的位置位于季肋,與胃、食管、膈相鄰,現代解剖學與此論述[1]基本一致。中醫學認為“肝者,體陰而用陽也,二者一血一氣,一陰一陽,互根互用”。“肝主藏血”為陰,“肝主疏泄”為陽,若肝失疏泄則人體氣機失調,導致肝氣郁結,甚者肝氣上逆,化火傷陰,臟腑陰陽失衡,肝陽上亢而出現煩躁易怒、血壓升高等癥狀或體征[2-3]。此理論為從肝論治高血壓提供了理論前提,也為平肝潛陽法治療高血壓奠定了論治基礎。清達顆粒是由陳可冀院士防治高血壓專方清眩降壓湯化裁而來,全方由天麻、鉤藤、黃芩、蓮子心四味藥物組成,共奏清肝熱、平肝陽、瀉心火之功,對高血壓病人降壓效果顯著[4]。本研究采用自發性高血壓大鼠(spontaneously hypertensive rats,SHR)模型,觀察清達顆粒對血壓、心臟功能、血管病理形態及肝臟晝夜節律基因的影響,為探討清達顆粒的作用機制提供部分生物學基礎。
1 材料與方法
1.1 實驗動物與分組 Wistar Kyoto(WKY)大鼠8只,SHR 16只,均為雄性,無特定病原體(SPF)級,4周齡,體質量(200±20)g,北京維通利華實驗動物技術有限公司提供[實驗動物許可證號:SCXK(京)2019-0009],由福建中醫藥大學實驗動物中心代購并飼養[SYXK(閩)2009-0001]。將16只SHR隨機分為模型組(SHR組)和清達顆粒組(SHR+QDG組),各8只;8只同周齡Wistar Kyoto大鼠作為空白組(WKY組)。分籠飼養,光照/黑夜各12 h,恒溫、恒濕,自由進食、飲水。實驗過程均嚴格按照國際動物保護及使用指南進行。
1.2 主要試劑與儀器 蘇木精染色液(北京索萊寶科技有限公司);伊紅染色液(北京索萊寶科技有限公司);Masson三色染色試劑盒(北京索萊寶科技有限公司);異氟烷(深圳瑞沃德生命科技有限公司);clock抗體(SAB,33580);per2抗體(ABclonal,A13168);bmal1抗體(Abbkine,ABP53154);即用型免疫組化試劑盒(兔)(福州邁新生物技術開發有限公司);二氨基聯苯胺法(DAB)顯色試劑盒(×20)(福州邁新生物技術開發有限公司);CODA無創鼠尾血壓系統(美國 Kent Scientific公司);DM400B顯微鏡(德國萊卡儀器有限公司);生物自動脫水機(湖北孝感亞光醫用電子技術有限公司);生物組織石蠟包埋機(湖北孝感亞光醫用電子技術有限公司);全自動石蠟切片機(德國徠卡儀器有限公司);小動物超聲影像系統(加拿大VisualSonics公司);Vevo LAB軟件(富士 VisualSonics公司)。
1.3 清達顆粒藥液制備 清達顆粒由江陰天江藥業有限公司提供。按照臨床給藥量換算,取清達顆粒(每袋5 g),按0.9 g/(kg·d)加入一定比例生理鹽水攪拌震蕩至完全溶解。
1.4 干預方法 大鼠在適應性飼養1周后,SHR+QDG組給予清達顆粒0.9 g/(kg·d)灌胃,SHR組和WKY組均給予等體積生理鹽水灌胃。每日1次,3組均連續給藥10周。每周采用鼠尾無創血壓儀器測量大鼠血壓,稱量體質量。
1.5 鼠尾無創血壓測量 首先安裝CODA無創鼠尾血壓系統,打開電源開關、加熱板、電腦Coda軟件、連接傳感器裝置等。根據室溫選擇合適的加熱檔及加熱時間,將大鼠固定器置于加熱板上進行預熱,按每組每輪8只大鼠誘導其鉆進固定器,并將合適的尾袖套在大鼠尾巴根部,讓大鼠穩定5 min,設置電腦的CODA軟件,每只大鼠預測試5次,正式測定10次,循環3次,測量開始并記錄合格的血壓數據。
1.6 心臟超聲與脈沖波檢查 實驗結束時,大鼠在異氟烷吸入麻醉下,將小動物超聲探頭MS250置于胸骨左緣,對大鼠進行超聲心動圖與脈沖波檢查,通過M型心動圖測量大鼠形態學和功能參數,包括室間隔厚度(IVS)、左室后壁厚度(LVPW)、左室收縮末期容積(LVESV)、左室舒張末期容積(LVEDV)、左室收縮末期內徑(LVESD)、左室舒張末期內徑(LVEDD)、左室射血分數(LVEF)和左室短軸縮短率(LVFS)。LVEF和LVFS通過Vevo LAB軟件計算得出:LVEF(%)=[(LVEDV-LVESV)/LVEDV]×100%,LVFS(%)=[(LVEDD-LVESD)/LVEDD]×100%。所有超聲心動圖參數取連續3個心動周期平均值。
1.7 取材及實驗指標檢測 干預10周后,大鼠采用異氟烷麻醉并處死,收集腹主動脈血樣,分離血清,將其保存在-80 ℃下進行后續實驗。取出心臟,冰上剔除大血管與結締組織,剝離腹主動脈并分離為3部分,將肝臟左外葉的左側和右側兩部分及腹主動脈的其中兩部分置于-80 ℃保存用于分析,其余部分固定在4%多聚甲醛中,用于蘇木精-伊紅(HE)染色和Masson染色。
1.8 肝臟轉錄組測序 使用Illumina公司的NEBNext Ultra RNA Library Prep Kit構建測序庫。用RNase抑制劑和ProtoScript Ⅱ Reverse合成互補DNA(cDNA)第一鏈。樣品在PTC-225 Peltier熱循環器中培養,在25 ℃下10 min,在42 ℃下15 min,在70 ℃下15 min,在4 ℃下保持。第二鏈的cDNA合成使用第二鏈合成反應緩沖液和第二鏈合成酶混合,并在PTC-225 Peltier熱循環器中16 ℃孵育1 h。之后使用1.8X agcourt AMPure XP Beads對雙鏈DNA進行純化,最后制備cDNA文庫。進行PCR擴增。采用QUBIT DNA HS Assay Kit對聚合酶鏈式反應產物進行準確定量。采用2100生物分析儀芯片對文庫質量進行評價。轉錄組文庫在Illumina測序平臺上測序。利用FastQC軟件對測序5′-3′的堿基質量進行分析,并對測序數據中的堿基含量進行測量。對原始測序結果進行過濾,得到適合下游數據分析的高質量序列。
1.9 實時熒光定量聚合酶鏈式反應(RT-qPCR) 采用RT-qPCR檢測肝臟組織bmal1、clock和per2 mRNA表達水平。使用Trizol試劑對肝臟組織進行裂解,提取肝臟組織RNA,采用NanoDrop 2000分光光度計測量260 nm和280 nm處的吸光度比,定量測定提取的RNA。采用PrimeScript RT reagent Kit 合成cDNA,并使用SYBR Green qPCR Master Mix進行qPCR。目的基因mRNA相對表達量歸一化至管家基因(GAPDH),并采用比較Ct法和公式2-△△CT進行定量。引物序列如下:GAPDH正向引物序列5′-3′TATGTCGTGGAGTCTACTGGCG,反向引物序列5′-3′ATGAGCCCTTCCACGATGC;bmal1正向引物序列5′-3′CACAGGATAAGAGGGTCATCAC,反向引物序列5′-3′CGGAAGGAATGTCTGGAGTC;per2正向引物序列5′-3′GCAACGGGGAGTACATCACA,反向引物序列5′-3′GTGCGGAGTCTTCTCCTCTG;clock正向引物序列5′-3′CACTCAGGACAGACAGATAAGGT,反向引物序列5′-3′GCTGCTGTTGCTGTGTTACT。
1.10 免疫組織化學法 將新鮮大鼠部分肝臟組織置于4%多聚甲醛固定24 h,之后采用75%乙醇室溫下浸泡。常規脫水、包埋,制作石蠟切片,脫蠟入水后,以檸檬酸法進行抗原修復,按照免疫組化試劑盒步驟進行下一步操作,阻斷內源性過氧化物酶封閉10 min,配制bmal1、clock和per2一抗(bmal1為1∶100;clock為1∶200;per2為1∶100),4 ℃低溫過夜孵育,次日孵育酶標聚合抗兔IgG二抗,鏈霉菌抗生物素蛋白孵育1 h,過氧化物酶孵育1 h,DAB染色,蘇木精復染色,最后晾干封片。所有切片采用光學顯微鏡進行放大400倍檢查,每個切片隨機選取6張圖分析clock、bmal1、per2蛋白的表達情況。利用顯微鏡圖像分析軟件Motic MED 6.0圖像分析軟件計算陽性表達率。
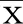
2 結 果
2.1 清達顆粒對SHR血壓及體質量的影響 第0周起(除第1周外),SHR組與WKY組收縮壓、舒張壓及平均動脈壓比較,差異均有統計學意義(P<0.05),提示高血壓模型可靠。清達顆粒灌胃第2周起,與SHR組比較,SHR+QDG組收縮壓、平均動脈壓上升幅度均受到抑制(P<0.05);給藥3周后,與SHR組比較,SHR+QDG組舒張壓下降(P<0.05)。提示清達顆粒可明顯降低SHR血壓。詳見圖1。
SHR組與WKY組比較,*P<0.05;SHR+QDG組與SHR組比較,#P<0.05。圖1 清達顆粒對SHR血壓及體質量的影響(A為收縮壓;B為舒張壓;C為平均動脈壓;D為體質量。1 mmHg=0.133 kPa)
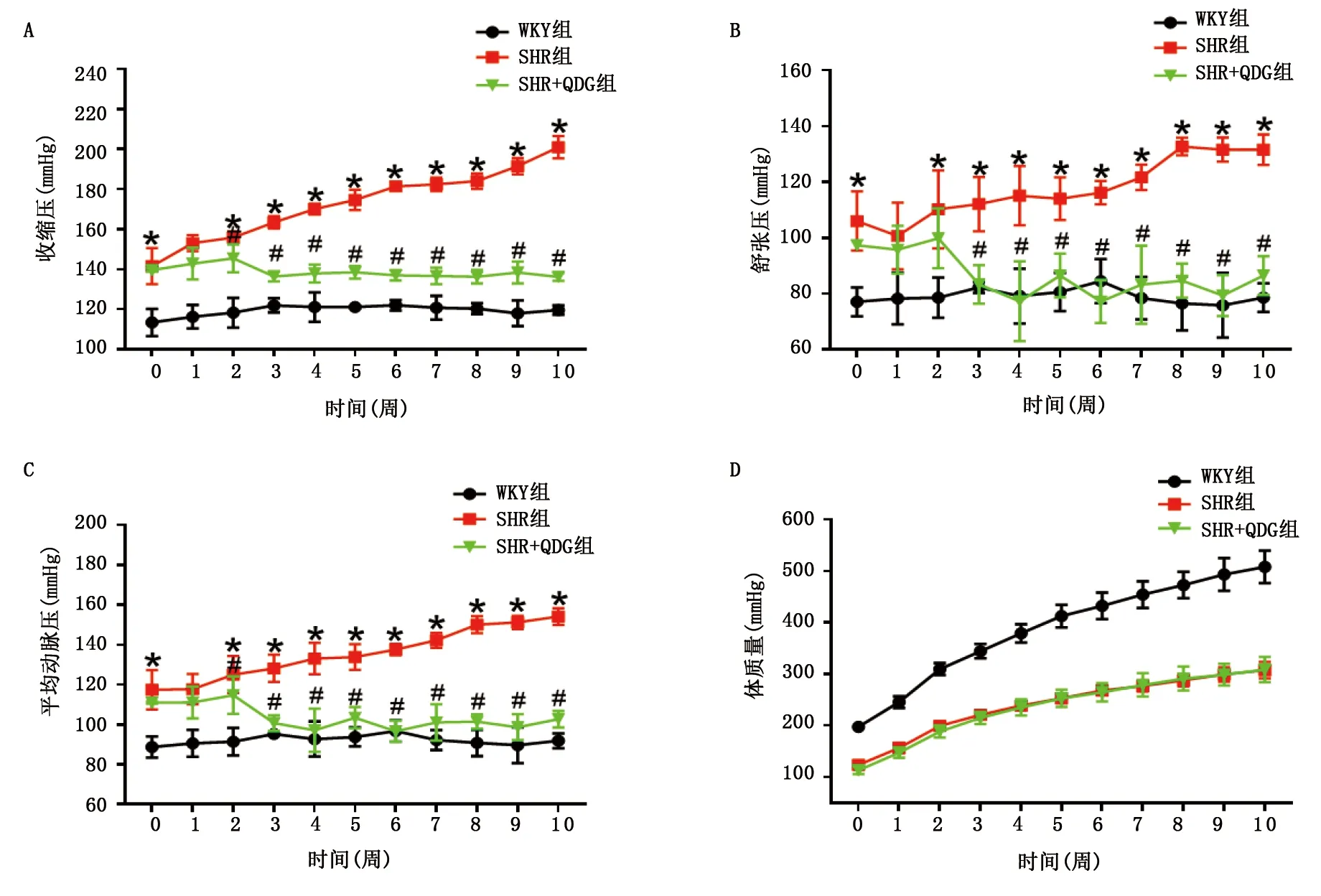
2.2 清達顆粒對SHR超聲心動圖指標和腹主動脈脈沖波傳導速度的影響 給藥第10周結束,通過小動物超聲對大鼠進行超聲心動圖及腹主動脈脈沖波檢查,結果顯示:與WKY組比較,SHR組大鼠LVEF和LVFS降低(P<0.05),腹主動脈脈沖波傳導速度升高(P<0.05);與SHR組比較,SHR+QDG組大鼠LVEF、LVFS升高和腹主動脈脈沖波傳導速度降低(P<0.05)。提示清達顆粒可改善SHR心臟和腹主動脈功能。詳見圖2。
SHR組與WKY組比較,*P<0.05;SHR+QDG組與SHR組比較,#P<0.05。圖2 清達顆粒對SHR超聲心動圖、腹主動脈脈沖波傳導速度的影響(A為各組超聲心動圖圖像;B為LVEF;C為LVFS;D為腹主動脈脈沖波傳導速度)
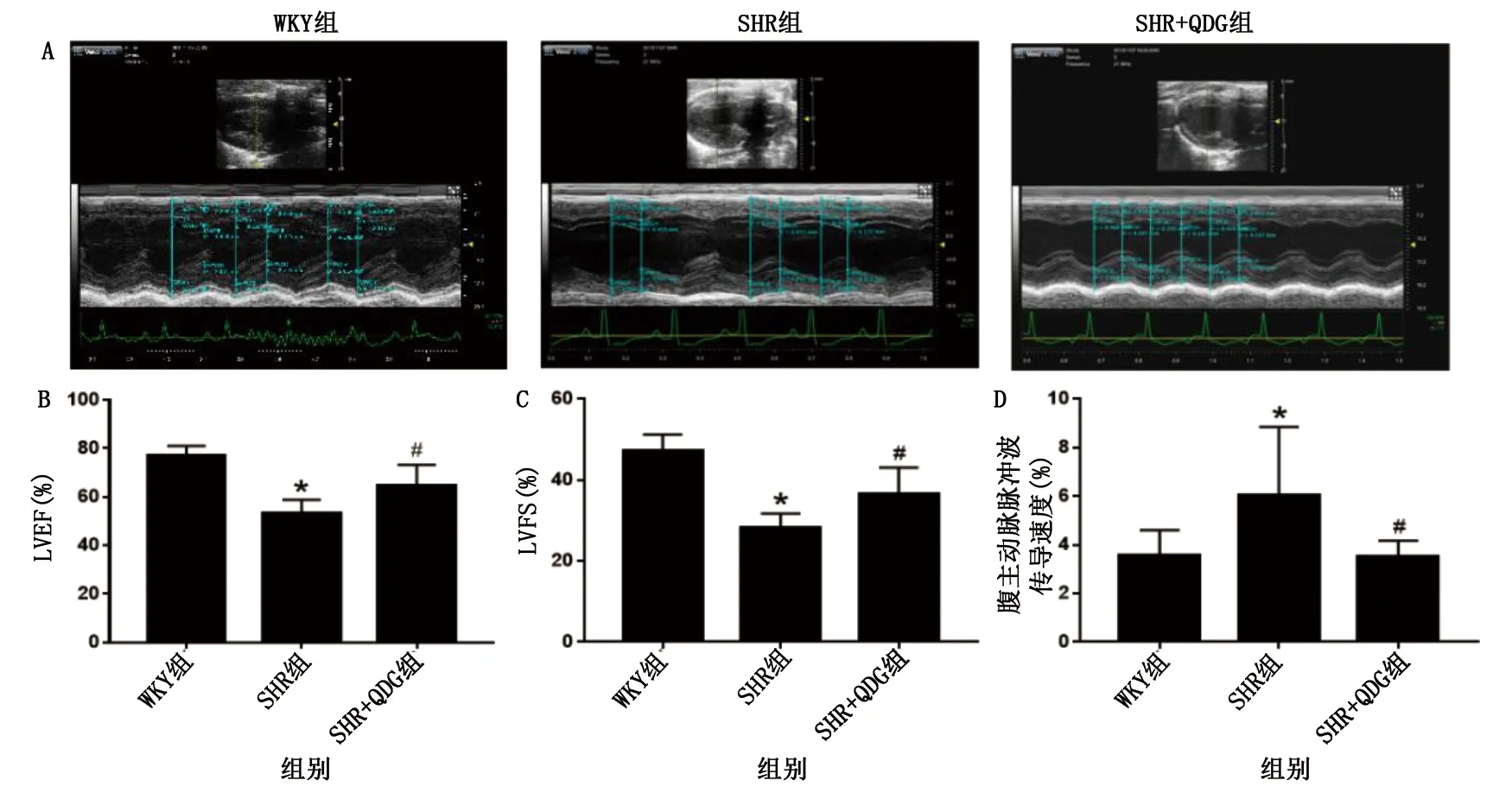
2.3 清達顆粒對SHR腹主動脈病理形態及血管纖維化的影響 HE染色觀察顯示:與WKY組比較,SHR組腹主動脈內膜明顯增厚,內膜結構紊亂,內皮細胞排列不完整;與SHR組比較,SHR+QDG組腹主動脈內膜結構、厚度均有所改善。提示清達顆粒可減輕SHR腹主動脈病理改變。Masson染色觀察顯示:與WKY組比較,SHR組腹主動脈壁膠原纖維增多;與SHR組比較,SHR+QDG組腹主動脈壁纖維化程度減輕。提示清達顆粒可明顯減輕SHR腹主動脈血管纖維化。詳見圖3。
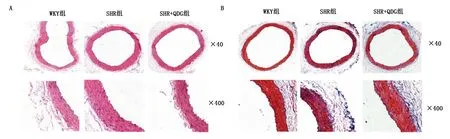
圖3 清達顆粒對SHR腹主動脈血管病理形態及血管纖維化的影響(A為HE染色圖;B為Masson染色圖)
2.4 清達顆粒對SHR肝臟組織病理形態的影響 WKY組肝小葉結構完整,肝細胞排列成條索狀,以中央靜脈為中心向四周放射狀排列,肝細胞輪廓清晰,未見脂肪變性和炎細胞分布;SHR組肝小葉結構被破壞,小葉間可見大量粗條狀結締組織增生,肝細胞腫脹壞死;SHR+QDG組肝臟病變明顯減輕。詳見圖4。
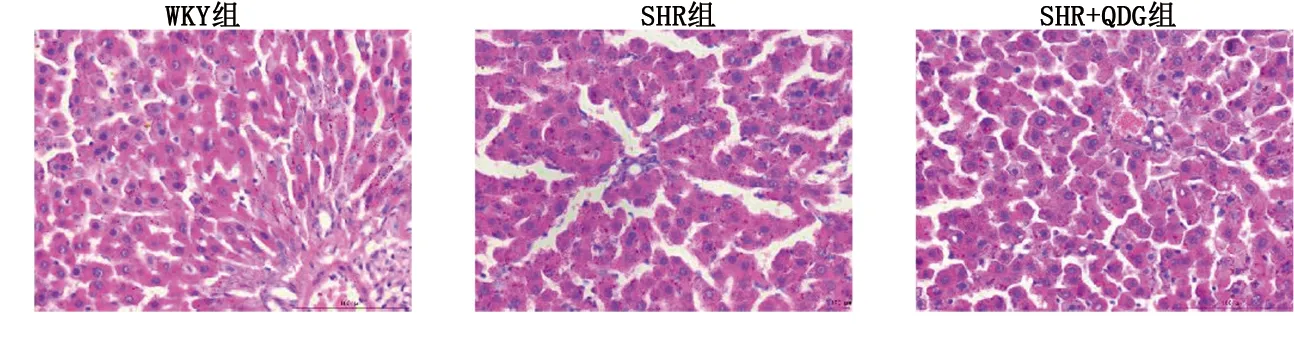
圖4 清達顆粒對SHR肝臟組織病理形態的影響(×400)
2.5 全基因組基因表達譜分析 通過轉錄組測序比較各組肝臟組織中差異表達基因分析(DEGs),并根據DEGs繪制聚類圖(見圖5A、5B)和火山圖(見圖5C、圖D),以便較好地顯示DEGs分布情況。結果顯示,與WKY組比較,SHR組中有936個DEGs顯著表達,其中512個基因顯著上調,424個基因顯著下調。與SHR組比較,SHR+QDG組中有365個DEGs顯著表達,其中155個基因顯著上調,210個基因顯著下調。SHR組有107個重疊基因表達上調,清達顆粒處理后表達下調(見圖5E)。SHR組有63個重疊基因下調,清達顆粒處理后上調(見圖5F)。SHR組上調和清達顆粒處理后下調前5個基因的信息見表1。SHR組下調基因和SHR+QDG組上調基因居前5位的信息見表2。

圖5 清達顆粒對SHR的DEGs影響(A為SHR組比WKY組聚類圖;B為SHR+QDG組比SHR組聚類圖;C為SHR組比WKY組火山圖;D為SHR+QDG組比SHR組火山圖;E、F為各組DEGs的交集)

表1 SHR組上調和SHR+QDG組下調的基因信息(居前5位)

表2 SHR組下調和SHR+QDG組上調的基因信息(居前5位)
2.6 基因本體(GO)、京都基因與基因組百科全書(KEGG)富集分析 GO功能富集分析主要從生物過程(BP)、細胞組成(CC)、分子功能(MF)等方面對生物靶標進行分析。圖6A和6B顯示豐富的GO項。對SHR組與WKY組和SHR+QDG組進行了交叉分析,得到了3 315種常見的生物過程(見圖6C)、321種常見的細胞成分(見圖6D)和555種常見的分子功能(見圖6E)。結果表明,富集基因主要表現在小分子代謝、多細胞生物發育、細胞對化學刺激、有機物質的反應、對脂質、激素、應激的反應等。同時進行了KEGG通路富集分析,進一步探討了QDG治療高血壓的病理機制,并鑒定了SHR組與WKY組和SHR+QDG組與SHR組功能相關的基因通路。圖7A和圖7B顯示KEGG富集顯著的前30個信號通路。其中,SHR組與WKY組和SHR+QDG組與SHR組有206條重疊信號通路(見圖7C)。其中Circadiam rhythm信號通路最豐富。
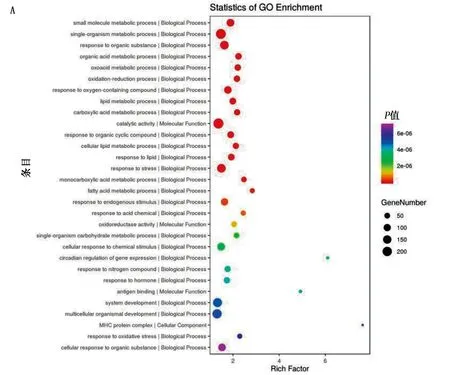
圖6 GO功能富集分析(A、B為GO富集分析;C為BP;D為CC;E為MF)
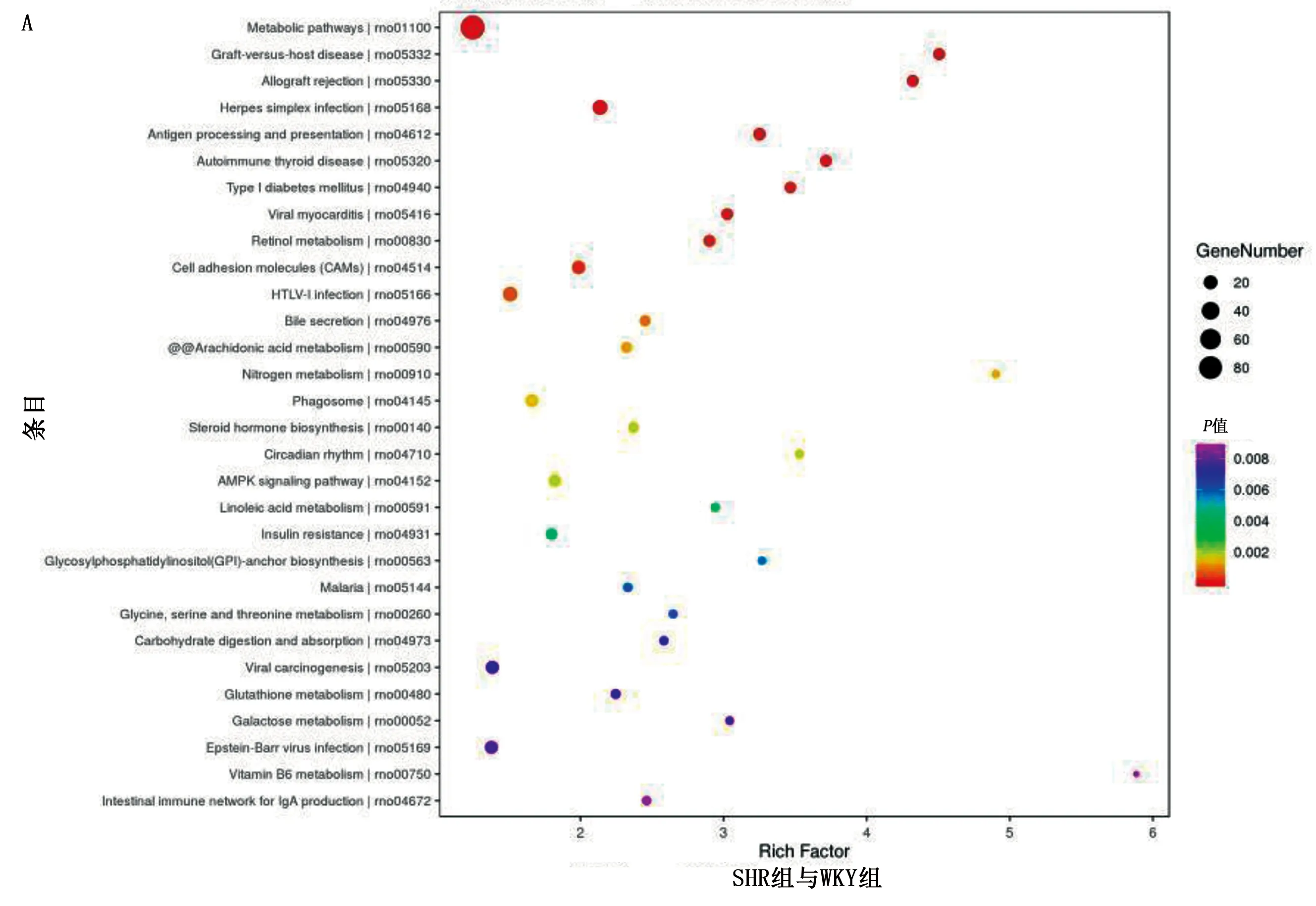
圖7 KEGG通路富集分析(A為SHR組和WKY組;B為SHR+QDG組與SHR組;C為重疊信號通路)
2.7 RT-qPCR RT-qPCR結果顯示,與WKY組比較,SHR組肝臟組織bmal1 mRNA表達上調(P<0.05);與SHR組比較,SHR+QDG組抑制了這種上調(P<0.05)。各組間clock mRNA表達比較,差異無統計學意義(P>0.05)。與WKY組比較,SHR組肝臟組織per2 mRNA表達明顯下調(P<0.05);與SHR組比較,SHR+QDG組QDG處理抑制了這種下調(P<0.05)。詳見圖8。
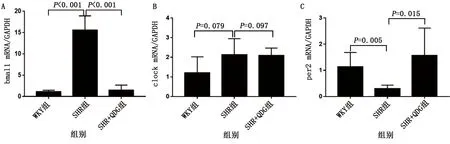
圖8 qPCR檢測肝臟組織bmal1、clock和per2的mRNA表達(A為bmal1 mRNA;B為clock mRNA;C為per2 mRNA)
2.8 免疫組織化學法 免疫組織化學法檢測肝臟組織bmal1、clock和per2蛋白表達情況。與WKY組比較,SHR組bmal1和clock蛋白表達比較,差異無統計學意義(P>0.05);與SHR組比較,SHR+QDG組bmal1和clock蛋白表達比較,差異無統計學意義(P>0.05)。與WKY組比較,SHR組per2蛋白表達下調(P<0.05);與SHR組比較,SHR+QDG組per2蛋白表達上調(P<0.05)。詳見圖9。
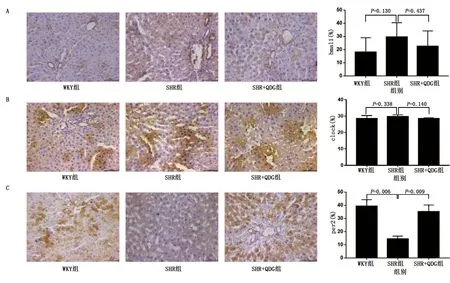
圖9 免疫組化檢測各組大鼠肝臟組織bmal1、clock和per2蛋白表達(×400)(A為bmal1;B為clock;C為per2)
3 討 論
《十四經發揮》記載:“肝之為臟,左三葉,右四葉,凡七葉,其治在左。其臟在右脅右腎之前,并胃著脊之第九椎”,并以《臟腑名堂圖》描述了肝臟在人體的具體位置,對肝的形態位置與毗鄰關系進行了記載,中醫學與現代解剖學的肝臟位置相同[5]。
“肝藏血,主疏泄”概括了中醫學中肝臟的功能,一方面,肝臟貯藏血液,調節全身血液流動;另一方面,肝臟調暢氣機,促進津血的運行和代謝,促進脾胃的運化及調節生殖機能等。中醫學認為導致高血壓的內因多為年老體虛、陰陽失衡、先天稟賦不足、后天失調,外因多為起居無常、飲食不節、情志刺激、勞逸失度[6]。這些病因從不同角度影響肝臟正常的生理功能,如長期的情志失調、抑郁惱怒,致使肝失疏泄,肝氣郁結,郁結日久而化火,導致肝陽上亢,形成本虛標實之證,出現血壓升高的臨床癥狀;飲食不節,嗜食肥甘厚味之物,導致脾胃運化失常,內生痰濕之邪,阻礙人體津血正常的運行和代謝,進一步擾亂肝氣運行,血壓升高同時多伴有頭重、昏蒙的臨床癥狀[7]。可見,“肝藏血主疏泄”的功能與高血壓發病密切相關。
現代醫學對高血壓的病因多歸于遺傳因素、飲食、吸煙、精神應激等環境因素,其中,精神應激、飲食與中醫學所言情志失調、飲食不節等不謀而合。現代社會生活節奏日益加快,人們承受的心理壓力日漸加大,隨之出現高血壓病人數量呈快速增多的趨勢[7],研究人員開始關注精神應激和高血壓發病之間的關系。有研究通過對老年原發性高血壓病人研究發現,高血壓發病與焦慮、抑郁、低社會支持及高應激狀態等不良情緒存在相關性[8]。寧亮等[9]認為心理情緒障礙是原發性高血壓發生的獨立危險因素之一,可增加高血壓相關心腦血管事件發生率。從肝藏血、主疏泄、調暢情志的功能出發,采用清肝熱、平肝陽、恢復肝臟正常生理功能的中藥成方是治療高血壓病的公認思路。
清達顆粒是在清眩降壓湯基礎上的簡化配方,由天麻、鉤藤、黃芩、蓮子心4味中藥組成,全方共奏清肝熱、平肝陽之效。相關研究表明,清達顆粒通過促進血管舒張降低SHR血壓,還可抑制核轉錄因子-κB通路,從而減輕心臟重構和炎癥[10-11]。本研究采用SHR模型,發現清達顆粒可降低SHR血壓,改善心臟收縮功能,減輕動脈血管重構同時調控SHR肝臟晝夜節律基因的表達。
根據肝臟轉錄組測序分析結果發現,SHR組與WKY組和SHR+QDG組與SHR相比,GO功能分析表明富集基因主要表現在小分子代謝、多細胞生物發育、細胞對化學刺激、有機物質的反應、對脂質、激素、應激的反應等方面。KEGG通路富集分析,發現Circadiam rhythm信號通路最為豐富。生物過程和功能,如血壓的調控等呈時間節律性,是由下丘腦視交叉上核(SCN)中的遺傳主時鐘控制的,時鐘基因per1、per2、per3、bmal1、clock及cry及其基因產物的節律性活動構成了中樞節律維持機制[12]。有研究顯示,對生物鐘成分的遺傳操作,如clock和bmal1,人類生物鐘基因per3的串聯重復變異及內皮細胞或血管平滑肌細胞內生物鐘的遺傳消融,顯著減弱甚至消除了心律或血壓的晝夜節律,影響機體自身晝夜節律的穩定[13-15]。可見,晝夜節律與高血壓呈一定的相關性,調控肝臟晝夜節律基因的表達可調控血壓。本研究結果顯示,清達顆粒降低血壓同時可調控肝臟組織bmal1和per2 mRNA表達,二者的作用機制需進一步探討。
綜上所述,清達顆粒能降低血壓,改善心臟收縮功能,減輕動脈血管重構,調控肝臟晝夜節律基因的表達。清達顆粒降血壓的機制可能與清肝熱、平肝陽,使肝主疏泄的功能恢復正常,調控肝臟晝夜節律基因表達有關,肝臟晝夜節律基因表達的改變可能是清達顆粒的藥效機制或相關成分的靶點,為從肝論治高血壓奠定了部分生物學基礎。

