夏季達里諾爾湖浮游細菌群落表、底層結構特征及其關鍵驅動因子
杜蕾, 李暢游, 李文寶, 史小紅, 楊旭, 劉晶晶
夏季達里諾爾湖浮游細菌群落表、底層結構特征及其關鍵驅動因子
杜蕾, 李暢游*, 李文寶, 史小紅, 楊旭, 劉晶晶
內蒙古農業大學水資源保護與利用自治區重點實驗室, 呼和浩特 010018
浮游細菌是湖泊水體物質循環和能量流動過程中的關鍵要素, 影響著整個生態系統的遷移轉化。為探索中國北方典型內陸封閉型湖泊浮游細菌群落結構對環境因子變動的響應, 以夏季內蒙古達里諾爾湖(以下簡稱“達里湖”)為例, 采集表、底層水共32個樣品, 基于16S rRNA基因測序, 詳細分析了浮游細菌群落結構的表、底層變化特征及其主要影響因素, 結果顯示: (1)夏季達里湖水體中浮游細菌群落多樣性和均勻度均呈現表層>底層, 豐富度則呈底層>表層。(2)浮游細菌群落以變形菌門(Proteobacteria)、放線菌門(Actinobacteria)、藍細菌門(Cyanobacteria)和擬桿菌門(Bacteroidetes)四大優勢菌門為主要組成部分, 且變形菌門含量在表、底層水體中均占絕對優勢: 在底層水中占比46.46 %, 在表層水中占比36.21 %。(3)基于不同環境因子和浮游細菌優勢菌門間的Pearson相關性分析, 表層水體中總溶解性固體(TDS)、溶解態無機磷(DIP)是多數優勢菌門的主要驅動因子, 而底層水體中的總氮(TN)、葉綠素a(Chl)和水溫(WT)為主要驅動因子。總的來說, 達里諾爾湖表、底層浮游細菌群落結構與不同環境因子間存在顯著相關, 而水體環境因子的表、底層差異是影響多數優勢菌門演化的重要因素。
浮游細菌; 表、底層變化; 夏季; 群落結構; 達里諾爾湖
0 前言
湖泊在區域生態系統中起著至關重要的作用, 而湖泊水體中的微生物則是這一生態系統中的關鍵組成部分[1-2]。浮游細菌作為主要分解者[3-4], 參與了湖泊水體中的各種物質循環和能量流動過程[5-8]。此外, 水體中的浮游細菌群落結構變化與其水質也有著密切的聯系, 且對水體環境變化響應快速: 不同形態營養元素的輸入、水體環境因子的變化都會導致細菌群落結構的改變[9-10]。因此, 分析水體浮游細菌群落結構及優勢菌門含量變化可以很好地反映湖泊的水環境質量狀況[11-14]。
目前, 關于湖泊水體生態系統中浮游細菌菌群結構特征及其與環境因子之間關系的研究已經廣泛展開。如Garcia, De Figueiredo等通過研究季節變化對湖泊水體環境的影響, 進而討論了其中細菌群落結構的變化[1,8]; 在國內, 姜學霞、呂明姬、沈烽、楊長明等分別對河、湖水體及沉積物中的浮游細菌群落結構特征及影響因素進行了分析[14-17]。結果顯示不同環境因子, 如水體溫度(WT)、溶解氧含量(DO)、溶解性總固體含量(TDS)、營養元素(如總磷-TP、總氮-TN等)等, 對浮游細菌的群落結構影響明顯[17,18]。然而, 相對于這些研究區域, 中國內蒙古高原內陸封閉型湖泊不僅水文循環過程影響因素簡單[19], 而且氣候環境變化存在明顯的冬季冰封期(相對封閉環境)-夏季非冰封期(相對開放環境)交替的區域特點[20, 21]。因此, 在具有重要區域生態環境意義的內陸湖泊開展菌群結構變化研究, 既可以為深入探討區域生態環境演變提供理論基礎, 又可以為不同氣候條件下的湖泊水體生態系統演變對比提供基礎材料。
基于此, 本文將以內蒙古赤峰市克什克騰旗境內達里諾爾湖(簡稱“達里湖”)為研究區域, 通過對2018年夏季湖水進行垂向采樣, 分析不同空間部分環境因子參數(如WT、DO、TDS、水深、不同形態營養元素含量等)的變化特征; 同時, 利用16S rRNA基因測序對不同水深樣品中的浮游細菌群落結構進行測試, 分析浮游細菌群落結構組成及垂向變化特征; 進一步結合Pearson相關性分析方法研究浮游細菌優勢菌門和不同環境因子間的關系, 討論影響浮游細菌群落組成及演變的關鍵因素, 為進一步研究達里湖水環境變化、水生態演化過程提供理論基礎, 以期為達里諾爾湖水體環境保護提供一定參考。
1 研究區概況
達里湖(43o12′—43o24′ N, 116o24′—116o56′ E)位于內蒙古自治區赤峰市克什克騰旗境內, 為封閉式蘇達型半咸水湖, 屬高原內陸湖, 湖水無外瀉, 補給源為大氣降水, 河水(亮子河、沙里河、浩來河與貢格爾河)及地下水 (圖1), 其中亮子河與貢格爾河為主要補給河流, 達里湖年入湖水量存在差異, 主要由于年均降水量不同[19]。
達里湖水面面積平均約為189 km2, 年均面積變化在1—2 km2內[19]。湖泊的面積變化造成不同區域水深出現一定程度波動, 具體體現在從西南到東北逐漸變淺, 湖水最深處約13 m[21]。其中, 西南側水深變化明顯, 形成了顯著的水下陡坡。而其他區域湖岸均比較平緩, 湖水深度變化也較平緩[22, 23]。

注: (a) 取樣點分布示意圖。取樣點依具體位置由北到南依次編號。左上小圖代表內蒙古自治區的年均降水量區域變化特征; (b)達里湖水深變化概況示意圖, 修改自肖舉樂, 等[22, 23]. 圖中白色數值代表當時水深。由于近年達里湖水位變化, 具體湖水深度存在一定程度的波動。
Figure 1 Distribution of sampling points and water depth profile of Dali-nor Lake
2 材料與方法
2.1 樣品采集
根據達里湖的水面面積、水深以及入湖河口的位置, 本文采用GPS全球定位系統, 在達里湖內共布設17個取樣點(圖1), 于2018年7月進行了湖水樣品采集工作。樣品采集主要劃分為表層、底層2層, 其中DL-9水深較淺, 僅采集表層水樣, 由于實驗操作失誤丟失DL-5底層水樣, 共采集水樣32個。采集完成的水樣裝入經滅菌處理的1 L的聚乙烯取樣瓶中, 并立即密封避光保存在低溫保溫箱中盡快運回實驗室進行過濾處理, 其中500 mL用于環境因子的測定, 500 mL用于收集細菌, 首先水樣先經過5 μm孔徑濾膜過濾, 以去除顆粒雜質(濾膜可用以測試附著細菌)[24, 25], 然后在經過0.22 μm孔徑濾膜過濾[24, 25], 過濾完成后, 濾膜置于凍融管中保存在-20℃條件下, 用于后續實驗分析。
2.2 水體環境因子測定
利用YSI Pro多參數水質分析儀現場測定DO、WT、TDS、EC, 塞氏圓盤測定SD、測深鉛錘測定水深。同時, TN、TP、溶解態無機磷(DIP)、溶解態總磷(DTP)、葉綠素(Chl)等環境因子的測定則是在內蒙古農業大學水資源利用與保護自治區重點實驗室完成, 標準參照《水和廢水監測分析方法》(第四版)[26]。
2.3 DNA提取和高通量測序
按照FastDNA? Spin Kit for Soil試劑盒的具體實驗操作步驟方法, 提取湖水中微生物基因組DNA。隨后利用微量紫外分光光度計(NanoDrop-2000)測定提取出的DNA濃度和純度后, 選用通用引物515F(5`- GTGCCAGCMGCC-GCGGTAA-3`)和806R (5`-GGACTACVSGGG TATCTAAT-3`)[27]對V4-V5 可變區進行PCR 擴增。
擴增程序[28]為95℃預變性3 min, 27 個循環(95 ℃變性30 s, 55 ℃退火30 s, 72 ℃延伸30 s), 最后72 ℃延伸10 min (PCR 儀: ABI GeneAmp? 9700 型)。擴增體系為20 uL, 4 uL 5*FastPfu 緩沖液, 2 uL 2.5 mM dNTPs, 0.8 uL 引物(5 uM), 0.4 uL FastPfu 聚合酶; 10 ng DNA 模板。每個樣品3 個重復, 將不同樣品的PCR 擴增產物均一化至10 nmol·L-1后等體積混合, 利用上海美吉生物醫藥科技有限公司的MiSeq PE300測序儀完成序列測定。
2.4 數據分析
高通量測序所得數據保存在NCBI數據庫內, 其生物信息學分析采用 Qiime軟件進行, 根據序列的相似度, 將序列歸為多個OTU, OTU 產出后, 統計各個樣品中含有OTU的情況及每個OTU中所含序列的數目, 得到每個OTU 的分類學信息[29]。選取相似度在97%條件下的OTU生成預期的稀釋曲線, 并利用Mothur軟件計算豐富度指數Chao和Ace, 文庫覆蓋度, 均勻度指數Heip以及多樣性指數Simpson 和Shannon指數進行Alpha 多樣性分析[30]。利用非度量多維尺度分析(NMDS)方法, 對不同深度湖水中浮游細菌群落結構的垂向差異進行分析。利用Pearson相關分析進行了環境因子與優勢菌群間的相關性分析。
3 結果與分析
3.1 達里湖水體環境因子表、底層差異變化
為探究達里湖水體環境因子表、底層差異, 對各取樣點的理化指標計算均值, 并計算各指標表、底均值的變異系數。Chl的變化最大, 變異系數為10.889%; pH值的變化最小, 變異系數為0.007%。除Chl外, 各理化指標的變異系數均較小, 可見達里湖表、底層水體交換過程相對緩慢, 水體理化指標變化相對穩定[31]。
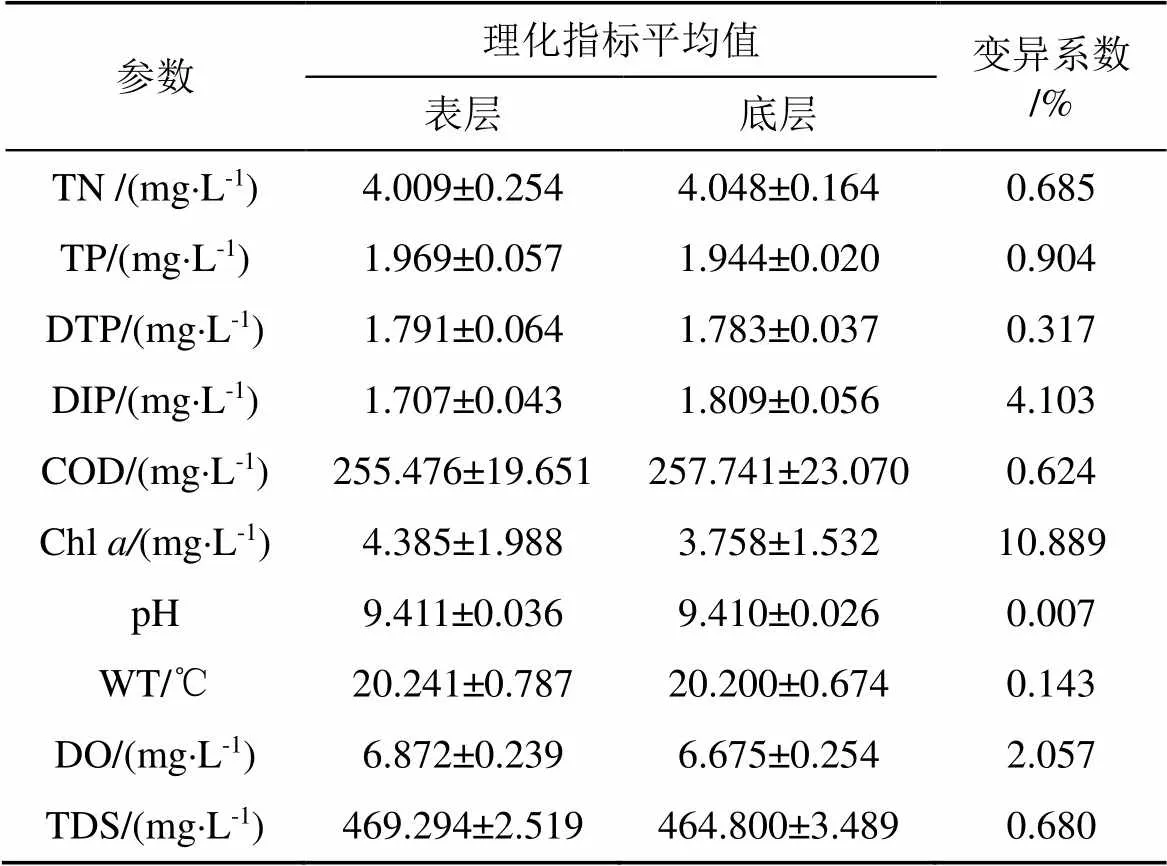
表1 表、底層水體環境因子的平均值及變異系數*
注: “*”平均值為每層水體所有取樣點的平均值, 黑體字代表平均值最高。
在夏季開放條件下的達里湖, 表層水更易受太陽輻射、大氣降水及河流輸入等外界因素的直接影響, 因此導致達里湖表層水的溫度、TDS值較高。夏季適宜的水體溫度導致藻類大量繁殖, 造成表層水體的Chl值高于底層, 而底層水體中TN、DIP、COD環境因子參數的平均值高于表層。
3.2 達里湖浮游細菌多樣性分析
表、底層水體樣品測序結果的文庫覆蓋率均高于99.7%(表2), 測序條數達到10000條以上時稀釋性曲線趨向平穩(圖2), 表明測序數據量合理, 能夠代表物種的豐富度。采用群落豐富度指數Chao和Ace、群落多樣性指數Shannon 和Simpson、均勻度指數Heip和文庫覆蓋率等對達里湖浮游細菌群落進行評估, 結果表明樣品具有豐富的群落組成, 其群落多樣性均較高(表2)。多樣性指數Shannon、Simpson、均勻度指數Heip均體現表層水體浮游細菌群落多樣性最高, 豐富度指數Chao 和Ace為底層水體最高, 文庫覆蓋率為表層高于底層。從標準差對比來看, 達里湖表、底層水體的浮游細菌群落豐富度較多樣性差異明顯。
3.3 浮游細菌群落結構組成的表、底層分布特征
為具體探究達里湖表、底層水體中浮游細菌群落結構的差異性特征, 采用非度量多維尺度分析(NMDS)方法, 繪制出樣點的二維分布圖(圖3), 其中不同樣點在二維圖中的距離可以反映群落結構的相似程度, 樣點之間的距離越近則表示群落組成結構越相似。
通過表、底層各個取樣點中細菌群落結構的分析, 可以發現表層水體各取樣點的NMDS1值主要分布在-0.4—0.2之間, NMDS2值主要分布在-0.2—0.45之間; 底層水各取樣點的NMDS1值主要分布在-0.4—0.3間, NMDS2值主要分布在-0.15—0.35間(圖3)。顯然, 夏季開放條件下達里湖水體浮游細菌菌群結構差異性程度呈現表層>底層的特征。
基于表、底層水體中浮游細菌群落結構的差異, 對表層和底層水中的浮游細菌在門類水平上的變化進行了統計, 具體分析了達里湖表、底層水體中浮游細菌群類結構特征及差異(圖4, 表3), 變形菌門(Proteobacteria)、放線菌門(Actinobacteria)、藍細菌門(Cyanobacteria) 3種浮游細菌菌門豐度在表、底層水體中均占優勢比例(表3), 其中, 變形菌門的標準差遠高于其他菌門: 變形菌門(Proteobacteria)的豐度最高, 在底層水(47.65%)中高于表層水(36.21%)中; 而放線菌門的豐度在底層水(24.89%)高于表層水(24.66%); 藍細菌門在表層水(11.22%)中高于底層水(8.99%)中。相對地, 擬桿菌門(Bacteroidetes)、軟壁菌門(Tenericutes)、異常球菌-棲熱菌門(Deinococcus-Thermus)、疣微菌門(Verrucomicrobia)、硬壁菌門 (Firmicutes)、浮霉狀菌門(Plancto-mycetes)、酸桿菌門(Acidobacteria)和綠菌門(Chlorobi)等8種門類浮游細菌同樣在表層、底層湖水中的比例存在差異(表3)。
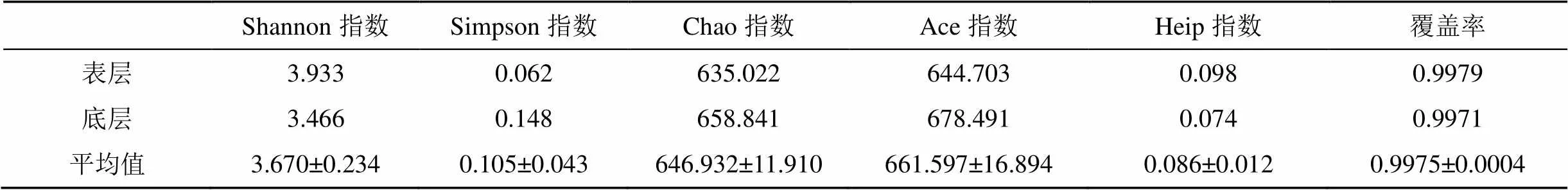
表2 浮游細菌表、底層分布多樣性分析
注: 黑體字代表平均值最高。
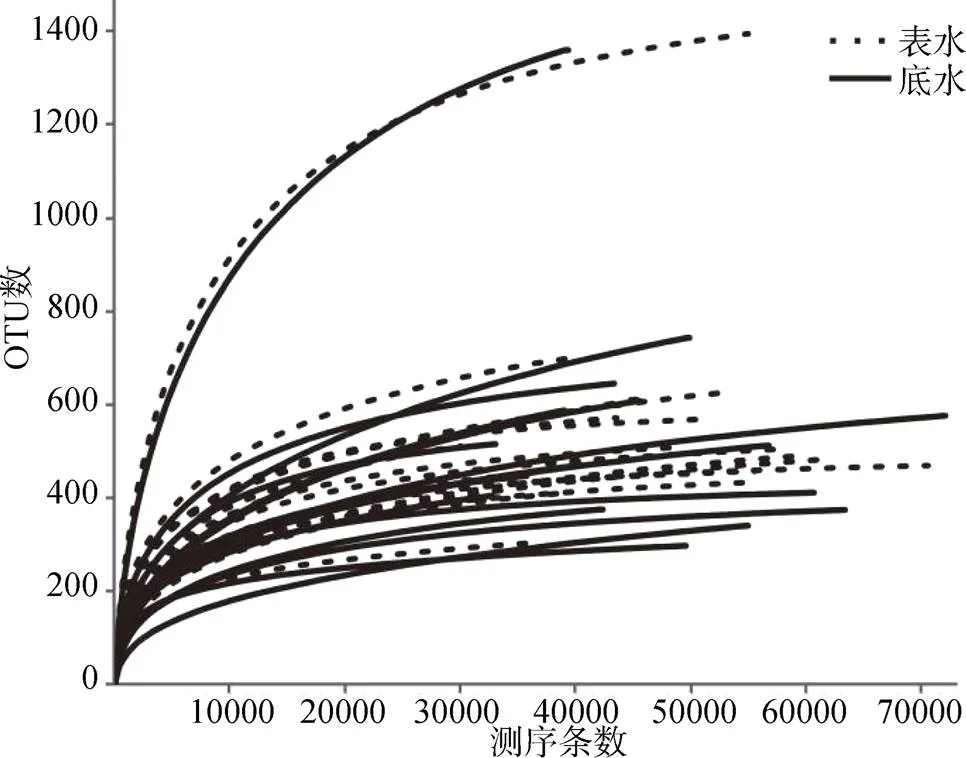
圖2 浮游細菌稀釋性曲線
Figure 2 Rarefaction curve of bacterioplankton community
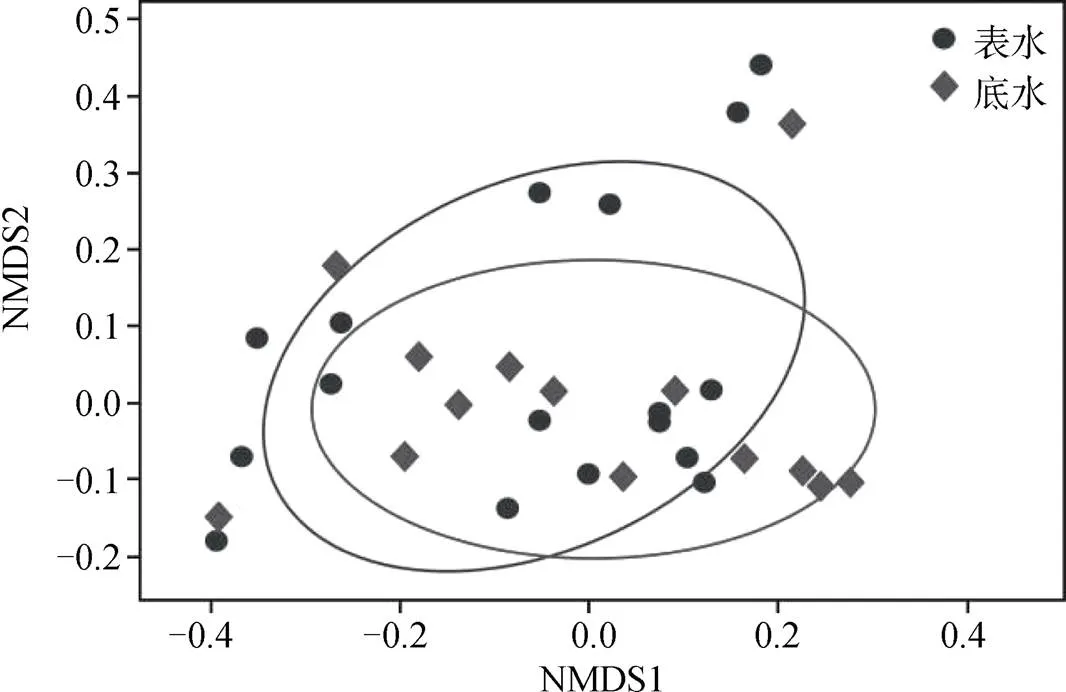
圖3 達里湖表、底層水體浮游細菌群落結構的NMDS分析
Figure 3 NMDS analysis of phytoplankton community structure in surface and bottom waters of Dali-nor Lake
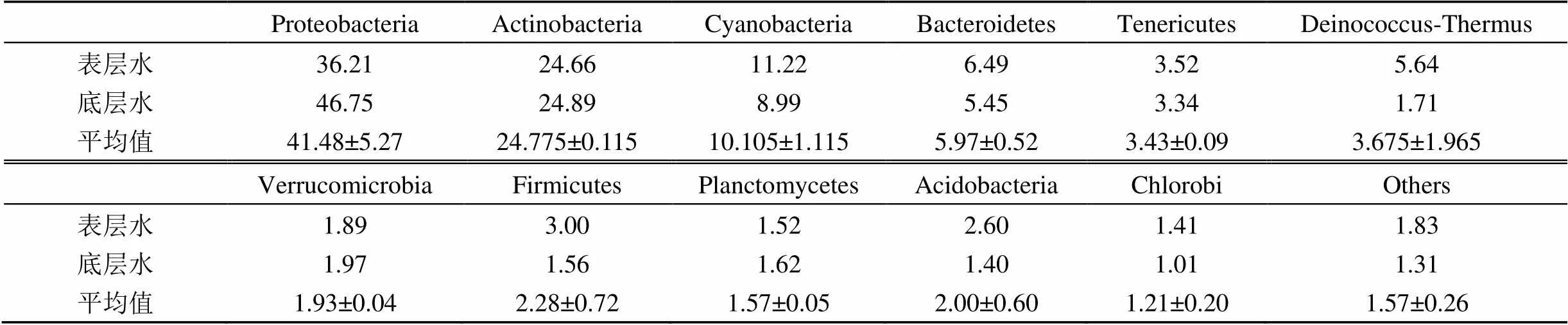
表3 表、底層湖水門類水平上浮游細菌群落結構比例(%)
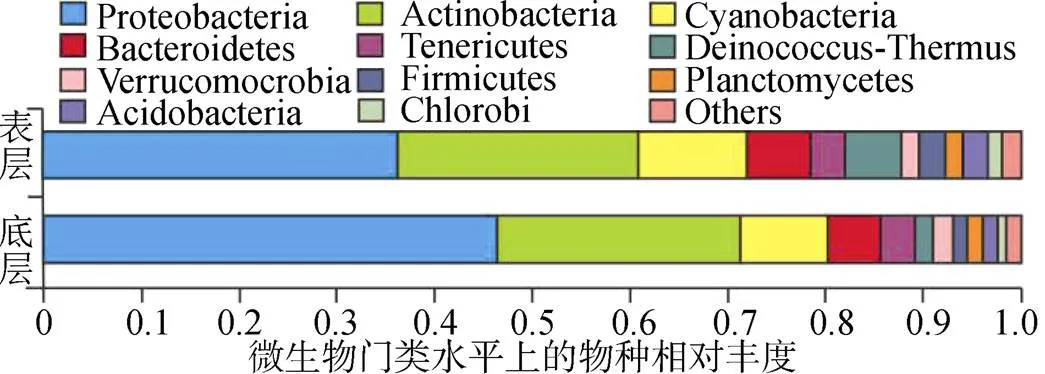
圖4 表、底層水體門類水平浮游細菌群落結構組成
Figure 4 Composition of phytoplankton community in surface and bottom water bodies on phylum level
3.4 環境因子與浮游細菌優勢菌門之間的關系
浮游細菌作為湖泊水體中主要的微生物種群, 其群落結構變化會對水體環境因子的垂向變化出現一定程度的響應。因此, 利用Pearson相關分析對達里湖表、底水體中門類水平上的浮游細菌物種豐富度和環境因子變化間的相互關系進行了詳細分析, 結果顯示表、底層水體中優勢細菌門類受不同環境因子的影響程度也不相同(圖5)。

注: 橫向坐標為水體環境因子, 縱向為物種信息, 中間不同顏色代表Pearson 相關分析的相關系數r值, r值范圍為-1—1. 當r值小于零, 則顯示兩者負相關, 當r值大于零, 則顯示兩者正相關. "*"代表顯著性檢驗P值<0.05有顯著性差異, "**"代表有極顯著差異。
Figure 5 Pearson analyzing result of planktonic bacterial flora and environmental factors in Dali-nor Lake
表層水體中, TDS、DIP作為與浮游細菌優勢菌門群落結構相關性最顯著的環境因子, 在和不同優勢門類浮游細菌間的相關性結果上也有體現。異常球菌-棲熱菌門(Deinococcus- Thermus)、硬壁菌門(Firmicutes)與TDS呈極顯著正相關, 而與DIP呈顯著負相關; 變形菌門(Proteobacteria)與這TN、SD、TDS 3個環境因子呈顯著負相關; pH與擬桿菌門(Bacteroidetes)、軟壁菌門(Tenericutes)呈顯著負相關; 綠菌門(Chlorobi)與DIP呈顯著負相關 (圖5a)。
底層水體中, 浮游細菌優勢菌門群落結構受TN、Chl和WT因子影響最顯著。TN與擬桿菌門(Bacteroidetes)、綠菌門(Chlorobi)、軟壁菌門(Tenericutes)呈顯著負相關; DIP與軟壁菌門(Tenericutes)呈顯著正相關; Chl與放線菌門(Actinobacteria)、擬桿菌門(Bacteroidetes)、綠菌門(Chlorobi)呈顯著正相關; WT與酸桿菌門(Acidobacteria)、異常球菌-棲熱菌門(Deinococcus- Thermus)和硬壁菌門(Firmicutes)呈顯著正相關; 水深與酸桿菌門(Acidobacteria)、異常球菌-棲熱菌門(Deinococcus-Thermus)呈顯著負相關(圖5b)。
4 討論
本文利用16S rRNA基因測序技術闡明了達里湖浮游細菌群落的空間變化, 多樣性指數表現為表層高, 底層低, 而豐富度指數為表層低, 底層高, 每個樣品在菌群組成上表、底層差異顯著, 這與其中變形菌門(Proteobacteria)、放線菌門(Actinobacteria)、藍細菌門(Cyanobacteria)是達里湖的主要菌門有關, 這一分布特征也和大部分的淡水湖泊浮游細菌的組成相似[32,33]。
在達里湖夏季水體中, Proteobacteria作為優勢菌中數量最高的菌門, 在達里湖表、底層水體中均占據明顯優勢, 其物種多樣性豐富, 生存方式多樣[34], 這也導致在表、底層湖水中Proteobacteria 豐度變化與湖水理化指標參數的相互關系復雜多變; 而相對豐度也相對較高的 Actinobacteria, 其豐度變化往往會受到水體富營養化等因素影響[35], 隨著水深的增加, Actinobacteria與營養元素的相關性產生差異; 其次是Cyanobacteria, 其生長方式為在表層湖水進行光合作用, 消耗表層水中的營養物質, 當營養物質被消耗盡時, 他們便會隨細胞體下沉到底層水體或沉積物中繼續吸收營養物質, 進而造成達里湖表層水體到底層水體與氮、磷營養鹽的相關關系發生改變。
達里湖屬典型內陸封閉型湖泊, 常年湖水無外泄, 在夏季湖泊水體處于開放條件下, 表層水體更易受太陽輻射、大氣降水及河流輸入等外界因素的直接影響, 因此導致達里湖表層水的溫度、TDS值較高, 并且由于夏季適宜的水體溫度導致藻類大量繁殖, 造成表層水體的Chl值也較底層偏高, 進而顯示出表層水體的理化性質主要受外界因素輸入的影響; 而底層水體中TN、DIP、COD等環境因子參數高于表層, 這是由于在湖泊底部, 底層水體與底泥接觸, 而底泥中的氮、磷等污染物釋放造成污染物濃度偏高。隨著環境因子在表、底層水體的變化, 其浮游細菌群落結構也相應發生改變。總的來說, 湖泊水體中微生物群落的結構特征與其環境理化性質緊密相關并相互限制影響[36]。本研究發現, 與達里湖浮游細菌呈顯著相關的環境因子分別為TN、DIP、Chl、PH、WT、SD、TDS、水深。TN、DIP及水深因子在表、底層均為主要環境因子。氮、磷元素循環是各種元素循環的中心, 微生物參與下的氮、磷循環是生態系統中的主要初級生產力, 在水生態環境中, 過量的氮、磷會導致水體發生富營養化。Haukka等[37]在對韋西湖微生物群落結構的分析中發現, 氮濃度與浮游細菌的組成直接相關, 其中Verrucomicrobia能夠對氮磷營養鹽進行有效的利用, 而Actinobacteria則適宜低濃度氮磷營養環境。在本研究中達里湖浮游細菌對氮磷營養鹽的響應并不明顯, 氮濃度與多數浮游細菌的關系為不顯著相關, 且DIP作為對達里湖部分浮游細菌有顯著影響的磷營養鹽, 對Chlorobi與Tenericutes有顯著促進作用, 對Deinococcus-Thermus、Firmicutes呈抑制作用; 李玉華等[38]在對松花湖水體的研究中得出水深為主要環境因子, 這與本研究中水深變化影響水體環境因子改變進而影響菌群結構產生差異的結果相同, 顯示了松花湖與達里湖浮游細菌菌群結構均受到水深變化的影響。夏季開放條件下, 達里湖表層懸浮大量藻類, 使得Chl含量偏高且與底層存在顯著差異, 從Pearson相關分析中Chl對多數優勢菌門的生長呈顯著促進作用, 除此之外, TDS也對表層的優勢菌門具有顯著影響, 這與王歡等對碧流河水庫的研究存在一定差異[39]。顯然, 湖泊水體微生物結構特征除受水體環境因子的調控外, 水域所處區域氣候條件及自身的區域特征也會對水體浮游細菌的菌群結構及優勢菌門的分布存在影響。
總之, 在開放條件下的達里湖, 表層和底層水體受外界環境變化影響的程度存在差異, 這進一步導致了水體中環境因子的含量出現波動, 最終引起浮游細菌群落結構及優勢菌門的豐度出現變化。
5 結論
1) 夏季開放條件下, 湖水中變形菌門(Proteo-bacteria)、放線菌門(Actinobacteria)、藍細菌門(Cyanobacteria)和擬桿菌門(Bacteroidetes)為優勢菌門, 且Proteobacteria含量在表、底層水體中中均占絕對優勢: 底層水占比46.46 %, 表層水中占比36.21 %。表、底層水體中優勢菌的占比存在一定差異, 這與水體環境差異有關。
2)表層水體中浮游細菌的群落多樣性、分布均勻程度最高。不過, 底層水體的整體細菌豐富度要高于表層水。
3) 水深變化引起的不同水體中環境因子含量的波動成為夏季達里湖浮游細菌菌群結構和優勢菌門豐度變化的關鍵因子, 即不同水深處浮游細菌群落結構及優勢菌門與不同水體環境因子間的相關性存在差異, 不同環境因子促進或抑制了相應優勢菌門的發育。其中, 表層水體中TDS、DIP對浮游細菌優勢菌門影響最顯著, 底層水體中TN、Chl和WT為主要影響因子。整體上, 水體環境因子的表、底層差異成為影響浮游細菌的優勢菌門群落結構的重要因素。
[1] Garcia S L, Salka I, Grossart H P, et al. Depth-discrete profiles of bacterial communities reveal pronounced spatio-temporal dynamics related to lake stratification[J]. Environmental Microbiology Reports, 2013, 5(4): 549–555.
[2] Li M, Wei G, Shi W,et al. Distinct distribution patterns of ammonia-oxidizing archaea and bacteria in sediment and water column of the Yellow River estuary[J]. Scientific Reports, 2018, 8(1): 1584.
[3] 陳禎, 何聃, 任麗娟. 溫度和營養鹽水平對淡水浮游細菌群落結構的潛在影響[J].南京大學學報(自然科學), 2016, 52(4): 590–600.
[4] Newton R J, Jones S E, Eiler A, et alA guide to the natural history of freshwater lake bacteria[J]. Microbiology and Molecular Biology Reviews, 2011, 75(1): 14–49.
[5] Hanson C A, Fuhrman J A, Horner-Devine M C, et al. Beyond biogeographic patterns: processes shaping the microbial landscape[J]. Nature Reviews Microbiology, 2012, 10(7): 497–506.
[6] 閆冰,李俊生,陸晴,等. 北京城市公園綠地土壤微生物群落碳源代謝活性特征[J].環境科學研究, 2019, 32(9): 1567–1574.
[7] Yuan G, He J, Min C, et al. Factors dominating bacterioplankton abundance and production in the Nordic seas and the Chukchi Sea in summer 2012[J]. Acta Oceanologica Sinica, 2017, 36: 153–162.
[8] De Figueiredo D R, Pereira M J, Correia A. Seasonal modulation of bacterioplankton community at a temperate eutrophic shallow lake[J]. World Journal of Microbiology Biotechnology, 2010, 26(6): 1067–1077.
[9] Chen K, Allen J, Lu J R. Community Structures of Phytoplankton with Emphasison Toxic Cyanobacteria in an Ohio Inland Lake during Bloom Season[J]. Journal of Water Resource and Protection, 2017, 9(11): 1–29.
[10] Hahn M W. The microbial diversity of inland waters[J]. Current Opinion in Biotechnology, 2006, 17(3): 256-261.
[11] Sims A, Zhang Y, Gajaraj S, et al. Toward the development of microbial indicators for wetland assessment[J]. Water Research, 2013, 47(5): 1711–1725.
[12] Jiang J G, Shen Y F. Development of the microbial communities in Lake Donghu in relation to water quality[J]. Environmental Monitoring and Assessment, 2007, 127(1-3): 227–236.
[13] 程豹, 望雪, 徐雅倩, 等. 瀾滄江流域浮游細菌群落結構特征及驅動因子分析[J]. 環境科學, 2018, 39(8): 3649–3659.
[14] 姜學霞, 朱木得, 陳雪曼, 等. 肇慶波海湖細菌群落多樣性研究[J]. 環境科學導刊, 2019, 38(5): 20–23.
[15] 呂明姬, 汪杰, 范錚, 黃藝. 滇池浮游細菌群落組成的空間分布特征及其與環境因子的關系[J]. 環境科學學報, 2011, 31(2): 299–306.
[16] 沈烽, 趙大勇, 黃睿, 等. 南京玄武湖浮游細菌群落結構的季節變化及其與環境因子的關系[J]. 湖泊科學, 2017, 29(3): 662–669.
[17] 楊長明, 吳亞瓊, 王育來, 等. 南淝河表層沉積物細菌群落結構特征及驅動因素[J]. 中國環境科學, 2018, 38(9): 3552–3561.
[18] 李文寶, 劉志嬌, 楊旭, 等. 內蒙古高原達里諾爾湖夏季水體穩定同位素變化特征[J]. 湖泊科學, 2019, 31(2): 539–550.
[19] 劉曉旭, 李暢游, 李文寶, 等. 冰封期達里諾爾湖同位素與營養鹽分布特征及關系的定量分析[J]. 湖泊科學, 2015, 27(6): 1159–1167.
[20] 李衛平. 高原典型湖泊營養元素地球化學循環與重金屬污染研究[D]. 呼和浩特: 內蒙古農業大學, 2012.
[21] 王旭陽. 基于3S技術的達里諾爾湖水深反演研究[D]. 呼和浩特: 內蒙古農業大學, 2017.
[22] 李文寶, 李暢游, 劉曉旭, 等. 達里諾爾湖水體穩定氫、氧同位素組成變化對結冰過程的響應[J]. 地球科學(中國地質大學學報), 2015, 40(12): 2081–2090.
[23] 范佳偉, 肖舉樂, 溫銳林, 等. 內蒙古達里湖全新世有機碳氮同位素記錄與環境演變[J]. 第四紀研究, 2015, 35(4): 856–870.
[24] Yang C Y, W Q, Simon P N, et al. Distinct Network Interactions in Particle-Associated and Free-Living Bacterial Communities during aBloom in a Plateau Lake[J]. Frontiers in Microbiology, 2017, 8: 1202–1227.
[25] Angelika R, Herlemann D P R. Particle-Associated Differ from Free-Living Bacteria in Surface Waters of the Baltic Sea[J]. Frontiers in Microbiology, 2015, 6: 1297–1310.
[26] 國家環境保護總局. 水和廢水監測分析方法(第四版)[M]. 北京: 中國環境科學出版社, 2016, 35(1): 139–147.
[27] Bates S T, Berg-Lyons D, Caporaso J G, et al. Examining the global distribution of dominant archaeal populations in soil[J]. The International Society for Microbial Ecology Journal, 2011, 5(5): 908–917.
[28] Marti E, Balcázar, José Luis. Use of pyrosequencing to explore the benthic bacterial community structure in a river impacted by wastewater treatment plant discharges[J]. Research in Microbiology, 2014, 165(6): 468–471.
[29] Caporaso J G, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data [J]. Nature Methods, 2010, 7(5): 335–336.
[30] Schloss P D, Westcott S L, Ryabin T, et al. Introducing mothur: open-source, platform-independent, community- supported software for describing and comparing microbial communities[J]. Applied and Environmental Microbiology, 2009, 75(23): 7537–7541.
[31] 劉志嬌. 達里諾爾湖水動力條件及氫氧穩定同位素試驗研究[D]. 呼和浩特: 內蒙古農業大學, 2015.
[32] 錢瑋, 范竟成, 王金虎, 等. 東太湖地區濕地水質與浮游細菌群落結構關聯性研究[J]. 生物技術, 2017, 1: 90–96.
[33] 劉晨宇, 祝亞楠, 王繼華, 等. 不同季節尾水排放對河道細菌群落結構的影響[J]. 環境科學研究, 2018, 31(5): 893–900.
[34] 丁軼睿, 李定龍, 張毅敏, 等. 滆湖底泥細菌群落結構及多樣性[J]. 環境科學學報, 2017, 37(5): 1649–1656.
[35] Allgaier M, Grossart H P. Diversity and Seasonal Dynamics of Actinobacteria Populations in Four Lakes in Northeastern Germany[J]. Applied and Environmental Microbiology, 2006, 72(5): 3489–3497
[36] 萬甜, 何夢夏, 任杰輝, 等. 渭河流域水體細菌群落的環境響應及生態功能預測[J]. 環境科學, 2019, 40(08): 3588–3595.
[37]Haukka K, Kolmonen E, Hyder R, et al. Effect of Nutrient Loading on Bacterioplankton Community Composition in Lake Mesocosms[J]. Microbial Ecology, 2006, 51(2): 137– 146.
[38] 李玉華, 許其功, 趙越, 等. 松花湖水體中不同空間分布的細菌群落結構分析[J]. 農業環境科學學報, 2013, 32(4): 764–770.
[39] 王歡, 趙文, 謝在剛, 等. 碧流河水庫細菌群落結構特征及其關鍵驅動因子[J]. 環境科學, 2018, 39(8): 3660– 3669.
Surface and bottom characteristics of bacterioplankton community in summer Dali-nor Lake and its key driving factors
Du Lei, Li Changyou*, Li Wenbao, Shi Xiaohong, Yang Xu, Liu Jingjing
IMAR Key Laboratory of Water Resources Protecting and Utilization, Inner Mongolia Agricultural University, Hohhot 010018, China
Bacterioplankton is the key element in the material cycle and energyflow in lake, affecting the migration and transformation of the ecosystem. In this paper, we collect 32 water samples from the surface and bottom water in summer Dali-nor Lake, which locates in Inner Mongolia Plateau and is an inland closed lake. Based on the T-RFLP technology and 16S rRNA sequencing,the community structure of bacterioplankton and its vertical variation characteristics were analyzed in detail. In summer, the diversity and evenness of the bacterioplankton in surface water are higher than bottom water. Meanwhile, bottom water has the highest species richness.On the whole, the Proteobacteria, Actinobacteria, Cyanobacteria, and Bacteroidetes are the dominant phyla in summer Dali-nor Lake. The Proteobacteria is the most dominant phylum in all water layers, with the content of about 46.46% in bottom water, and about 36.21% in surface water, respectively. Furthermore, TDS, DIP in surface water are correlated with most dominant bacteria, TN, Chland WT in the bottom water are the main environmental factors influencing community distribution. In summary, there is a significant correlation between the surface and bottom planktonic bacterial community structure of Dali-norl Lake and different environmental factors, while the water environmental factors in surface and bottom waters have become important factors affecting the evolution of most dominant bacteria.
bacterioplankton; change of surface and bottom water layers; summer; community structure characteristics; Dali-nor Lake
10.14108/j.cnki.1008-8873.2021.06.002
X172
A
1008-8873(2021)06-013-08
杜蕾, 李暢游, 李文寶, 等. 夏季達里諾爾湖浮游細菌群落表、底層結構特征及其關鍵驅動因子[J]. 生態科學, 2021, 40(6): 13–20.
Du Lei, Li Changyou, Li Wenbao, et al. Surface and bottom characteristics of bacterioplankton community in summer Dali-nor Lake and its key driving factors[J]. Ecological Science, 2021, 40(6): 13–20.
2020-05-11;
2020-06-20
國家自然科學基金地區項目(52160021, 51869020); 國家重點研發計劃—國際合作專項(2017YFE0114800); 內蒙古自治區自然科學基金項目(2019MS05032); 內蒙古自治區科技攻關項目(2020GG0009); 內蒙古自治區高等學校“青年科技英才支持計劃”項目(NJYT-20-A14)
杜蕾(1996—), 女, 內蒙古赤峰市人, 碩士研究生, 主要研究方向為湖泊水環境演變及修復, E-mail: 18847163393@163.com
通信作者:李暢游, E-mail: nndlichangyou@163.com

