蛋白核小球藻濃縮制品低溫保藏技術研究*
駱小英 楊潤青 魏 東
(華南理工大學食品科學與工程學院 廣東 廣州 510640)
微藻在水產養殖中應用廣泛,可作為鮮活餌料、調水劑、功能性飼料添加劑等(張國維等, 2020)。我國是世界水產養殖第一大國,對餌料微藻的需求量巨大。小球藻(Chlorella)是一類單細胞綠藻,環境適應能力強、生長速度快,細胞內含有豐富的蛋白質、脂質、葉綠素、維生素等營養成分(嚴佳琦等, 2011)。與世界衛生組織(WHO)和聯合國糧農組織(FAO)于1973年發布的其他食物蛋白的標準蛋白質氨基酸模式(氨基酸的含量、比例和可用性)相比,小球藻蛋白質中的氨基酸模式更有利于實現畜禽等對氨基酸的平衡攝入。此外,魚類以小球藻為餌料進行培養時,具有較高的生物利用率和消化率(Becker, 2007; Lai et al,2019)。蛋白核小球藻(Chlorella pyrenoidosa)是最常見的小球藻品種,2012年已被衛生部批準為新資源食品(Yu et al, 2018),其細胞內的蛋白質含量可高達細胞干重的 59.8% (Li et al, 2019),在水產養殖業具有廣闊的應用前景。何海生等(2019)研究發現,在水產養殖水體中接種蛋白核小球藻可去除水體中的氮和磷,改善水質;同時,可提高養殖動物的特定生長率、成活率及免疫酶活性。
目前,蛋白核小球藻在我國水產養殖業的應用仍存在許多技術瓶頸。例如,微藻鮮活制品在實際應用中常常會出現供應不及時、保質期過短、營養品質和衛生指標大幅下降等問題,不僅會增加育苗成本,也可能帶來病害導致育苗失敗(俞建中等, 2013)。為控制微藻制品中的細菌數量,在保藏前對其進行殺菌處理可有效延長微藻保質期。目前,用于微藻液體殺菌的方法通常是巴氏殺菌及過濾除菌法(李元廣等, 2014)。此外,微藻常用的保藏方法是藻種低溫保藏法,但需要添加不同種類的保護劑,如二甲基亞砜、甲醇等(Chellappan et al, 2020; Saadaoui et al, 2016),一方面會增加保藏成本,另一方面也可能會在水產養殖食物鏈中存在潛在毒性。因此,微藻濃縮制品的直接保藏成為近些年的研究熱點。研究發現,4℃直接保藏2個月的螺旋藻(Spirulina platensis)藻液濃縮制品仍保持較高的細胞活力(劉恒恒等, 2020);微擬球藻(Nannochloropsissp.)和杜氏藻(Dunaliellatertiolecta)濃縮藻液在4℃條件下保藏2個月,其脂肪酸成分及蛋白質含量無顯著變化(Welladsen et al, 2014)。如何有效保持微藻鮮活制品的相對細胞活性、營養品質并延長貨架期,對于微藻在水產養殖業的商業化應用至關重要。
本研究以實驗室光發酵后得到的蛋白核小球藻濃縮藻膏和濃縮藻液為研究對象,考察巴氏殺菌處理以及不同保藏溫度條件下,細胞內的天然色素、蛋白質和細胞活性在連續避光保藏15 d過程中的變化規律,為開發具有實際應用價值的保藏技術提供一定的理論基礎。
1 材料與方法
1.1 實驗材料
蛋白核小球藻(15-2070)由北京大學陳峰教授惠贈,采用Basal培養基(Ogbonna et al, 1997)進行斜面轉接保藏,保藏溫度為4℃。
1.2 實驗方法
1.2.1 蛋白核小球藻光發酵藻液的制備 用接種環從實驗室保存的蛋白核小球藻藻種斜面上挑取一小環,轉接到無菌Basal液體培養基中(121℃高壓滅菌 15 min,含 10 g/L 葡萄糖和 1.25 g/L 硝酸鈉),置于溫度為 30℃、光照為 10 μmol/(m2·s)的搖床中培養 3~ 5 d。隨后,將藻液轉接至帶有LED外光照系統的5 L光發酵罐中。為降低細胞密度增長帶來的遮蔽效應對生長的影響,在培養過程中采用逐步調光策略,光照強度范圍為 120~560 μmol/(m2·s),pH 為 6.50±0.05,溫度為(30±2)℃,攪拌轉速為 150~200 r/min,通氣量為 2.5~10 L/min,消泡劑濃度為 0.3% (W/V),培養 3~ 5 d (駱小英等, 2020)。
1.2.2 蛋白核小球藻濃縮制品的制備 濃縮藻膏制備:取光發酵后藻液于4000 r/min離心10 min,棄上清液后加蒸餾水進行漩渦混合洗滌,離心后棄上清液,再加BG11培養基進行洗滌,離心棄去上清液,得到的離心沉淀即濃縮藻膏(細胞密度為8×1010cells/mL),直接裝入15 mL無菌離心管,裝滿并排除管內空氣用于后續實驗。
濃縮藻液制備:采用BG11培養基懸浮稀釋濃縮藻膏,得到細胞密度為1×108cells/mL的濃縮藻液。裝入15 mL無菌離心管,裝滿后用于后續實驗。
1.2.3 蛋白核小球藻濃縮制品的巴氏殺菌 巴氏殺菌處理參考李元廣等(2014):將制備好的濃縮藻膏和濃縮藻液離心管放入恒溫水浴鍋中,于85℃連續加熱15 min,加熱過程中多次手動混勻。冷卻至室溫后進行后續實驗。
1.2.4 蛋白核小球藻濃縮制品的保藏 將未經巴氏殺菌處理和經巴氏殺菌處理的濃縮制品(藻膏及藻液)分別置于室溫(18℃~25℃)或者低溫(4℃)條件下避光保藏15 d,每組3個平行。保藏起始時,取0.5 mL樣品用于細胞活性測定;保藏過程中,每3 d取樣1次,每次取樣2 mL,經-40℃真空冷凍干燥后測定藻粉中的色素及蛋白質含量。
1.3 分析測試
1.3.1 蛋白質含量 取 100 mg凍干藻粉至消化管中,加入6.40 g混合還原性催化劑及12 mL濃硫酸,靜置過夜后,于消化爐中150℃保持40 min,隨后420℃保持120~150 min,至消化管中的液體呈現透明的綠色,停止消化。冷卻至室溫后,置于半自動凱氏定氮儀(2300,FOSS,美國)上實現自動加液、蒸餾(使用前加入400 g/L NaOH 溶液以及 20 g/L 硼酸溶液),以甲基紅-溴甲酚綠作混合指示劑,用 HCl標準溶液(0.10 mol/L)滴定,粗蛋白含量(%)采用下列公式計算(Wang et al,2020)。

式中,V1和V2分別是滴定空白和滴定樣品所消耗鹽酸標準滴定溶液的體積(mL);m是樣品質量(g);V′是樣品消煮液總體積(mL);V是蒸餾用消煮液總體積(mL)。
1.3.2 色素含量測定 稱取凍干藻粉 10 mg于 2 mL凍存管中,加入適量的陶瓷珠及1 mL 90%丙酮溶液,經研磨儀(Tissuelyser-24,凈信,上海)振蕩后在液氮中迅速冷凍,離心收集上清液。反復多次提取至藻粉呈現白色后,合并所有上清液并定容到10 mL。經6000 r/min離心10 min后,再次吸取上清液定容至10 mL。利用紫外分光光度計(UV2300,天美,上海)測定470、646和663 nm下的吸光度,利用下列公式計算葉綠素a (Chl.a)、葉綠素b (Chl.b)和類胡蘿卜素(Car)的濃度(mg/L) (Chen et al, 2013)。

式中,Ca、Cb、Ct分別為 Chl.a、Chl.b和 Car的濃度,A為吸光度。
1.3.3 細胞活性的測定 利用無碳Basal培養基將收獲的蛋白核小球藻細胞數梯度稀釋至1×103~2.4×106cells/mL,用于后續實驗。
配制熒光探針染料:稱取4.16 mg二醋酸熒光素(FDA),用丙酮定容至 10 mL,配成 1.0 mmoL/L的母液,置于-20℃冰箱中保存。
細胞活性檢測方法:每5 mL梯度稀釋藻液分別加入 0、5、20、40、60、80、100、120和 140 μmol的FDA,充分振蕩后于室溫下避光放置 30 min。按每孔100 μL加樣于 96孔板上,利用多功能酶標儀(Synergy Neo2,BioTek,美國)在 525 nm 下檢測其熒光值(FDA激發波長為488 nm,最大發射波長為525 nm),每組3個平行,結果以平均值±標準差(Mean±SD)表示。保藏前、后細胞相對活性用下列公式計算(吳瑞珊,2008)。

1.4 數據統計分析
采用 Microsoft Origin 2018軟件進行繪圖,使用SPSS Statistics 24軟件通過單因素方差分析(one-way ANOVA)進行統計學分析,顯著性水平為P<0.05或P<0.01。
2 結果與討論
2.1 保藏前、后濃縮藻膏和濃縮藻液的感官變化
在實驗過程中,不同保藏條件下蛋白核小球藻濃縮藻膏和濃縮藻液的顏色和氣味等感官特征變化很大。新鮮制備的蛋白核小球藻藻膏和濃縮藻液均呈正常的濃墨綠色;而經巴氏殺菌處理后則呈不同程度的褐色,這與前人的研究結果一致。小球藻的顏色在115℃加熱 15 min 后出現褐變(Castelló et al, 2018)。這是因為在高溫條件下,小球藻細胞內的色素體受到破壞,從而導致葉綠素大量降解(Morist et al, 2001)。保藏到第3天時,藻膏和濃縮藻液在室溫條件下均產生刺鼻的腥味,膏體變稀,出現腐敗的跡象;而在4℃直接保藏的藻膏和濃縮藻液均未出現明顯變化。隨著保藏時間的延長,未經巴氏殺菌處理的藻膏和濃縮藻液的顏色在室溫條件下逐漸由鮮綠色變成褐色;而在4℃連續保藏15 d后,藻膏和濃縮藻液的顏色均保持為濃墨綠色。此外,保藏在所有條件下的蛋白核小球藻藻膏和濃縮藻液均隨著保藏時間的延長逐漸產生刺鼻的腥味。這種腥味產生是因為高密度藻細胞在常溫下代謝旺盛,而保藏條件下營養有限,部分藻細胞死亡并發生酸敗,產生了一些具有刺鼻性氣味的胺類、醛、酮、脂肪聚合物、過氧化氫和烴類等(陳煒等,2012)。
2.2 不同保藏條件下藻膏的營養品質評價
圖1為蛋白核小球藻藻膏在不同保藏條件下細胞內色素含量隨保藏時間的變化。結果發現,巴氏殺菌后未開始保藏前,藻膏中葉綠素的含量與巴氏殺菌前相比無明顯變化。室溫條件下,無論是否經過巴氏殺菌處理,藻膏在保藏第3天時總葉綠素含量均顯著下降(P<0.01) (圖 1a和圖 1b),直接室溫保藏和巴氏殺菌后室溫保藏的葉綠素損失量分別達到41.11%和34.76%;而在4℃條件下,未經巴氏殺菌處理的藻膏中總葉綠素含量無明顯下降,而經巴氏殺菌處理的藻膏總葉綠素含量下降了42.92% (P<0.01)。這一結果與藻膏在保藏過程中出現的顏色變化呈正相關,說明4℃條件下未經巴氏殺菌處理的蛋白核小球藻的藻膏中細胞內色素含量隨保藏時間的延長未出現明顯變化,且在保藏結束時細胞內色素含量基本與保藏前相同。
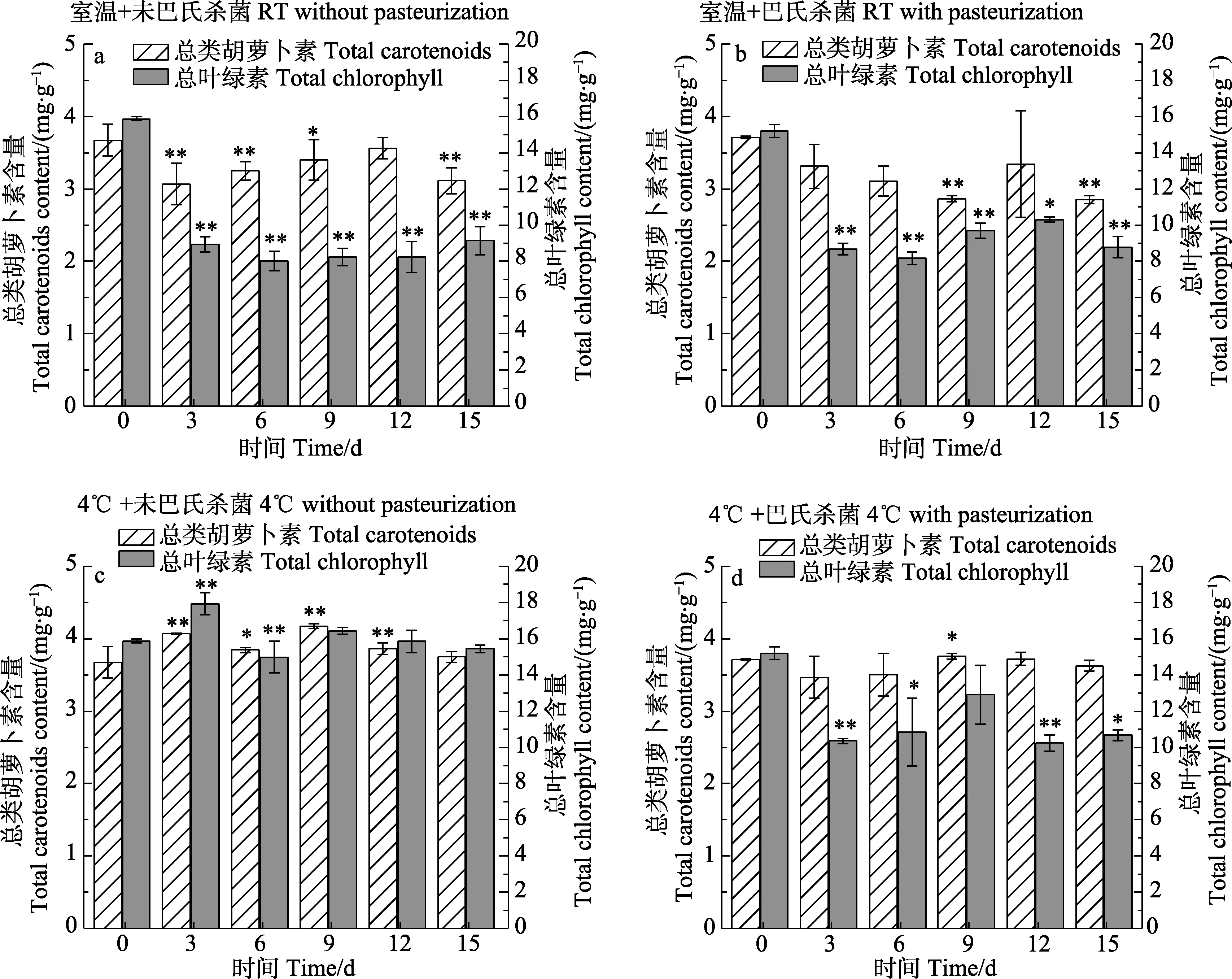
圖1 在不同保藏條件下藻膏中色素含量的變化Fig.1 Changes of pigments contents in algal paste under different preservation conditions
蛋白核小球藻藻膏在不同保藏條件下,細胞內蛋白質含量隨保藏時間的變化見圖2。由圖2可知,經巴氏殺菌處理的藻膏中蛋白質含量與未經巴氏殺菌處理相比,略有下降。隨著保藏時間的延長,藻膏中蛋白質含量出現波動。經巴氏殺菌處理后,在室溫條件和4℃條件下保藏結束時,藻膏蛋白質含量與第0天相比均顯著提高(P<0.05),這可能是巴氏殺菌并不徹底,導致濃縮藻膏腐敗變稀,在凱氏定氮時造成測量誤差;二是由于微生物滋生,菌體蛋白可能被測定計入,導致數據偏高;而直接保藏條件下的則無顯著差異。與此相似的是,細胞密度為8×1010cells/mL的微擬球藻濃縮制品在4℃條件下弱光保存2個月后,其蛋白質含量未出現顯著性變化(Welladsen et al, 2014)。

圖2 在不同保藏條件下藻膏中蛋白質含量的變化Fig.2 Changes of protein contents in algal paste under different preservation conditions
綜上,未經巴氏殺菌處理的蛋白核小球藻藻膏在4℃下連續避光保藏15 d,細胞內色素及蛋白質含量無明顯下降(P>0.05),其總葉綠素含量、總類胡蘿卜素含量及蛋白質含量分別為保藏前的97.20%、100.00%和98.20%。
2.3 不同保藏條件下濃縮藻液的營養品質評價
蛋白核小球藻濃縮藻液在不同保藏條件下細胞內色素含量隨保藏時間的變化情況見圖3。由圖3可知,經過巴氏殺菌處理后,濃縮藻液中的總類胡蘿卜素和總葉綠素含量分別為2.93和11.77 mg/g,比未經巴氏殺菌處理的藻液分別下降了15.32%和24.06%。研究表明,加熱溫度越高,越容易使細胞內的色素降解,且產生的褐變程度越高;同時,巴氏殺菌時間越長,細胞內的總葉綠素含量下降越多(Morist et al, 2001)。與藻膏相比,濃縮藻液經巴氏殺菌處理后總葉綠素損失率更高,這可能是因為濃縮藻液的密度更低,傳熱效率高,受熱更均勻,導致其葉綠素降解更嚴重。在室溫條件下,當保藏時間延長到第3天時,直接保藏和巴氏殺菌保藏的濃縮藻液中總葉綠素含量分別下降到10.59和9.26 mg/g,損失率分別為31.68%和21.33%。培養結束時,葉綠素含量在室溫條件下均極顯著低于初始水平(P<0.01)。與藻膏(圖1a和圖1b)不同的是,在室溫條件下濃縮藻液胞內的總類胡蘿卜素含量隨保藏時間的延長而下降。保藏結束時,未經巴氏殺菌處理和經巴氏殺菌處理的濃縮藻液中總類胡蘿卜素含量分別為保藏前的 51.16%和72.03%。由圖3c和圖3d可知,在4℃條件下保藏的濃縮藻液盡管在保藏過程中色素含量出現波動,但保藏結束時,其總葉綠素和總類胡蘿卜素含量未出現顯著性降低。

圖3 在不同保藏條件下濃縮藻液色素含量的變化Fig.3 Changes of pigments contents in concentrated fluid in different preservation conditions
不同保藏條件下,蛋白核小球藻濃縮藻液蛋白質含量隨保藏時間的變化見圖4。由圖4可知,在室溫條件下,未經巴氏殺菌處理的濃縮藻液蛋白質含量隨保藏時間的延長而顯著上升(P<0.01),這可能是因為未經巴氏殺菌處理的藻液中細菌活動旺盛,可以利用BG11培養基中的氮素及腐敗藻體維持代謝,而在利用凱氏定氮法測定蛋白質含量時無法分離藻體和菌體,菌體蛋白可能被測定計入,從而導致測定的蛋白質含量數據偏高。而經巴氏殺菌處理后再保藏的濃縮藻液的蛋白質含量隨保藏時間的延長而顯著下降(P<0.01),這可能是由于小球藻體在巴氏殺菌后裂解死亡,從而導致蛋白質含量下降。在4℃條件下直接保藏的濃縮藻液的蛋白質含量在保藏結束時未有明顯變化。這與Welladsen等(2014)的研究結果類似,杜氏藻(4.38×108cells/mL)在 4℃條件下保藏 2個月后,蛋白質含量無顯著變化。
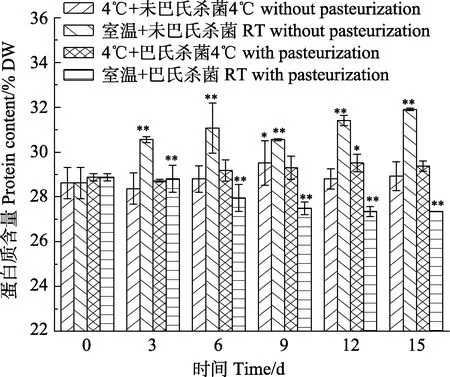
圖4 在不同保藏條件下濃縮藻液蛋白質含量的變化Fig.4 Changes of protein contents in concentrated fluid under different preservation conditions
綜上表明,未經巴氏殺菌處理的蛋白核小球藻濃縮藻液在4℃連續避光保藏15 d,細胞內的色素和蛋白質含量無顯著變化,均為保藏前的100%。
盡管在連續保藏15 d后的蛋白核小球藻藻膏和濃縮藻液中蛋白質含量無顯著變化,但本研究中采用凱氏定氮法無法區分樣品中的蛋白態氮、多肽氮和氨基酸態氮。研究表明,微擬球藻在4℃保藏過程中蛋白質總量及必需氨基酸含量未出現顯著下降,而亮氨酸和纈氨酸含量呈顯著上升的趨勢(P<0.05)。因此,要獲得保藏過程中細胞內蛋白質含量的準確變化,需要采取更精確的分析方法,如利用氨基酸分析儀測定氨基酸等。
2.4 細胞相對活性的分析
2.4.1 熒光探針法分析細胞相對活性 不同細胞密度下FDA濃度對蛋白核小球藻染色效果的影響見圖5。根據吳瑞珊(2008)的方法,設定蛋白核小球藻的濃度梯度為 1.5×103、1.4×104、2.6×105和 2.4×106cells/mL。如圖5所示,利用熒光探針法分析可知,最適細胞密度為2.6×105cells/mL。在過高或過低的細胞密度下,其熒光值幾乎持平。這是因為在過高的細胞密度下,FDA不易滲入細胞而影響染色效果;而細胞密度過低會導致熒光值較低,超出檢測下限而無法檢測到。在細胞密度為2.6×105cells/mL時,檢測所得的熒光強度隨FDA濃度的上升而上升,并在60 μmoL/L時達到最大值,而后隨著FDA濃度的進一步增加,熒光值下降并趨于平緩。因此,根據本研究的結果,建立了檢測細胞相對活性的最佳檢測條件:細胞濃度為2.6×105cells/mL,FDA 終濃度為 60 μmoL/L,染色時間為30 min。這與吳瑞珊(2008)利用FDA檢測眼點擬微球藻(Nannochloropisisoculata)的細胞活性所采用的濃度相一致。

圖5 不同細胞密度下FDA濃度對蛋白核小球藻染色效果的影響Fig.5 Effects of FDA concentration on the cell staining of C. pyrenoidosa at different cell densities
2.4.2 保藏前后藻膏及濃縮藻液的細胞活性分析
由2.1可知,在4℃條件下,未經巴氏殺菌處理的蛋白核小球藻藻膏和濃縮藻液在連續保藏15 d后,顏色始終保持為鮮亮的綠色。針對這2個組別,利用2.4.1中建立的檢測細胞相對活性的最優條件,檢測其保藏前后的細胞相對活性。結果顯示,蛋白核小球藻藻膏保藏前后樣品的熒光值分別為7.74×1010和3.73×1010,細胞相對活性為保藏前的48.26%;濃縮藻液保藏前后樣品的熒光值分別為6.91×106和4.24×106,細胞相對活性為保藏前的61.36%。Montaini等(1995)研究發現,四肩突四鞭藻(Tetraselmis suecica)的細胞活力在保藏過程中會隨著其濃度的升高而下降,這與本研究結果一致。但微擬球藻(Nannochloropsis gaditana)在不同初始保藏濃度下(5和150 g/L)經6個月的4℃避光保藏,其細胞活性均保持在90%以上(Camacho-Rodríguez et al, 2016),這與本研究結果不同,可能是微藻的不同特性所致。
3 結論
本研究主要針對蛋白核小球藻離心濃縮和重懸工藝得到的藻膏(8×1010cells/mL)和濃縮藻液(1×108cells/mL)的保藏條件(是否巴氏殺菌處理及不同保藏溫度)進行了系統評價,證實了新鮮濃縮制品在4℃條件下保藏15 d品質最好。藻膏中的相對細胞活性、總葉綠素、總類胡蘿卜素和蛋白含量分別為保藏前的48.26%、97.20%、100.00%和98.20%;濃縮藻液中的相對細胞活性、總葉綠素、總類胡蘿卜素和蛋白含量分別為保藏前的61.36%、100.00%、100.00%和100.00%。本研究中蛋白核小球藻濃縮制品直接保藏15 d的時間還相對較短,在今后的研究中,應對更長保藏時間下的保藏效果及衛生指標變化進行更深入的研究,以提高實際應用的可操作性。

