黃東海浮游生物群落呼吸率對碳平衡的重要性*
葉文琪 劉誠剛 蔡昱明 翟紅昌 樂鳳鳳 王 斌 壽 鹿 陳全震 杜 萍
黃東海浮游生物群落呼吸率對碳平衡的重要性*
葉文琪 劉誠剛 蔡昱明 翟紅昌 樂鳳鳳 王 斌 壽 鹿 陳全震 杜 萍①
(自然資源部海洋生態系統動力學重點實驗室 自然資源部第二海洋研究所 浙江杭州 310012)
黃東海接受長江沖淡水和黑潮帶來的大量營養鹽和有機物質, 其碳循環對陸架海碳源匯格局至關重要。浮游生物群落呼吸是影響碳循環的重要過程。為揭示黃東海浮游生物群落呼吸率(PCR)對碳平衡的貢獻, 于2011年四季使用黑白瓶培養法測定黃海南部及東海北部浮游群落呼吸率和初級生產力, 并同步測定溫度、鹽度、營養鹽、葉綠素和細菌豐度等環境因子。結果顯示, 浮游生物群落呼吸率的變化范圍為1.61~834.84 mg C/(m3·d), 年均為(184.53±154.21) mg C/(m3·d), 其中夏季最高, 冬季最低。根據相關性分析, 黃東海研究區域浮游生物群落呼吸率, 尤其是在夏天, 主要由浮游植物和浮游細菌貢獻; 浮游生物群落呼吸率與溫度呈顯著正相關, 與鹽度和硅酸鹽呈顯著負相關。通過比較群落呼吸率與初級生產力, 得到研究海區水柱總體呈現異養狀態; 部分站位表層或10 m水層呈現出自養狀態。海氣CO2交換通量的研究顯示, 黃東海陸架主要表現為大氣CO2的碳匯區域。研究提出, 黃東海陸架碳平衡總體異養、卻為碳匯的主要原因可能為: 研究區域表層初級生產吸收CO2高于呼吸產生CO2, 常表現為自養和碳匯; 但表層沉積物的再懸浮和外源有機碳輸入為次表層以下水體提供了豐富的有機碳, 浮游生物群落呼吸產生的CO2高于初級生產吸收的CO2, 呈現異養。當臺風等物理外力破壞水層結構使水體混合時, 次表層及以下的CO2將釋放到大氣中, 表現為碳源。
浮游生物群落呼吸率; 陸架海; 碳平衡; 黃東海
工業革命以來, 人類活動產生的大量CO2導致溫室效應加劇, 促使全球氣候變暖。海洋作為重要的碳匯, 每年吸收約2.5 pg人為排放CO2, 占全球排放的30%左右, 對控制氣候變化至關重要(Khatiwala, 2009; García-Martín, 2019)。海洋對CO2的固定主要通過生物碳泵介導: 浮游植物和光合細菌通過光合作用吸收CO2形成顆粒有機碳(POC); 同時海洋生物通過呼吸作用分解POC, 兩個過程差額的POC沉降到深海即為生物泵(Sigman, 2000)。
盡管陸架僅覆蓋全球海表面積的8%, 但其在全球碳循環中扮演著重要的角色(Sverdrup, 1942)。由于具有較高的初級生產力, 以及接受大量陸源有機碳, 陸架海區被認為是潛在的有機碳匯(Walsh, 1981; Moran, 1991; Walsh, 1991)。然而, 地質資料顯示, 陸架沉積物中并沒有發現較高的有機碳含量(de Haas, 2002)。Borges (2005)研究揭露了沿岸和陸架區域很可能是凈異養狀態, 或表現為大氣CO2的源, 尤其是在低生產力區域。這說明海洋生物的呼吸作用能夠很大程度影響海洋有機碳代謝平衡, 在碳循環中起著重要作用。海洋浮游生物群落呼吸率(plankton community respiration, PCR)是指浮游動物、植物和浮游細菌等浮游生物組成的群落在單位時間內完成的呼吸作用所消耗的有機碳量, 表征群落代謝水平及其對有機物質的消耗能力(Calbet, 2004)。PCR結合總初級生產力(gross primary production, GPP), 可描述和評價生物群落在海洋吸收或釋放大氣CO2中的作用(Ducklow, 2013)。當生態系統的生產量高于消耗量時, 表現為凈自養狀態; 而當消耗量高于生產量時, 表現為凈異養狀態。
生態系統的自養或異養狀態(基于有機碳)與海區CO2的碳源匯性質有關。Smith等(1993)對1961~1991年間西北大西洋的沿岸陸架區域的凈生態系統生產力的研究進行統計得到, 沿岸西北大西洋陸架生態系統總體呈現為異養狀態, 且為大氣CO2的源; Gattuso等(1998)在東北大西洋的沿岸陸架區域的多航次(主要包括LOISE、ELOISE)研究結果顯示, 東北大西洋沿岸等陸架生態系統為凈自養狀態, 且為大氣CO2的匯。但由于海氣CO2通量是由海氣界面CO2壓力梯度驅動的, 受多種環境因素影響, 生態系統營養狀態并不能與海氣CO2通量完全對應, 例如上升流海域是凈自養狀態, 但卻是大氣CO2的源, 這是由于上升流中海洋CO2分壓高于平均大氣CO2分壓(Gattuso, 1998)。
黃東陸架海作為世界上最典型的陸架海之一, 其碳平衡對全球碳通量有重要意義。黃東海是世界最大陸架之一, 同時受到黑潮、長江沖淡水、江蘇沿岸流、浙閩沿岸流和臺灣暖流等水團影響(Chen, 1999; Wang, 2000), 具有多變的季節和空間碳源/匯格局。黃東海海氣CO2通量的研究認為, 黃海總體表現為碳匯, 吸收CO2約1.15 Tg C/a, 東海春、夏、冬季為碳匯, 秋季為碳源, 吸收CO2約6.92~23.30 Tg C/a(焦念志等, 2018; 宋金明等, 2018); 空間上, 夏、冬季表層海水CO2分壓(CO2)西高東低, 春、秋季空間變化劇烈(曲寶曉等, 2013)。但黃東海海氣CO2源匯性質及通量存在明顯的季節變化, 且易受到人類活動的影響。如夏季東海海水受到較強的物理擾動時, 仍然可能成為CO2源; 又如近海富營養化加劇、三峽工程的運行可能導致東海冬季碳匯量減少、秋季碳源匯格局轉變。黃東海海氣CO2源匯性質及通量與營養狀態的關系還不明確, 宋金明等(2018)認為碳源匯性質的季節和水層間變化受生物活動影響較大。Chen等(2003, 2006)分別于1998年11月和2003年6、8月對東海陸架海域浮游生物群落呼吸率進行調查研究, 結果表明東海陸架生態系統表現為凈異養狀態。但目前關于一年四季黃東海區域的群落呼吸作用及其營養狀態變化尚有待進一步研究。
為了解黃東海陸架營養狀態的季節性變化, 闡明生物活動與大氣CO2源匯性質的關系, 以揭示其碳平衡, 本研究對四季南黃海及東海北部不同水層的PCR進行測定, 并分析其分布與環境因子(溫度、鹽度、溶氧、營養鹽、葉綠素和細菌豐度)之間的相關關系, 以確定其分布特征以及區域內PCR的主要貢獻者。此外, 通過比較生物碳的生產量和消耗量, 以說明黃東海陸架生態系統中生物活動對區域內有機碳平衡的作用。
1 材料和方法
1.1 研究區域與采樣站位
分別于2011年3月17日至4月7日(春季)、2011年7月6日至2011年7月24日(夏季)、2011年10月17日至11月5日(秋季)、2011年12月20日至2012年1月11日(冬季)搭載“東方紅2號”調查船進行了海上采樣, PCR采樣站位覆蓋南黃海、東海北部及浙江近岸(121.35°~127.00°E, 27.50°~36.34°N), 各季節略有差異(圖1): 春季27個站位, 其中6個站位測定初級生產力; 夏季26個站位, 3個站位測定初級生產力; 秋季20個站位, 3個站位測定初級生產力; 冬季19個站位。初級生產力的各季節測定站位詳見表3。
1.2 樣品采集與分析
1.2.1 浮游生物群落呼吸率 每個站位分別采集表層(距海面2 m)、中層(南黃海為30 m層, 東海為10 m)和底層(距海底2 m)共三層水樣進行浮游生物群落呼吸率培養實驗。每個水樣用250 mL的生物需氧測定瓶(biological oxygen demand, BOD)采集4瓶, 采樣按照溶解氧(dissolved oxygen, DO)采集要求進行: 將乳膠管的一端接上玻璃管, 另一端套在采水器的出水口, 放出少量水樣洗滌水樣瓶兩次。將玻璃管插到水樣瓶底部, 慢慢注入水樣, 并使玻璃管口始終處于水面下, 待水樣裝滿并溢出水樣瓶體積的1/2時, 將玻璃管慢慢抽出, 瓶內不出現氣泡。2瓶水樣立即測定溶解氧濃度, 均值作為“培養前DO濃度”; 另外2瓶水樣置于對應水層環境溫度黑暗培養24 h。其中表層水樣置于甲板循環水水槽中培養, 中層水和底層水分別置于實驗室控溫培養箱中培養。培養結束后, 取出水樣測定溶解氧濃度, 均值作為“培養后DO濃度”。溶解氧濃度使用YSI 5000臺式溶解氧檢測儀(美國維賽)測定, 測定結果經滴定法結果校正后用于分析。浮游生物群落呼吸率[μmol O2/(L·d)]計算公式為:
浮游生物群落呼吸率=(培養前DO濃度-培養后DO濃度)/培養時間, (1)
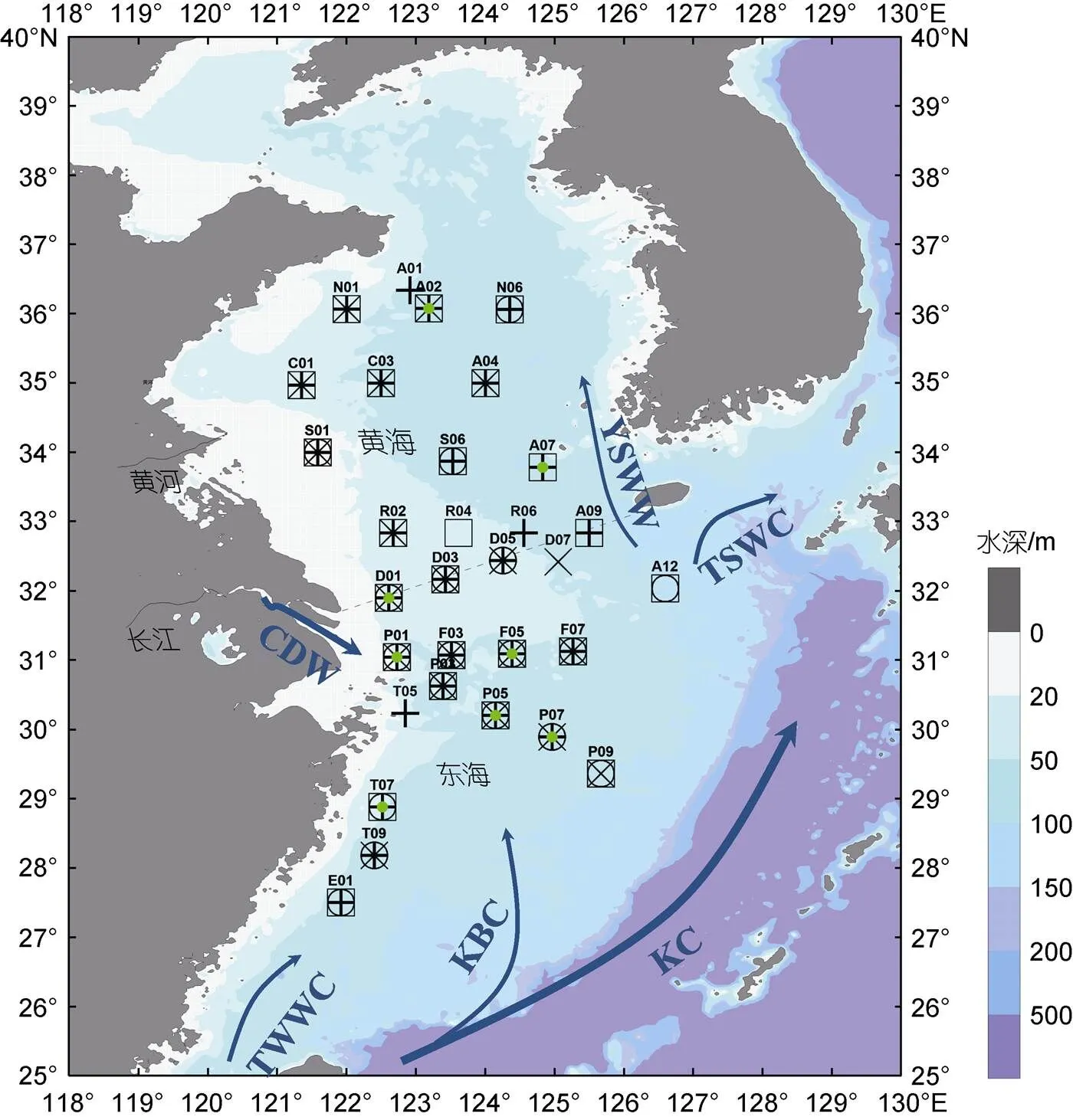
圖1 2011年四季浮游生物群落呼吸率采樣站位圖
注: “+”代表春季, “□”代表夏季, “×”代表秋季, “○”代表冬季, 綠色點代表初級生產力測定站位。CDW表示長江沖淡水, KBC表示黑潮分支, KC表示黑潮, TSWC表示對馬暖流, TWWC表示臺灣暖流, YSWW表示黃海暖流。虛線表示黃海和東海的分界線
應用呼吸熵(respiration quotient, RQ)為1, 將呼吸率由氧O2轉換為碳的單位mg C/(m3·d)(Hopkinson, 1985)。
1.2.2 初級生產力 使用透明度盤測定海水的透明度, 確定采樣的光學深度。按光學深度, 在光強為表層的100%、50%、30%、10%、5%和1%的深度上采水樣。在弱光下, 將水樣經孔徑為200 μm的篩絹過濾, 分裝至提前用體積分數2%的稀鹽酸浸泡24 h的培養瓶中, 每層樣品包括兩個白瓶和一個黑瓶, 第一層和第四層樣品分裝一個準確體積的零時間培養瓶, 取相同體積37~370 kBq的14C工作溶液加至每個培養瓶, 培養24 h。用微量洗液器從每一零時間培養瓶中吸取一定體積水樣兩份, 分別移入2個閃爍瓶中, 加20 mL閃爍液, 混勻, 用于放射性活性測定。將已加有14C的培養瓶, 放入各自相應的培養箱內, 再放入透明的培養箱內, 記下開始培養時間, 用流動的表層海水保持培養期間的溫度恒定。培養開始后, 立即過濾兩個零時間樣品, 所得載有浮游植物的濾膜, 放入閃爍瓶中, 存放于-20 °C低溫冰箱中。樣品培養后用孔徑為0.65 μm的纖維素酯微孔濾膜進行過濾, 將濾膜放入閃爍瓶中, 存放于-20 °C低溫冰箱中。在實驗室通風櫥中, 加入1 mL 0.1 mol/L的鹽酸, 15 min后加蓋。向閃爍瓶中加入10 mL閃爍液, 在振蕩器上振蕩20 min后, 把閃爍液置于液體閃爍計數儀( AccuFLEX LSC-8000, HITACHI,日本)內, 使樣品暗適應12 h后測定。
1.2.3 浮游細菌豐度 用預先經稀鹽酸浸泡并沖洗烘干的PEB瓶, 采集3.6 mL水樣, 加入終濃度10%的多聚甲醛固定后, 于液氮中保存帶回實驗室。測定前先于室溫下解凍, 取0.5 mL水樣用SYBRGreen-1進行染色后, 使用流式細胞儀(BDFACSCalibur, BD公司, 美國)測定細菌總數。
1.2.4 環境因子 深度、溫度、鹽度數據均由“東方紅2號”調查船配備的Seabird 911 PlusCTD獲得。營養鹽(活性硅酸鹽SiO3-Si、活性磷酸鹽PO4-P、硝酸鹽NO3-N、亞硝酸鹽NO2-N、銨鹽NH4-N)的測定方法為: 分別采集表層、10 m、30 m、底層水樣100 mL, 用孔徑為0.45 μm的醋酸纖維濾膜過濾, 濾液在4 °C臨時保存, 48 h內在船上實驗室用Skalar san++型營養鹽自動分析儀測得。溶解無機氮(dissolved inorganic nitrogen, DIN)為硝酸鹽、亞硝酸鹽、銨鹽濃度之和。
葉綠素濃度的測定: 分別采集表層、10 m、30 m、底層水樣, 用0.7 μm孔徑的GF/F玻璃纖維濾膜進行過濾, 過濾體積為50~100 mL。過濾后的濾膜置于15 mL Falcon離心管中, 存放于-20 °C低溫冰箱。回實驗室后, 向離心管中加入10 mL體積分數為90%的丙酮, 搖蕩, 置于低溫冰箱內, 提取12~24 h。取出樣品后, 置于黑暗處使樣品恢復室溫, 用唐納熒光計(10-AU型, TURNER公司, 美國)測定葉綠素和脫鎂葉綠素濃度。
1.3 數據分析
采用非參數檢驗(Kruskal-Wallis test, K-W檢驗)方法分析營養鹽的季節差異以及浮游生物群落呼吸率的季節、層次和區域間差異。利用Spearman相關系數分析浮游生物群落呼吸率與環境因子(溫度、鹽度、營養鹽濃度、溶氧濃度、葉綠素濃度、細菌豐度)的相關性, 并利用線性回歸分析各環境因子與浮游生物群落呼吸率的線性相關性, 以上分析均通過SPSS20.0軟件完成。
生態系統的營養狀態用總初級生產力(GPP)與總群落呼吸率(PCR)的比值描述, 即GPP/PCR值(Odum, 1956)。PP/CR小于1, 認為海區生態系統表現為異養; PP/CR大于1, 認為海區生態系統表現為自養。
2 結果
2.1 浮游生物群落呼吸率時空分布特征
研究區域PCR的變化范圍為1.61~834.84 mg C/(m3·d), 均值為(184.53±154.21) mg C/(m3·d)。季節和水層間差異顯著, 且季節間差異(=0.220,=0.001)比水層間(=0.120,=0.001)差異更顯著。兩兩季節間PCR差異均顯著(<0.01), 夏季最高[(266.63±172.28) mg C/(m3·d)], 其次為秋季[(206.60±175.77) mg C/(m3·d)], 再次為春季[(142.74±107.06) mg C/(m3·d)], 冬季最低[(94.68±74.21) mg C/(m3·d)]。兩兩水層間PCR也具有顯著差異(=0.120,=0.001), 中層最高[(212.46±178.27) mg C/(m3·d)], 其次為表層[(195.68±162.47) mg C/(m3·d)], 底層最低[(150.19±115.37) mg C/(m3·d)]。
PCR具有一定的水平分布變化, 且各季節的空間變化特征不同(圖2)。將研究站位分為黃海南部和東海北部兩個區域, 兩個區域間PCR均值僅在夏季(=0.018)和冬季(=0.025)的底層水存在顯著差異(表1)。春季表層PCR在長江口區域和南黃海北部較高; 中層在長江口區域較高; 底層分布較均勻, 南黃海區域略高于東海北部。夏季表層和中層PCR的高值主要分布在長江口區域和浙江近岸區域, 并沿長江口離岸方向呈現遞減趨勢; 底層南黃海區域高于東海北部, 且差異顯著(<0.5)。秋季各層PCR在南黃海北部沿岸和東海離岸區均較高, 在不同水層之間的分布相似。冬季因天氣和海況原因, 南黃海區域的有效數據較少, 僅N06站位較高; 東海北部在D01站位和P斷面的離岸側較高。
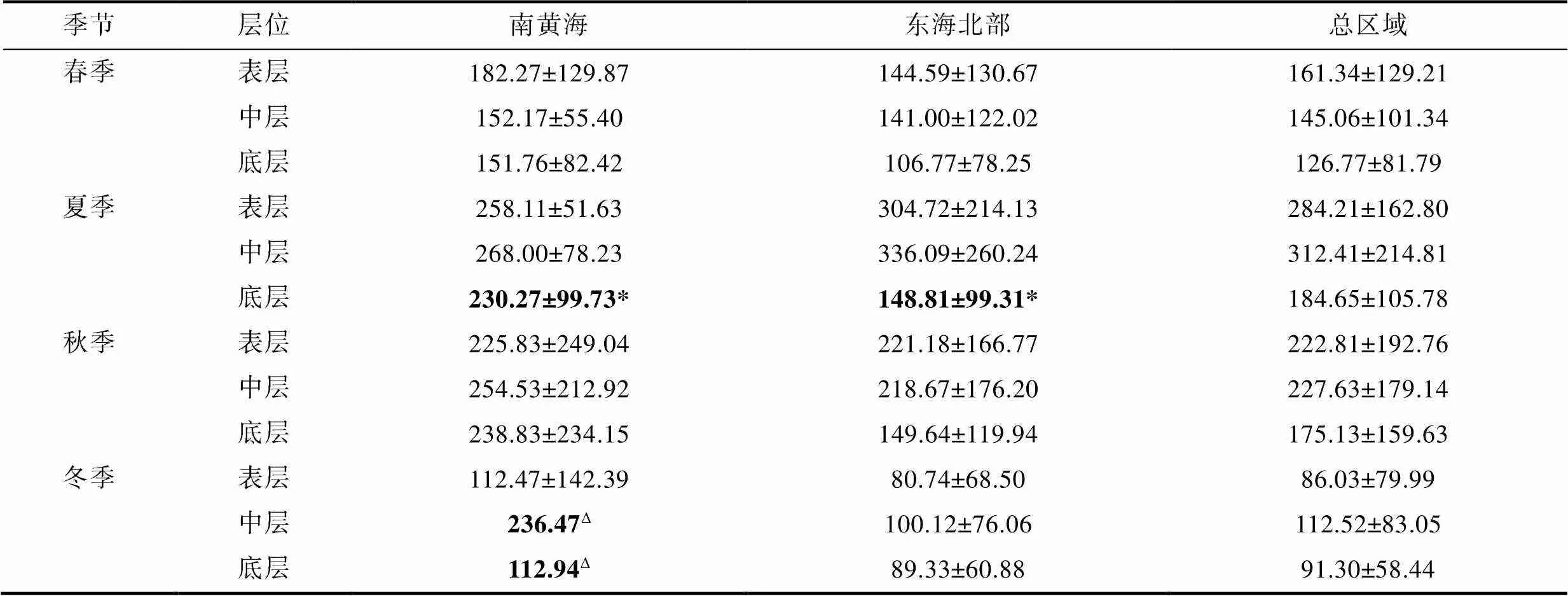
表1 2011年南黃海、東海北部四季各水層平均PCR[單位: mg C/(m3·d)]
注: *表示顯著性<0.05;Δ表示冬季南黃海中、底層僅有一個站位的有效數據。

圖2 2011年四季各層次PCR分布圖
注: 圓餅圖表示浮游生物群落呼吸率分布, 等值線圖表示鹽度分布, 彩虹等值線圖表示溫度分布
2.2 影響浮游生物群落呼吸率時空分布的環境因素
2.2.1 黃東海研究區域環境因素 研究區域夏季、秋季平均溫度最高[分別為(19.11±6.68) °C、(20.10±3.24) °C], 其次為冬季[(14.61±3.33) °C], 春季溫度最低[(9.34±2.61) °C]。春季溫度垂直分布較均勻, 南黃海東側和研究區域南側溫度較高。夏季溫度垂直分布差異較大, 表層普遍高溫, 但長江近岸口溫度較低; 中底層南黃海東北側表現為明顯低溫。秋季表中層溫度垂直分布較均勻, 但南黃海底層東北側表現為明顯低溫。冬季, 溫度垂直分布較均勻, 整體呈現出東南向西北遞減的趨勢(圖2)。
研究區域四季各水層鹽度總范圍為23.6~34.6, 四季的空間分布較相似(圖2), 均表現為長江口較低, 東海北部東南側、南黃海東側較高。其中夏季表層鹽度最低, 尤其是長江口。
DIN季節分布差異顯著(=0.00), 在春季[(10.72±4.04) μmol/L]最高, 其次為夏季[(9.10±8.59) μmol/L], 秋季[(7.14±4.43) μmol/L]與冬季[(7.38±4.14) μmol/L]最低。PO4-P的季節差異不顯著, 在秋季[(0.69±0.49) μmol/L]最高, 其次為夏季[(0.52±0.45) μmol/L]、冬季[(0.51±0.25) μmol/L]、春季[(0.50±0.24) μmol/L]。SiO3-Si的季節分布差異顯著(=0.00), 在春季[(15.81±6.21) μmol/L]最高, 其次為冬季[(11.82±4.21) μmol/L]、秋季[(11.39±7.47) μmol/L], 夏季[(10.89±8.44) μmol/L]最低。在空間分布上, 春季, DIN在長江口近岸較高, 黃海及東海遠岸處較低; PO4-P在東海北部西北側及南黃海東側較高, 而在浙江近岸及南黃海西側較低; SiO3-Si在東海北部及南黃海東側較高, 南黃海西側較低。夏季, DIN及SiO3-Si在長江口近岸較高; PO4-P在東海北部西北側較高。秋季, DIN、PO4-P及SiO3-Si在東海北部較高。冬季, DIN在東海北部中北側及南黃海北部較高; PO4-P在東海北部及南黃海西側較高; SiO3-Si在東海北部較高。
對東海北部和南黃海四季各層平均葉綠素進行統計(圖3a)。總體而言, 春季各層次葉綠素均較高, 夏、秋季表、中層較高, 但底層較低, 冬季普遍較低, 東海北部高于南黃海。對不同區域而言, 南黃海的葉綠素在春季最高, 尤其是春季底層, 冬季最低, 尤其是冬季底層; 東海北部除冬季底層高于表、中層外, 其余季節表、中層均高于底層。
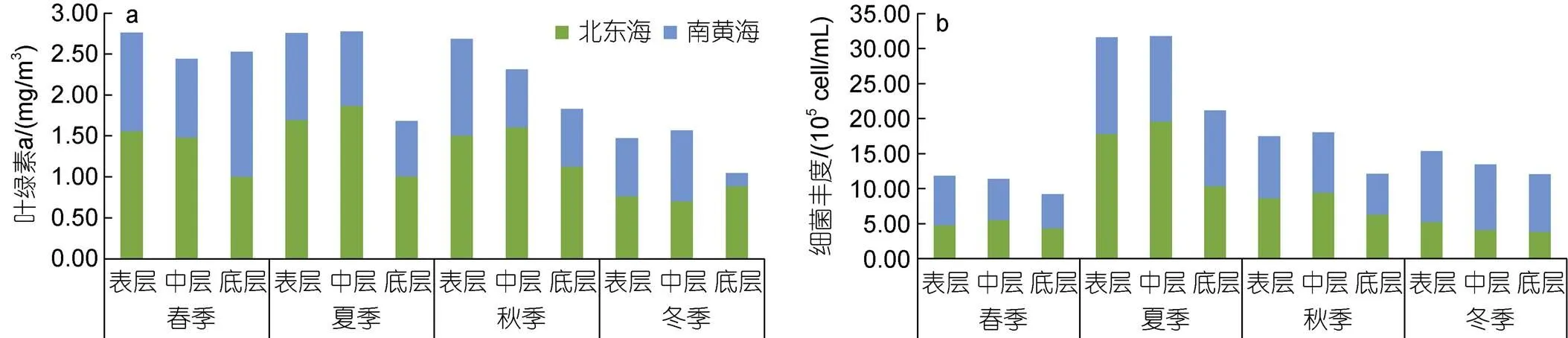
圖3 南黃海、東海北部四季各層平均葉綠素a (a)、平均細菌豐度(b)的比較
對東海北部和南黃海四季各層平均細菌豐度進行統計(圖3b)。夏季平均細菌豐度最高, 秋季與冬季稍高于春季。四季底層中浮游細菌豐度相較于其他水層均較低。東海北部與南黃海浮游細菌豐度在春、夏、秋季分布較均勻, 但在冬季南黃海浮游細菌豐度高于東海北部。
2.2.2 PCR與環境因素的相關性分析 Spearman相關性分析結果顯示(表2), 整體上, 研究區域PCR與細菌豐度、葉綠素、溫度呈極顯著正相關, 與硅酸鹽、鹽度呈極顯著負相關。其中, 與細菌豐度相關性最高, 其次是硅酸鹽、鹽度、葉綠素和溫度, 再次是磷酸鹽。
PCR與葉綠素濃度(chl)和細菌豐度(BA)的線性回歸分析模型得到PCR=57.070+11.367×BA+ 25.688×chl(=44.297,<0.001), 表明在南黃海和東海北部區域, 大部分PCR是由浮游植物和浮游細菌貢獻。
春季, 研究區域PCR空間變化與溶解氧呈極顯著正相關(=0.004), 與溫度(=0.001)呈極顯著負相關, 也與細菌豐度顯著正相關、與鹽度顯著負相關。
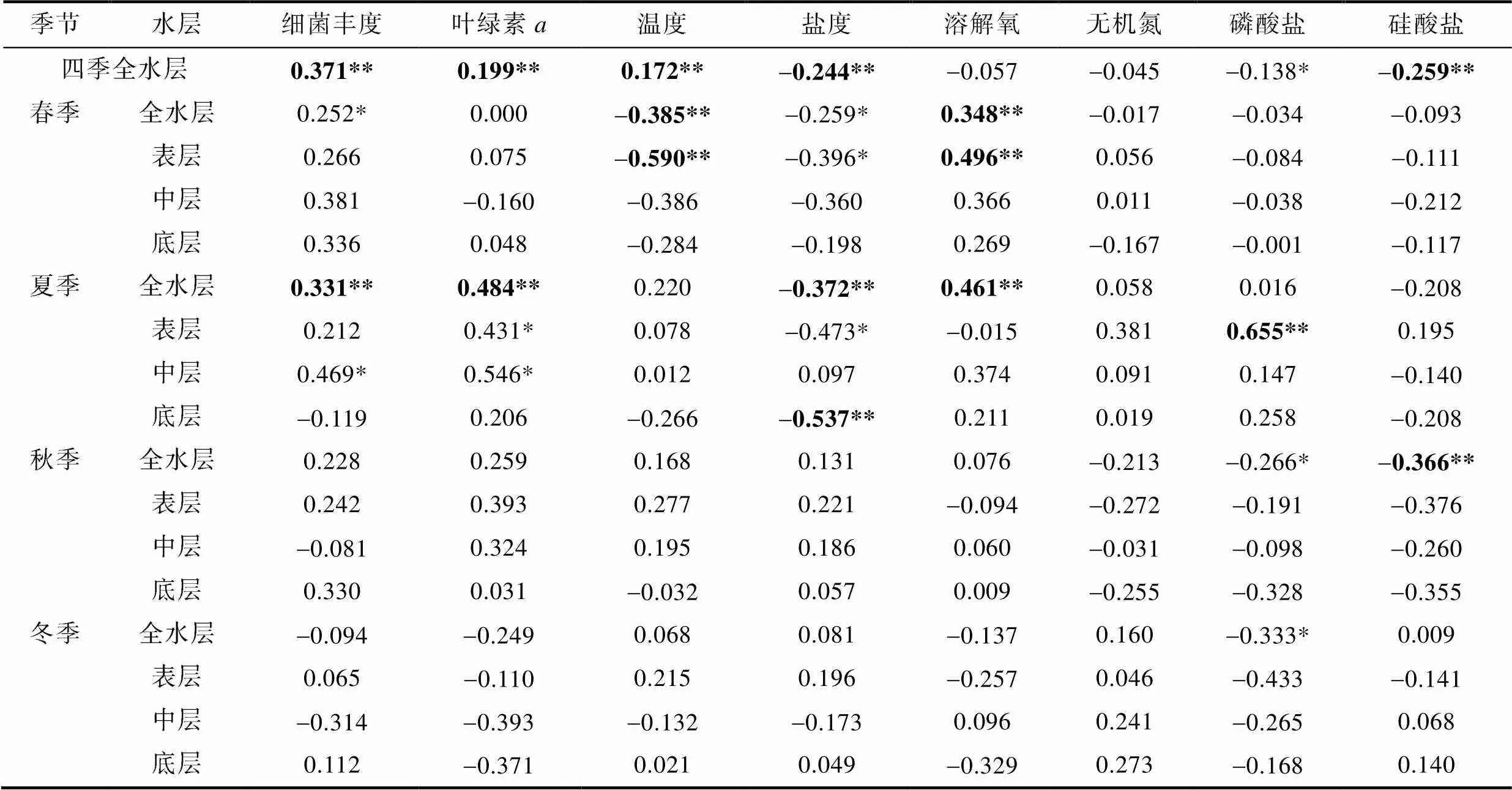
表2 四季各水層PCR與環境因素的相關性
注: **表示顯著性<0.01; *表示顯著性<0.05。
其中, 春季表層PCR的水平變化與溶解氧呈極顯著正相關(=0.008), 而與溫度呈極顯著負相關(=0.001), 與鹽度顯著負相關(表2)。
夏季, 研究區域PCR空間變化與細菌豐度(=0.009)、葉綠素(=0.000)、溶解氧(=0.000)呈極顯著正相關, 與鹽度呈極顯著負相關(=0.003)。其中, 夏季表層PCR的水平變化與磷酸鹽(=0.002)呈極顯著正相關, 與葉綠素呈顯著正相關, 與鹽度呈顯著負相關; 中層與細菌豐度和葉綠素呈顯著正相關; 底層則與鹽度(=0.007)呈極顯著負相關。
秋季, 黃東海PCR與硅酸鹽(=0.006)呈極顯著負相關, 也與磷酸鹽呈顯著負相關。
冬季, 研究區域PCR與磷酸鹽呈顯著負相關。
秋冬季節, 研究區域PCR在各水層的水平分布與上述環境因子的相關性不顯著。
2.3 南黃海及東海北部生態系統群落呼吸率與初級生產力的相對關系
選取初級生產力與浮游生物群落呼吸率數據均有效的站位, 計算水柱凈浮游生物群落呼吸率[ICR, mg C/(m2·d)]和真光層深度的水柱初級生產力[IPP, mg C/(m2·d)] (表3)。所有站位的水柱群落呼吸率ICR均高于水柱初級生產力IPP, 即所有站位IPP/ICR均小于1, 表明研究海區水柱呈異養狀態。
但比較真光層初級生產力均值[PP, mg C/(m3·d)]與真光層的群落呼吸率[LCR, mg C/(m3·d)], 以下季節某些站位和水層PP/LCR>1: 春季A07站位表層, P01站位中層, T07站位表、中層; 夏季F05站位上層; 秋季A02站位表、中層, P07站位中層(表3); 表明這些季節站位的水層生態系統為凈自養狀態, 而其他水層為凈異養狀態。在空間上, 表現出南黃海東部A07站位春季表層呈凈自養狀態; 南黃海北部A02站位秋季表、中層呈凈自養狀態; 長江口區P01站位春季中層呈凈自養狀態; 長江口遠岸區F05站位夏季表層、P07站位秋季中層呈現凈自養狀態, 浙江近岸T07站位在春季表中層呈現凈自養狀態。
3 討論
3.1 黃東海陸架生態系統具有較高的浮游生物群落呼吸率
全球陸架海區域面積雖然不及全球海洋表面積的8% (Sverdrup, 1942), 但卻是全球生產力最高的區域之一(Liu, 2000), 這個區域的碳通量對全球而言不可忽視。世界典型海域如西北大西洋沿岸、東歐沿岸等, 其浮游生物群落呼吸率均已受到廣泛關注(表4)。與其他沿岸海域相比, 南黃海和東海北部PCR較高, 根據分析, 其他多數海區溫度、葉綠素比本海區低、鹽度比本海區高, 這種現象也符合本研究得到PCR與溫度、葉綠素呈正相關, 而與鹽度呈負相關的結果(表2)。東北大西洋東歐沿岸陸架由于緯度較高, 平均表層溫度為10 °C左右(García- Martín, 2019), 遠低于本研究區域。東太平洋秘魯智利沿岸陸架海區具有典型上升流, 平均表層溫度較低, 且葉綠素也低于本研究區域(Daneri, 2000)。日本相模灣位于北太平洋沿岸, 其緯度與本研究區域相似, 但其受黑潮暖流影響更大, 鹽度較高, 葉綠素較低(Hashimoto, 2006)。西北大西洋與本研究區域位于同一緯度, 且受到與黑潮暖流相似的墨西哥暖流影響, 其四季溫度、葉綠素均與本研究區域較相似(Griffith, 1995), 因此與本研究區域PCR相當。
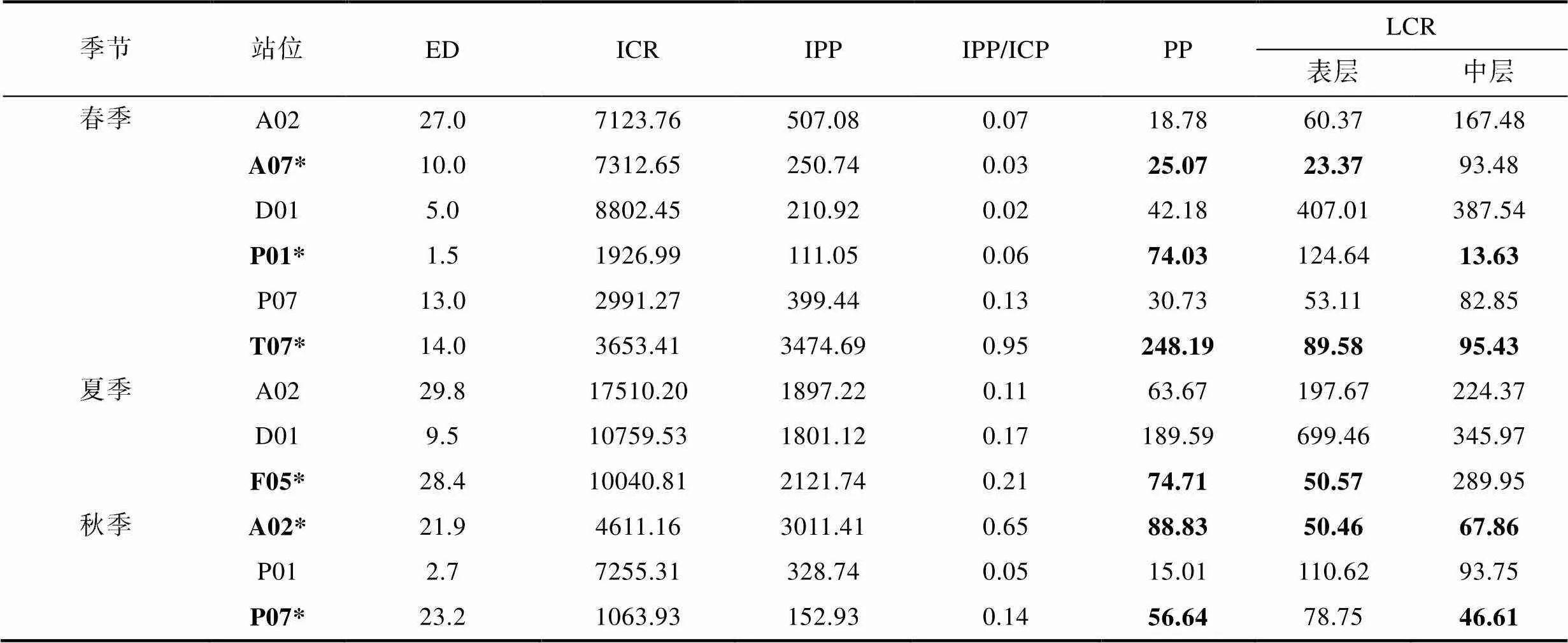
表3 浮游生物群落呼吸率與初級生產力的關系
注: 表中ED為真光層深度(m); ICR為表層到底層的水柱凈浮游生物群落呼吸率[mg C/(m2·d)], IPP為真光層的水柱初級生產力[mg C/(m2·d)]; PP為真光層初級生產力均值[mg C/(m3·d)]; LCR為表層或中層(A2和A7站位為30 m層; 其他站位為10 m層)的浮游生物群落呼吸率[mg C/(m3·d)]。加粗表示PP>LCR, *表示PP>LCR的站位
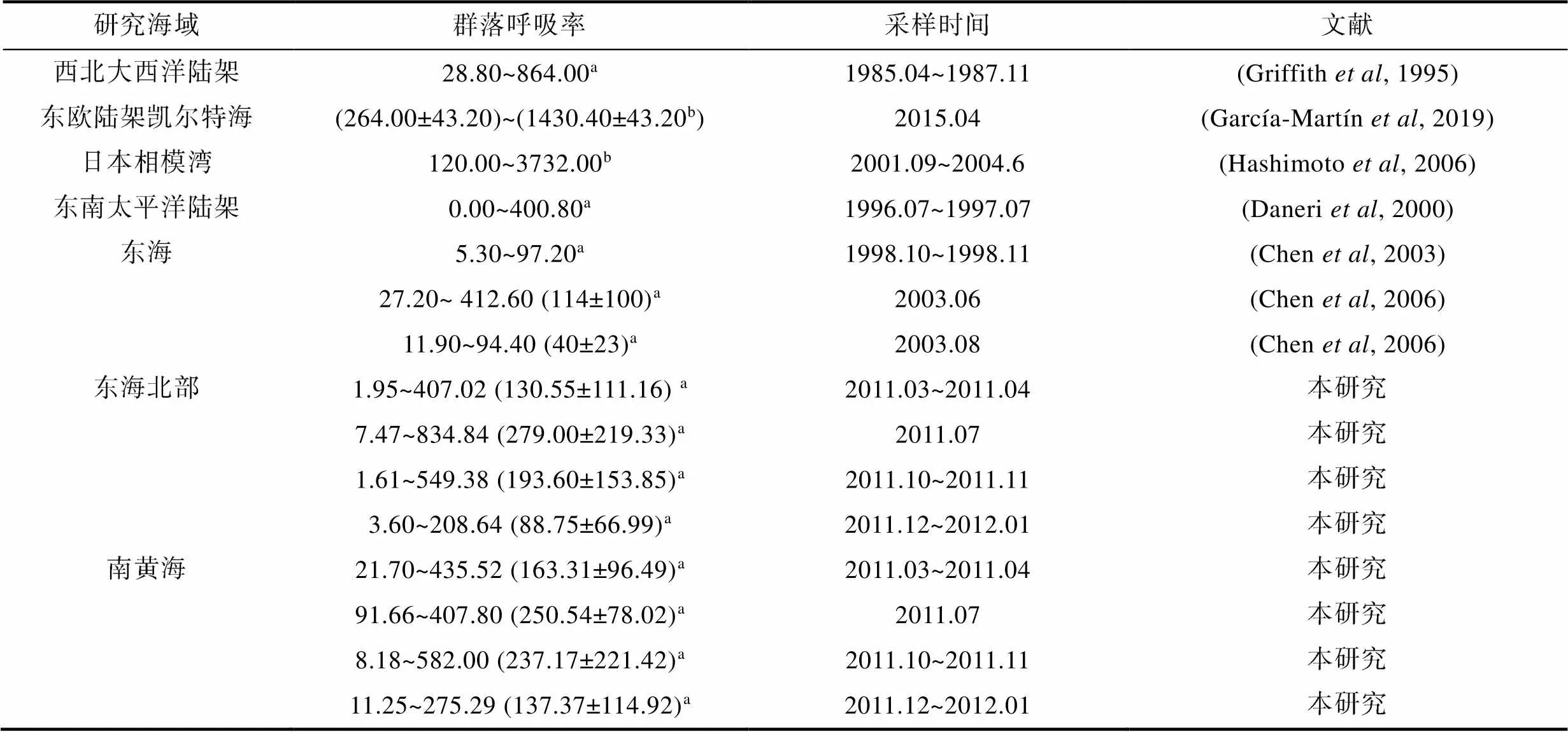
表4 世界不同海區PCR的比較
注: a代表平均群落呼吸率, 單位為mg C/(m3·d); b代表真光層水柱群落呼吸率, 單位為mg C/(m2·d)
黃海是完全位于陸架上的一個半封閉淺海, 由于其深度較小, 因此對季節交替所施加的作用響應較快。目前對黃海生態系統群落呼吸率的研究尚為空缺。本研究顯示, 南黃海區域多數季節和水層的PCR與東海北部研究區域相當。南黃海區夏季底層PCR較東海北部高, 主要與東海北部夏季底層低氧及南黃海夏季冷水團影響有關。本研究得出夏季底層葉綠素與細菌豐度均較低(圖3), 且PCR與這兩者不相關(表2), 說明在此時PCR的主要貢獻者可能是浮游動物。本研究觀察到東海北部夏季底層存在低氧現象, 其平均溶解氧含量為4.68 mg/L, 而南黃海夏季底層平均溶解氧含量為7.33 mg/L。低氧抑制了底層大部分需氧浮游生物的生長代謝, 導致東海北部夏季底部較低的PCR。此外, 低溫、高鹽的南黃海夏季冷水團具有穩定的溫鹽條件(蘇紀蘭, 2005), 這為浮游動物提供了躲避夏季高溫傷害的環境(孫躍等, 2020)。
東海66%的面積位于陸架上, 受黑潮和長江沖淡水的季節性變化影響, 不同季節有明顯的變化特征。相比于往年東海PCR的研究結果, 本研究調查區域得到的PCR較大。Chen等(2003, 2006)在1998年秋季及2003年夏季(6, 8月)東海南部陸架區的PCR結果均低于本研究結果(表4)。2003年夏季溫度與本研究相似, 6月葉綠素濃度較本研究高, 但8月葉綠素濃度遠低于本研究。Chen等(2003)在研究中提出, 東海南部區域營養鹽(尤其是硝酸鹽)是限制浮游生物群落呼吸率的因素之一。而本研究東海北部, 離長江口較近, 夏季長江沖淡水范圍擴增, 攜帶大量氮營養鹽進入東海陸架區域(蘇紀蘭, 2005), 硝酸鹽含量較高[(11.25±9.79) μmol/L], 未觀察到寡營養站位(硝酸鹽含量<0.3 μmol/L), 因此不受硝酸鹽限制, 這也與本研究夏季PCR與無機氮鹽顯著不相關的結果相符合(表2)。故本研究中東海北部PCR較高可能主要與硝酸鹽濃度較高有關。
3.2 浮游植物與浮游細菌是春夏季表中水層PCR的主要貢獻者
盡管對于全年全水層而言, 浮游植物和浮游細菌為PCR的主要貢獻者, 但具體分析各季節的各水層, 發現各水層PCR與葉綠素和浮游細菌豐度的相關性卻不顯著。浮游植物和浮游細菌主要為春、夏季表、中層PCR的貢獻者。
在本研究結果中, 僅有夏季表現為PCR與浮游細菌豐度和葉綠素極顯著相關(表2), 結合表中層較高的浮游細菌豐度及葉綠素(圖3a, 3b), 說明夏季表中層浮游植物及浮游細菌的呼吸作用貢獻了全年大部分的PCR。夏季低鹽的長江沖淡水范圍的擴展, 大量由沖淡水帶來的有機碳和無機氮鹽進入黃東海陸架表層區域(蘇紀蘭, 2005), 大量有機碳為浮游細菌生長繁殖提供底物, 無機氮鹽為浮游植物生長代謝提供底物, 大量浮游植物光合作用消耗磷酸鹽, 導致磷酸鹽成為表層浮游植物生長繁殖的相對限制性因素, 進而成為限制PCR的因素, 這也與本研究發現在夏季表層PCR與磷酸鹽呈極顯著相關的結果相一致(表2)。
在春季, 葉綠素濃度較高, 但研究區域PCR與葉綠素相關性不顯著。這可能是由于春季黃東海區域高發赤潮, 表、中層葉綠素濃度均較高, 導致PCR空間變化不明顯。并且大量的浮游植物死亡下沉, 導致底層具有較高的葉綠素濃度。春季高發的赤潮, 導致表層水體耗氧較快, 由此溶解氧成為PCR的限制因素, 這與本研究春夏季PCR與溶解氧的極顯著相關性結果相符合(表2)。
在春、夏季底層, PCR的主要貢獻者可能是其他浮游生物而不是浮游植物或浮游細菌, 或者可能是所有浮游生物的共同作用。盡管本研究并未統計同步的浮游動物在各季節各水層的豐度, 但除春季外, 底層均具有較低的葉綠素濃度和細菌豐度(圖3), 推測底層PCR主要是由浮游生物共同作用提供的, 而不是由哪一類群主導。在夏季底層, 南黃海PCR高于東海北部, 且具有顯著差異(表2), 結合已有研究說明浮游動物豐度和生物量在黃南海較東海北部高(孫躍等, 2020), 說明底層浮游動物可能是PCR的主要提供者。
秋冬季節研究區域PCR與葉綠素濃度和細菌豐度沒有明顯關系, 在以往的研究中也存在相似的結果。Chen等(2003)在東海的研究顯示秋季葉綠素或初級生產力與PCR之間無相關性。細菌豐度或細菌生產力與PCR之間較低的相關性在其他陸架研究中也有發現(Biddanda, 1994)。這顯示在秋冬季節, 黃東海陸架區域主要受浮游生物共同影響, 而不受浮游植物或浮游細菌的單一影響, 其中浮游原生動物可能為有機碳的消耗提供了重要作用(Del Giorgio, 1997; Chen, 2003)。此外, 在秋季觀察到, 浮游群落呼吸率與硅酸鹽濃度呈現顯著負相關。這可能是由于夏季大量浮游植物的光合作用, 耗盡水體中的營養鹽, 隨著夏末浮游植物大量死亡, 秋季浮游群落呼吸率降低, 而硅酸鹽含量在夏季降低而秋季開始回升(李伯志, 2018)。
3.3 黃東海陸架生態系統營養狀態與碳平衡之間的相關性
目前對海區大氣CO2的源匯主要通過海氣CO2通量判斷。基于對黃東海海氣界面CO2通量估計碳通量的研究顯示, 黃海在冬季、春季表現為大氣CO2的碳匯, 即從大氣中吸收CO2, 而在夏季、秋季向大氣中釋放CO2, 表現為碳源; 而東海在冬、春、夏季節表現為大氣CO2的碳匯, 而在秋季表現為大氣CO2的碳源, 全年表現為大氣CO2的碳匯(宋金明等, 2018)。海氣CO2交換在不同季節具有顯著的時空變化與復雜的受控因素。本研究從生物學角度, 通過分析浮游生態系統營養狀態說明黃東海陸架區域的CO2源匯性質。
以總初級生產力與總群落呼吸率的關系來判斷黃東海陸架海域生態系統的營養狀態, 結果顯示研究海區春、夏、秋季調查站位水柱均表現為凈異養狀態(表3), 表明研究區域的原位初級生產力吸收CO2低于浮游生物呼吸產生CO2。這種現象也在過去對東海生態系統營養狀態的研究中發現, Chen等(2003, 2006)研究得到, 在夏秋季節東海表現為異養狀態, 但海氣CO2交換通量顯示該海區為碳匯。
南黃海及東海北部總體表現為碳匯而水體為異養狀態, 這一現象主要是由于水體的分層作用、再懸浮的沉積有機碳利用以及甲板暗培養法的缺陷三方面導致的。
Chen等(2006)提出, 通過浮游生物呼吸產生的CO2, 以溶解無機碳的方式被固定在次表層中, 并影響了表層中CO2的通量。Chou等(2009)對夏季東海陸架碳化學成分垂直分布的研究也證明了這一觀點, 夏季海水分層現象是東海異養水體中維持CO2碳匯的關鍵因素: 當這種分層現象被打破, 海水混合時, 儲存在次表層水體中的溶解CO2也會釋放到大氣中。
本研究發現, 春、夏季浙江近岸上升流區域(T07站)和夏季長江口遠岸區(31°N斷面, F05)的上層水呈現自養狀態, 但真光層以下呈異養狀態, 與長江口區域基于浮標數據獲得的結果高度一致(Zhang, 2019), 即春、夏季浙江近岸和夏季長江口遠岸區的生態系統是大氣CO2的碳源或碳匯取決于海區的物理狀態: 當風平浪靜、水體分層穩定時, 該生態系統為大氣CO2的匯; 但當有風過境, 表底層水混合充分時, 該生態系統則可能成為大氣CO2的源。
此外, 盡管陸架認為是CO2的碳匯, 且有大量外源輸入有機碳, 但研究顯示, 陸架的大部分區域并沒有積累有機物質(de Haas, 2002)。沿岸長江沖淡水將大量有機碳從陸地補充到沿岸和陸架生態系統, 黑潮水攜帶高濃度的DOC侵入東海陸架, 另外富含有機質的沉積物通過上升流再懸浮進入黃東海陸架區域, 都是外源碳源的重要部分(Chen, 1999; Gong, 2000)。在東海雖然觀察到較高的沉積率, 但沉積物中有機碳的含量不超過預期的1% (Lin, 2002), 這表明大部分的有機碳被呼吸消耗或輸出。有研究顯示, 在陸架的沉積物中, 有40%~85%的有機碳可通過再懸浮, 重新被生物消耗(宋金明等, 2006)。這也部分解釋了黃東海區域盡管為碳匯區域但卻呈現異養狀態。
另外, 基于溶解氧測定的甲板暗培養法是目前獲取PCR的唯一實測方法, 但該方法會高估PCR。長期暗培養可能會改變優勢微型浮游生物群落晝夜節律; 瓶內培養可能會增加細菌豐度和物質分解速率等(Pomeroy, 1994; Sherr, 1999; Aranguren-Gassis, 2012; Huang, 2019)。因此本研究利用培養法評價東黃海海區生態系統營養狀態, 可能高估了海區的異養程度。
4 結論
本研究對南黃海和東海北部的浮游群落呼吸率進行測定, 得到一年間變化范圍為1.61~834.84 mg C/(m3·d), 平均(184.53±154.21) mg C/(m3·d), 其中夏季最高, 冬季最低, 季節之間差異性顯著, 不同水層之間的差異也較為顯著。此外, 浮游群落呼吸率與葉綠素濃度和浮游細菌豐度呈顯著正相關, 這說明浮游植物和浮游細菌是黃東海陸架生態系統的主要貢獻者。本研究得到黃東海陸架總體表現為異養-碳匯區域, 產生這種矛盾現象的原因可能為水體的分層作用、再懸浮的沉積有機碳利用。本研究闡明了黃東海陸架浮游生物呼吸率的時空變化格局, 解析了初級生產和群落呼吸等生物活動對黃東海陸架海區碳源匯格局和碳平衡的貢獻。進一步工作可以從浮游動物呼吸率的貢獻出發, 探討不同浮游生物成分對呼吸率的貢獻。
感謝中國海洋大學水文組江文勝、趙亮等老師提供溫度、鹽度和水深資料; 感謝自然資源部第二海洋研究所化學組提供航次營養鹽及溶解氧資料; 感謝中國海洋大學“東方紅2號”船長及全體船員在樣品采集過程中給予的幫助。
曲寶曉, 宋金明, 袁華茂, 等, 2013. 東海海—氣界面二氧化碳通量的季節變化與控制因素研究進展[J]. 地球科學進展, 28(7): 783-793.
孫躍, 沈陽, 戴鈴靈, 等, 2020. 夏冬季黃海浮游動物群落結構及其影響因素[J]. 中國海洋大學學報(自然科學版), 50(7): 82-93.
蘇紀蘭, 2005. 中國近海水文[M] //蘇紀蘭. 中國近海水文. 北京: 海洋出版社: 193-249.
李伯志, 2018. 中國近海營養鹽季節和年際變化特征分析[D]. 天津: 天津科技大學: 15-19.
宋金明, 曲寶曉, 李學剛, 等, 2018. 黃東海的碳源匯: 大氣交換、水體溶存與沉積物埋藏[J]. 中國科學: 地球科學, 48(11): 1444-1455.
宋金明, 徐亞巖, 張英, 等, 2006. 中國海洋生物地球化學過程研究的最新進展[J]. 海洋科學, 30(2): 69-77.
焦念志, 梁彥韜, 張永雨, 等, 2018. 中國海及鄰近區域碳庫與通量綜合分析[J]. 中國科學: 地球科學, 48(11): 1393-1421.
ARANGUREN-GASSIS M, TEIRA E, SERRET P,, 2012. Potential overestimation of bacterial respiration rates in oligotrophic plankton communities [J]. Marine Ecology Progress Series, 453: 1-10.
BIDDANDA B, OPSAHL S, BENNER R, 1994. Plankton respiration and carbon flux through bacterioplankton on the Louisiana shelf [J]. Limnology and Oceanography, 39(6): 1259-1275.
BORGES A V, 2005. Do we have enough pieces of the jigsaw to integrate CO2fluxes in the coastal ocean? [J]. Estuaries, 28(1): 3-27.
CALBET A, LANDRY M R, 2004. Phytoplankton growth, microzooplankton grazing, and carbon cycling in marine systems [J]. Limnology and Oceanography, 49(1): 51-57.
CHEN C C, CHIANG K P, GONG G C,, 2006. Importance of planktonic community respiration on the carbon balance of the East China Sea in summer [J]. Global Biogeochemical Cycles, 20(4): GB4001, doi: 10.1029/2005GB002647.
CHEN C C, SHIAH F K, GONG G C,, 2003. Planktonic community respiration in the East China Sea: importance of microbial consumption of organic carbon [J]. Deep Sea Research Part II: Topical Studies in Oceanography, 50(6/7): 1311-1325.
CHEN C T A, WANG S L, 1999. Carbon, alkalinity and nutrient budgets on the East China Sea continental shelf [J]. Journal of Geophysical Research: Oceans, 104(C9): 20675-20686.
CHOU W C, GONG G C, SHEU D D,, 2009. Reconciling the paradox that the heterotrophic waters of the East China Sea shelf act as a significant CO2sink during the summertime: Evidence and implications [J]. Geophysical Research Letters, 36(15): L15607, doi: 10.1029/ 2009GL038475.
DANERI G, DELLAROSSA V, QUI?ONES R,, 2000. Primary production and community respiration in the Humboldt Current System off Chile and associated oceanic areas [J]. Marine Ecology Progress Series, 197: 41-49.
DE HAAS H, VAN WEERING T C E, DE STIGTER H, 2002. Organic carbon in shelf seas: sinks or sources, processes and products [J]. Continental Shelf Research, 22(5): 691-717.
DEL GIORGIO P A, COLE J J, CIMBLERIS A, 1997. Respiration rates in bacteria exceed phytoplankton production in unproductive aquatic systems [J]. Nature, 385(6612): 148-151.
DUCKLOW H W, DONEY S C, 2013. What is the metabolic state of the oligotrophic ocean? A debate [J]. Annual Review of Marine Science, 5: 525-533.
GARCíA-MARTíN E E, DANIELS C J, DAVIDSON K,, 2019. Plankton community respiration and bacterial metabolism in a North Atlantic Shelf Sea during spring bloom development (April 2015) [J]. Progress in Oceanography, 177: 101873.
GATTUSO J P, FRANKIGNOULLE M, WOLLAST R, 1998. Carbon and carbonate metabolism in coastal aquatic ecosystems [J]. Annual Review of Ecology and Systematics, 29: 405-434.
GONG G C, SHIAH F K, LIU K K,, 2000. Spatial and temporal variation of chlorophyll, primary productivity and chemical hydrography in the southern East China Sea [J]. Continental Shelf Research, 20(4/5): 411-436.
GRIFFITH P C, POMEROY L R, 1995. Seasonal and spatial variations in pelagic community respiration on the southeastern U.S. continental shelf [J]. Continental Shelf Research, 15(7): 815-825.
HASHIMOTO S, HORIMOTO N, ISHIMARU T,, 2006. Metabolic balance of gross primary production and community respiration in Sagami Bay, Japan [J]. Marine Ecology Progress Series, 321: 31-40.
HOPKINSON JR C, 1985. Shallow-water benthic and pelagic metabolism: evidence of heterotrophy in the nearshore Georgia Bight [J]. Marine Biology, 87(1): 19-32.
HUANG Y B, CHEN B Z, HUANG B Q,, 2019. Potential overestimation of community respiration in the western Pacific boundary ocean: what causes the putative net heterotrophy in oligotrophic systems? [J]. Limnology and Oceanography, 64(5): 2202-2219.
KHATIWALA S, PRIMEAU F, HALL T, 2009. Reconstruction of the history of anthropogenic CO2concentrations in the ocean [J]. Nature, 462(7271): 346-349.
LIN S, HSIEH I J, HUANG K M,, 2002. Influence of the Yangtze River and grain size on the spatial variations of heavy metals and organic carbon in the East China Sea continental shelf sediments [J]. Chemical Geology, 182(2/3/4): 377-394.
LIU K K, ISEKI K, CHAO S Y, 2000. Continental margin carbon fluxes [M] // HANSON R B, DUCKLOW H W, FIELD J G. The Changing Ocean Carbon Cycle: A Midterm Synthesis of the Joint Global Ocean Flux Study. Canbridge, United Kindom: Cambridge University Press: 187-239.
MORAN M A, POMEROY L R, SHEPPARD E S,, 1991. Distribution of terrestrially derived dissolved organic matter on the southeastern U.S. continental shelf [J]. Limnology and Oceanography, 36(6): 1134-1149.
ODUM H T, 1956. Primary production in flowing waters[J]. Limnology and Oceanography, 1(2): 102-117.
POMEROY L R, SHELDON J E, SHELDON JR W M, 1994. Changes in bacterial numbers and leucine assimilation during estimations of microbial respiratory rates in seawater by the precision Winkler method [J]. Applied and Environmental Microbiology, 60(1): 328-332.
SHERR E B, SHERR B F, SIGMON C T, 1999. Activity of marine bacteria under incubated andconditions [J]. Aquatic Microbial Ecology, 20(3): 213-223.
SIGMAN D M, BOYLE E A, 2000. Glacial/interglacial variations in atmospheric carbon dioxide [J]. Nature, 407(6806): 859-869.
SMITH S V, HOLLIBAUGH J T, 1993. Coastal metabolism and the oceanic organic carbon balance [J]. Reviews of Geophysics, 31(1): 75-89.
SVERDRUP H U, JOHNSON M W, FLEMING R H, 1942. The earth and the ocean basins [M] // SVERDRUP H U, JOHNSON M W, FLEMING R H. The Oceans Their Physics, Chemistry, and General Biology. New York, USA: Prentice-Hall: 8-46.
WALSH J J, 1991. Importance of continental margins in the marine biogeochemical cycling of carbon and nitrogen [J]. Nature, 350(6313): 53-55.
WALSH J J, ROWE G T, IVERSON R L,, 1981. Biological export of shelf carbon is a sink of the global CO2cycle [J]. Nature, 291(5812): 196-201.
WANG S L, CHEN C T A, HONG G H,, 2000. Carbon dioxide and related parameters in the East China Sea [J]. Continental Shelf Research, 20(4/5): 525-544.
ZHANG Y F, LI D W, WANG K,, 2019. Contribution of biological effects to the carbon sources/sinks and the trophic status of the ecosystem in the Changjiang (Yangtze) river estuary plume in summer as indicated by net ecosystem production variations [J]. Water, 11(6): 1264.
THE IMPORTANCE OF PLANKTON COMMUNITY RESPIRATION RATE TO CARBON FLUX BALANCE IN THE YELLOW AND EAST CHINA SEA
YE Wen-Qi, LIU Cheng-Gang, CAI Yu-Ming, ZHAI Hong-Chang, LE Feng-Feng, WANG Bin, SHOU Lu, CHEN Quan-Zhen, DU Ping
(Key Laboratory of Marine Ecosystem Dynamics, Second Institute of Oceanography, Hangzhou 310012, China)
The Yellow Sea and East China Sea receive a large amount of nutrients and organic materials from the Changjiang (Yangtze) River dilution water and the Kuroshio, in which carbon cycle is very important to the carbon source and sink pattern of the continental shelf sea. Plankton community respiration is an important process that affects carbon cycle. To reveal the contribution of plankton community respiration rate (PCR) to the carbon balance in the Yellow Sea and the East China Sea, we used the black-and-white-bottle culture method to measure the plankton community respiration rate and primary productivity in the southern Yellow Sea and the northern East China Sea during the four seasons of 2011, and simultaneously measured the environmental factors such as temperature, salinity, nutrients, chlorophylland bacterial abundance. The results show that the plankton community respiration rate varied from 1.61 to 834.84 mg C/(m3·d), on annual average of (184.53±154.21) mg C/(m3·d), and the highest value occurred in the summer, while the lowest in the winter. According to the correlation analysis, the plankton community respiration rate, especially in summer, is mainly contributed from phytoplankton and bacterioplankton, and the plankton community respiration rate is significantly positively correlated with temperature, but significantly negatively correlated with salinity and silicate. Comparison between plankton community respiration rate and primary productivity shows that the studied area was heterotrophic but autotrophic in some surface layers. Studies on the exchange flux of sea-air CO2present that continental shelf regions of the Yellow Sea and East China Sea are mainly sinks of atmospheric CO2. However, why the Yellow and East China Sea ecosystems are heterotrophic in overall on one hand, and are sinks of atmospheric CO2on the other? The main reasons may be as follows: (1) the in-situ primary productivity in the studied area is low, and the organic carbon sources mainly depend on exogenous organic carbon or the re-suspension of surface sediments; (2) the CO2produced by the respiration of the plankton community is fixed in the subsurface water in the form of dissolved inorganic carbon. When an external force destroyed the structure of the water layer and forced the local water mixed, the fixed CO2could be released into the atmosphere, and become a carbon source of atmospheric CO2consequently.
plankton community respiration (PCR); continental shelf sea; carbon flux balance; the Yellow and East China Sea
P735; Q938; Q179.1; O613.71
10.11693/hyhz20210600139
*國家重點研發計劃資助, 2018YFD0900901號; 長江口-浙江近海-鄰近東海多學科長期觀測計劃, 14282號; 國家重點基礎研究發展計劃, 2010CB428903號; 國家海洋局青年科學基金, 2013140號; 自然資源部海洋生態監測與修復技術重點實驗室開放基金資助項目, MEMRT202106號; “全球變化與海氣相互作用”專項(II期)—長江口缺氧酸化預警監測。葉文琪, 碩士研究生, E-mail: 453276680@qq.com
杜 萍, 碩士生導師, 副研究員, E-mail: duping@sio.org.cn
2021-06-18,
2021-08-08

