腦靶向納米藥物遞釋系統研究進展
曹 意,蔣 晨
(復旦大學 藥學院, 上海 201203)
引言
中樞神經系統(central nervous system,CNS)相關疾病的發病率隨著人口老齡化而逐漸增加,然而相關治療技術的進展卻十分緩慢。一方面,是由于CNS相關疾病的發病機制尚未完全闡明;另一方面,則是由于跨越血腦屏障(blood-brain barrier, BBB)藥物遞送的復雜性:大腦中神經元信號傳遞均通過復雜的突觸連接網絡發生,其準確性在很大程度上依賴于腦內精細微環境的穩態,而BBB在這一環節中起著至關重要的作用。
BBB的內皮細胞間存在一系列的緊密連接(tight junctions, TJs)與黏附連接,因而與其他組織的內皮細胞相比,此處缺乏允許物質自由擴散的跨膜小孔,因而細胞間通透性明顯降低;該屏障的通透性受緊密連接和黏附連接等連接以及星形膠質細胞(astrocytes)、周細胞(pericytes)、血管內皮細胞(vascular endothelial cells)、神經元(neurons)、小膠質細胞(microglia)等幾種細胞的控制,TJs在腦內的表達明顯強于外周組織;同時,由于腦毛細血管被周細胞和星形膠質細胞包裹,內皮細胞之間存在高電阻,只有水、部分氣體及脂溶性化合物等小分子才能經被動擴散途徑穿越BBB,而具有高電荷、極性和親水性的大分子(如葡萄糖、氨基酸和大多數藥物)的運輸則必須經主動運輸途徑并依賴特定的跨膜轉運蛋白才能進入腦內。除了上述“物理屏障”,BBB還具有明顯高于外周組織的外排轉運蛋白、高度特化的神經血管單元及酶系,分別形成“運輸屏障”、“免疫屏障”和“代謝屏障”。上述因素均使藥物跨越BBB受到極大的限制,這也使腦靶向藥物遞送成為了一項極具挑戰性的工作。
為了有效地將藥物遞送入腦部,研究人員目前已經開發了多種策略,包括對藥物本身及其前藥進行化學修飾、暫時開放緊密連接、神經外科手術介入及NPs介導的藥物遞送等。然而,通過改變滲透壓、形成微泡及超聲波暫時開放緊密連接均存在較大風險:它們可能破壞BBB的完整性,并在開放緊密連接的過程中導致藥物與血液中其他分子及毒素非特異性地進入中樞神經系統。
相比上述侵入式治療手段,納米顆粒(nanoparticles,NPs)輔助跨越BBB的藥物傳遞是一種相對有效而又安全溫和的手段。第一種將藥物運送到腦部的NPs是六肽達拉精 (Tyr-D-Ala-Gly-Phe-Leu-Arg)[1]。發展至今,經NPs載體遞送的藥物已涵蓋肽[2]、蛋白質[3]、核酸[4]、抗體[5]、抗逆轉錄病毒藥物[6]等多個門類。總體而言,NPs給藥具有許多優點,主要包括無創、低成本,具有良好的生物降解性和長期穩定性,易于合成且靶向效率高,同時具有載藥和釋藥的高度可控性[7-8],因而在腦靶向藥物遞送領域具有令人興奮的應用前景。
理解腦靶向藥物遞送的關鍵點有兩個,一是剖析靶標(作用對象),二是操控藥物及對應載體(作用方式)。基于這一思路,下文即從BBB基本的生理結構出發,探討跨越BBB的難點;接著闡述NPs主要類型及自身特性,挖掘應用NPs進行腦部遞藥的可能途徑,并對用于腦靶向遞藥的NPs的主要類型及具體遞藥策略進行詳細的探討。
1 BBB基本結構及功能
BBB是大腦維持正常功能不可或缺的生理屏障,它能將腦內毛細血管與組織細胞有效分隔,并通過嚴格限制各類化合物進出、阻止有害化合物從血液入腦來維持CNS的穩態,而這一屏障功能與BBB的生理結構及其分子組成密切相關。BBB由內向外依次由腦內皮細胞、高度特化的基底膜、大量嵌入基底膜的周細胞、星形膠質細胞和小膠質細胞(圖中未標出)組成(圖1)。其中,內皮細胞為BBB的核心組成結構,其細胞連接可根據分子特征分為緊密連接和黏附連接兩種類型。BBB的結構完整性由黏附連接維持,它由血管內皮、鈣黏蛋白、肌動蛋白和連環蛋白組成。而BBB的主要功能則是由緊密連接維持的,它們主要負責通過BBB的滲透性。BBB的緊密連接主要由3種整合膜蛋白組成:封閉蛋白(occludin)、克勞丁(claudin)和連接黏附分子。除此之外,BBB 中還存在細胞質輔助蛋白,如封閉帶(zonula occludens, ZO1、ZO2、ZO3等)、扣帶蛋白(cingulin)等。成人的BBB 由復雜的蜂窩狀網絡組成,該系統的主要成分是腦內皮細胞、高度特化的基底膜、大量嵌入基底膜的周細胞和星形膠質細胞周足(圖 1)。星形膠質細胞可以通過多種方式調節 BBB 功能:(i) 通過強化緊密連接調節“物理屏障”;(ii) 通過轉運蛋白的表達和極化調節“運輸屏障”;(iii) 通過專門的酶系統調節“代謝屏障”。周細胞參與調節內皮細胞中BBB特異性基因的表達模式并誘導星形膠質細胞末端的極化。
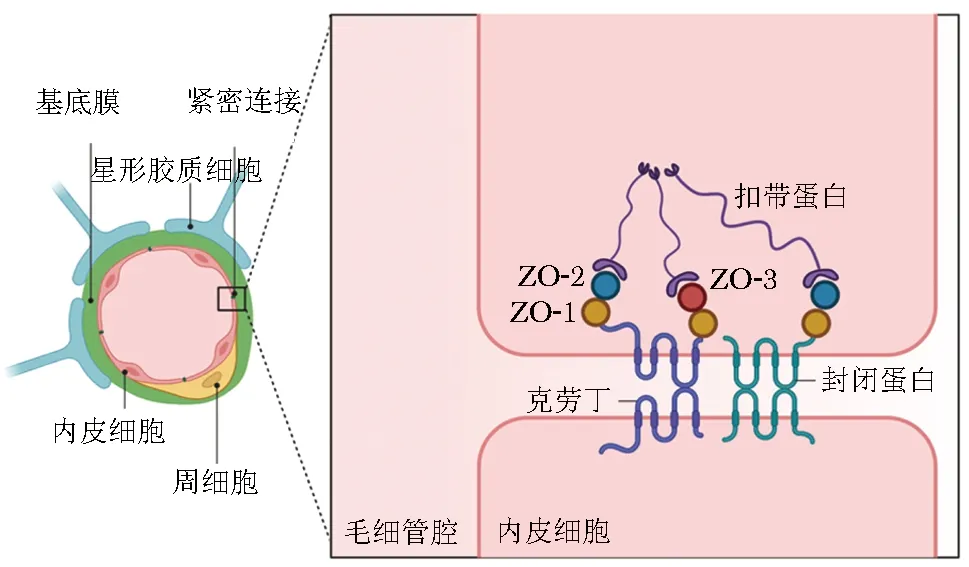
圖1 血腦屏障的組成及基本結構Fig 1 The composition and basic structure of blood-brain barrier
BBB在發揮正常生理功能、保護腦內微環境穩態的同時,也給靶向腦部的藥物遞送造成了困難。如上文所述,BBB內的各類細胞構成了多重實體屏障層,而它們又憑借其獨特的生理結構和分子組成,形成了一系列功能性屏障層:1)緊密連接、黏附鏈接、間隙連接通過減少離子和其他親水性溶質經細胞旁通路的滲透,形成“物理屏障”。2)在腦血管內皮細胞表面存在一系列膜轉運蛋白,參與腦部營養物質(包括葡萄糖和氨基酸)的運輸和代謝廢物的清除,ATP-盒式轉運蛋白(ATP-binding cassette)則介導許多潛在毒物(包括親脂性化合物)的主動外排,形成“運輸屏障”。囊泡主要通過吸附和受體介導的轉胞吞作用調節某些較大分子(包括肽和蛋白質)的轉移。載體和囊泡系統的結合有助于運輸屏障的功能行使。3)細胞內外酶的“代謝屏障”能進一步增強對腦部的保護水平,在運輸過程中及時代謝干擾性及毒性化合物。4)同時,內皮細胞和神經血管單元(neurovascular unit)的其他元素的特化還有助于調節血源性白細胞的流動,從而形成“免疫屏障”。上述多種屏障的存在使腦靶向藥物遞釋面臨嚴峻的挑戰,而NPs的出現和逐步發展則為跨越這些屏障帶來了巨大的機遇。
2 納米材料載體類型
NPs具有粒徑小、可改造性強的特征,有助于提高藥物生物利用度和穩定性,促進靶位的藥物濃集,減少外周毒素的釋放。同時,由于NPs在形狀、大小、疏水性、涂層、化學和表面電荷方面均具有高度的可調節性,基于上述特征的修飾與調控有助于進一步提升 NPs 的靶向性能,使其包載的藥物在血液循環過程中高度穩定,而達到藥物遞送區域時能夠精準、迅速釋放藥物;同時,NPs還有望進一步提高 BBB 的滲透效率,幫助遞藥系統逃離網狀內皮系統的監視[9-10]。目前用于腦靶向遞送系統的NPs可根據化學組成及結構分為3種主要的類型:聚合物型、仿生型和無機型。下文將就這3類NPs的結構及功能進行重點闡述。
2.1 聚合物型(polymeric-based)NPs
聚合物NPs在跨越BBB遞藥方面有較為明顯的優勢,它們通過靜電力或共價結合的方式與藥物相互作用,將藥物包裹于聚合物內核或鑲嵌于聚合物內部,從而增強藥物穩定性,延長藥物在體內循環時間,減少體內藥物的酶促和水解反應(即前面所述的“代謝屏障”),提高藥物的生物利用度[11]。最重要的是,利用恰當修飾的聚合物NPs包載藥物,可以促進藥物在腦部的靶向濃集[12]。聚(丙交酯-共-乙醇酸)(PLGA)、聚乙二醇(PEG)和聚乳酸(PLA)是3種常見的基于聚合物的載體[13]。其中,PLGA NPs具有低毒、高生物相容性和高度可控的藥物釋放等優點[14]。此外,PLGA NPs可以避免藥物溶解性不良和BBB非特異性吸收的問題。例如,Ghosh 等人已經證明了PLGA NPs 跨越 BBB的運輸用于治療神經膠質瘤的可行性,并且實現了理想的藥物溶解度和遞釋途徑特異性[15]。在其實驗中,一種針對生長抑素受體 2 (somatostatin receptor 2)的新型合成肽共價結合于PLGA NPs上,進一步提高了 NPs的轉運效率。結果表明,該系統有助于藥物進入膠質瘤內部并成功誘導細胞凋亡。PEG和PLA NPs具有優異的生物相容性,因而這類載體可以降低藥物的細胞毒性[16]。此外,可生物降解的PEG和PLA通常包覆在NPs表面作為“守門(gatekeeping)”層,從而實現藥物控釋。例如,Shen等人利用PLA作為活性氧(ROS)響應性“守門人(gatekeeper)”涂覆于介孔二氧化硅NPs表面,可以改善高氧化應激下的藥物釋放[13]。經多層PEG包載的藥物可以使NPs在腦部被動擴散,且PEG 具有較低的網狀內皮系統吸收,可以減慢 PEG NPs 的體內清除速率[17]。因此,PEG常用于修飾聚合物載體以增加它們在系統中的循環時間,并在腦部實現高效滲透和更高的積累。研究人員利用 PEG 的這些特性,嘗試在 Au NPs 表面用PEG進行修飾:PEG的生物穩定性和生物相容性使NPs能在生理條件下于較長時間段內在 BBB 兩側進行物質交換,從而促進藥物在腦內積聚。此外,在腦膠質瘤的治療層面,利用癌細胞對酸不穩定的特性,聚合物NPs還可以快速溶解于腦腫瘤細胞并在癌癥區域釋放藥物[18]。
盡管聚合物 NPs 在腦靶向藥物遞送中發揮了不可或缺的作用,但一些問題仍限制了其進一步發展,人們也迫切地尋找著相應的替代方案。目前亟待解決的問題主要與聚合物NPs的載藥性能有關:傳統的線性聚合物與BBB的相互作用位點相對較少,同時也缺乏特定的、大容量的載藥區。一些具有大比表面積的聚合物 NPs因能夠與藥物產生較強的吸附作用,在載藥方面具有獨特的優勢,因而逐漸被用于跨越 BBB 的藥物遞送。例如,樹枝狀聚合物是一種特殊的可拉伸聚合物,有助于人們精確控制其結構。與傳統的線性聚合物相比,大量可控的官能團均可結合于樹枝狀聚合物NPs表面[19],提高聚合物的生物相容性、BBB 穿透能力、信號響應性和腫瘤靶向特性。例如,利用4-[2-[[6-氨基-9-(N-乙基-β-d-呋喃糖胺基)-9H-2-嘌呤]氨基]乙基]苯丙酸鹽酸鹽(CGS) 可以激活A2A腺苷受體,暫時增加腦毛細血管內皮細胞之間的細胞間隙,從而使更多的NPs跨越BBB擴散到腦側。此外,研究表明,增加樹枝狀聚合物的生成有助于延長遞藥系統血液循環時間并增加其在腦部創傷區的積聚[20]。然而,這些載體的一個潛在缺點是,如果不將其與熒光染料結合,就無法監測大多數聚合物NPs在細胞中的位置。因此,聚合物NPs需要復雜的合成過程來連接熒光染料示蹤分子。近期,研究人員開發了一種基于聚[三苯胺-4-乙烯基-(P甲氧基-苯)] (TEB)的新型熒光聚合物NPs,避免了復雜的染料示蹤方法。此外,當用不同的配體(如轉鐵蛋白、乳鐵蛋白和脂蛋白)修飾這類NPs之后,可觀察到其穿透BBB的效果得到了明顯改善[21]。
2.2 仿生型(biomimetic-based)NPs
用于藥物遞送的NPs常具有外源性,這使其極易被免疫系統識別,進而激活下游的一系列免疫反應,并很快經肝腎清除。這也是導致部分NPs遞藥效果不甚理想的主要原因。因此,仿生 NPs遞藥系統的設計愈發受到關注。這類NPs可以準確識別并靶向配體,同時材料的仿生性給予其良好的生物穩定性,使其能長期參與血液循環且不易被降解[22]。例如,殼聚糖是一種典型的仿生型NPs材料,它通過部分脫乙酰作用從幾丁質中提取,具備良好的生物相容性、生物可降解性,能夠有效開放細胞緊密連接,同時僅有極小的免疫原性,這使得它被廣泛用于仿生藥物的載體[23]。此外,一些天然囊泡(由生物膜形成),如脂質體、外泌體、紅細胞膜或白細胞樣(leuko-like)包被的納米顆粒,作為重要的仿生納米顆粒在腦靶向藥物遞送領域也受到了很高的關注[24]。上述材料普遍具有磷脂雙分子層結構,而這也是其高生物相容性的關鍵。此外,多功能或自組裝蛋白質(如常用的轉鐵蛋白)也用于形成仿生納米囊泡用于藥物遞送[25]。基于蛋白修飾的納米材料也可增強細胞對藥物的吸收,并具有許多其他優點,例如無毒、可生物降解、無抗原性、易于表面修飾等[26]。這些特性使基于蛋白修飾的NPs有潛力突破目前NPs遞藥系統的局限:利用特定功能的蛋白或多肽對仿生NPs進行修飾,有助于進一步提升遞藥系統的靶向特異性,增強治療效果,為目前經靜脈注射仍無法穿透 BBB 的藥物遞送帶來轉機[27]。除了用蛋白修飾NPs,病毒樣 NPs(VLPs)是一種經幾類病毒自組裝形成的非感染性衣殼蛋白 NPs,已被作為疫苗和藥物遞送候選物[28]。在此情形下,衣殼蛋白為封裝于其中的藥物提供了“特洛伊木馬(Trojan horse)”策略。Anand等人將工程化VLPs(作為納米載體)用于跨BBB轉運,他們選擇鼠傷寒沙門氏菌噬菌體P22衣殼作為前體,將鎮痛海螺肽齊考諾肽轉運到體外,通過內吞策略成功跨越了BBB 模型[29]。
2.3 無機型(inorganic-based)NPs
無機NPs具有很高的穩定性,通過控制材料和尺寸還能靈活調節其物理化學特性,使它在腦靶向藥物遞送方面有相對于聚合物和仿生NPs的獨特優勢[30]。如今,具有不同結構的多功能無機基納米顆粒已得到了廣泛的研究[31]。人們可以較為簡便地使用聚合物或特定配體修飾基于無機材料的NPs,以促進藥物跨越BBB。二氧化硅納米粒子(Si NPs)成本相對較低,生物相容性好,質量可控[32],已被美國食品和藥物管理局(FDA)批準為食品添加劑[33]。研究人員用乳鐵蛋白(Lf)修飾Si NPs并研究其在BBB模型中的粒徑依賴性遞送效率[34],同時將PEG結合在Si NPs表面用于減少蛋白質吸附。與裸露的Si NP 相比,這種Lf修飾的Si NP提高了藥物穿透BBB的效率,其中,直徑為25 nm的NPs具有最高的傳輸效率,幾乎是裸露Si NPs的4倍[35]。介孔Si NPs(mesoporous silica nanoparticles,MSN)作為多孔硅基材料,也廣泛用于藥物遞送系統:它們不僅沿襲了傳統Si NPs優良的生物相容性,而且還具有高比表面積[36],例如,Kuang等人研究了一種基于MSN的藥物遞送系統,用于神經膠質瘤的治療[37]。金納米材料是另一種可用于藥物遞送且具有巨大潛力的無機材料:作為理想的光熱療法候選材料,一些特殊的 Au NPs可以很好地吸收近紅外波段(NIR)的激光,從而在NIR的照射條件下將光能充分轉化為熱能,通過病灶局部放熱達到相應的治療效果。Yin 等人使用基于Au的NPs來分離纖維狀Aβ(阿爾茨海默病的關鍵因素之一)[38],結果表明,基于Au的NPs在NIR照射下能夠有效解離Aβ原纖維。此外,銀和二氧化鈦NPs也可被用于穿過BBB[39]。
3 腦靶向遞藥策略
3.1 細胞旁通路(paracellular pathway)和被動跨膜擴散
內皮細胞之間的緊密連接嚴重限制了親水性分子的細胞旁通路。因此,大多數分子必須通過跨細胞途徑才能穿過BBB。 然而,只有分子質量低于400 u且氫鍵少于 8 個的小親脂性分子或小氣體分子(如 CO2或O2)才能通過跨膜擴散自由擴散通過BBB。此外,BBB內皮細胞的胞飲作用較弱,進一步抑制了分子向腦部的轉運。由于小粒徑和親脂性在參與血液循環及腦部運輸的物質中均相對少見,目前已知的經該轉運機制運輸入腦的物質并不多,這也限制了經該途徑介導的腦靶向遞藥系統的設計和發展。
3.2 吸附作用介導的轉胞吞作用(adsorptive-mediated transcytosis,AMT)
AMT由帶正電配體與帶負電細胞膜之間的靜電相互作用引發,經依賴網格蛋白(clathrin)的內吞作用介導,從血液單向轉運入腦。吸附作用介導的轉胞吞作用的起始步驟是通過內吞作用攝取 NPs。細胞的內吞作用分兩步進行:第一步,使NPs粘附于細胞膜上;第二步,通過主動耗能途徑將NPs轉運至細胞內。由此可見,NPs對細胞的粘附是胞吞作用順利進行的前提,即細胞攝取水平受NPs與細胞膜之間初始親和力的影響。在生理環境中,由于質膜上含唾液酸的糖蛋白的羧基和硫酸乙酰肝素蛋白聚糖的硫酸基呈極化分布,腦內皮細胞內外表面帶有負電荷。由于靜電相互作用,一些陽離子分子(如陽離子化白蛋白和麥胚凝集素)可能對內皮細胞表面的陰離子位點具有相對強的結合親和力。基于此,人們設計和開發了各種藥物遞送系統,通過與表面帶陽離子的分子(如殼聚糖[40])和白蛋白[41-42]結合,或以帶陽離子的聚合物為核心[43-44]負載各種藥物,從而使藥物轉運入腦。一些陽離子分子如細胞穿膜肽(cell-penetrating peptide, CPP)[45]和單克隆抗體[40]不僅可以使聚合物帶正電荷,同時還可以產生其他功效,參與其他跨 BBB 的轉運過程。聚(丙烯亞胺)(PPI)和聚(乙烯亞胺)(PEI)是陽離子聚合物的兩個例子,它們能夠通過離子相互作用來縮合核酸,還能夠利用質子緩沖能力從內體(endosomes)中逃逸,從而有效地將基因遞送入細胞核[43]。上述藥物載體的內吞作用即是通過 AMT 完成的。
除了考慮陽離子聚合物核心結構,還可以將一些帶正電荷的多糖對聚合物進行修飾,從而增強 AMT 過程,提高藥物穿透BBB的效率。未經修飾的兩親性聚合物中陰離子 PEG 層的屏蔽作用可能會削弱該系統穿透BBB的效果。因而,通過包裹低聚糖層有利于解除上述屏蔽作用,提升這類聚合物跨越 BBB 的能力[43]。研究表明,麥芽糊精NPs能夠在內吞作用的早期階段與細胞膜的陰離子位點結合,并通過膽固醇依賴的胞吐作用過程成功穿透BBB[46]。另一種多糖——殼聚糖也可用于增加與細胞表面的靜電相互作用。殼聚糖具有良好的生物相容性、可降解性及低毒性,它具有較強的細胞旁路通透性和黏膜粘附能力,最重要的是,它具備聚陽離子性質,是一種極具前景的載藥基質[40]。同樣,陽離子化白蛋白是細胞增殖的重要營養來源,可以制備為陽離子化白蛋白NPs[47]或用作構建NPs球殼表面的材料[41,48-49],以提高細胞攝取和內皮跨越效率[49-50]。表1 列舉了可用于基于AMT的藥物遞送系統的主要NPs。
此外,在開發穿越BBB的載體時,我們不能僅考慮藥物遞送系統的zeta電位,藥物載體的脂溶性也是增強AMT的重要因素,因為內皮的脂質膜結構為脂溶性藥物提供了有效擴散途徑[51]。基于此,固態脂質NPs(solid lipid nanoparticles,SLNs)[50]由于其具有良好的脂溶性以及可攜帶陽離子的表面,同時又具有良好的生物相容性、降解性及低毒性,并擁有更小的粒徑,使其已被廣泛用于穿越 BBB的遞藥系統。研究表明,在SLNs表面修飾牛血清白蛋白陽離子后,藥物攝取和遞送的速度能夠提高至與載體介導及受體介導的遞藥策略相近的水平[50]。
然而,表面帶正電荷的NPs在很多情況下并不適用于跨越 BBB 的藥物遞送系統:陽離子與細胞正常的生物膜表面相互作用時,可能對其產生一定的損傷,從而產生比中性表面更高的細胞毒性[41,55]。考慮到藥物本身具有相對較高的細胞毒性,正電荷納米顆粒的毒性可能是由較高的細胞攝取量和載體中的藥物釋放所致。除此之外,AMT的靜電相互作用是非特異性的,NPs可能會在體內隨機分布并極易被其他網狀內皮系統(如肺和肝臟)識別并捕獲,導致藥物在腦部的積累量降低,同時還易加劇對外周的毒副作用。同時,與受體介導的藥物遞送系統相比,AMT中納米顆粒與細胞膜的親和力也相對較低,這也是其在藥物遞送效率和特異性方面的局限性所在。
3.3 載體介導的轉胞吞作用(carrier-mediated transcytosis,CMT)
CMT也是腦內最常見的物質運輸機制之一。機體為了保證能將特定分子(如營養物質或氨基酸)轉運到大腦,在腦內皮細胞的腔內和基底外側均有相關的特異性轉運蛋白表達。根據BBB中的轉運體轉運的方向及底物的差異,大致可將CMT分為3類轉運模式:1)從血液入腦的泵入系統(influx transport system),該系統參與腦部必需營養物質的運輸,包括葡萄糖、氨基酸和核苷酸;2)藥物外排泵(efflux pump),該系統將外源性物質泵出到循環血液,防止它們進入大腦;3)從腦部入血的外排系統(efflux transport system),該系統主要用于清除腦間質液中的代謝廢物和神經毒性化合物。這些系統通過協調運行,共同發揮支持、保護 CNS的作用。其中,泵入系統能為腦靶向藥物的遞送創造機遇:首先,通過模擬對轉運蛋白具有高親和力的營養類似物,明確所要設計及合成的新分子的結構;然后,將這些分子設計為結合在藥物載體表面的高親和力配體,進而操控載體介導的胞吞作用,實現 BBB的跨越。 然而,這種方法高度依賴于精細設計的藥物結構,簡單地將藥物與另一種營養類似物分子偶聯并不能直接引發載體介導的胞吞作用。有研究經己糖相關轉運蛋白介導的途徑,成功實現藥物對 BBB 的跨越,從而引起了人們的關注。表2列出了使用載體介導的胞吞作用設計的藥物遞送系統。
葡萄糖是哺乳動物大腦代謝的主要能量來源,可經葡萄糖轉運蛋白(glucose transporter,GLUT) 跨越BBB。葡萄糖不能由大腦神經元直接合成,而大腦卻會消耗大量的葡萄糖(約占全身的 30%)[71]。為了確保腦部能量供應,BBB處葡萄糖轉運蛋白的密度相對較高,GLUT1在BBB的內皮細胞中以糖基化形式高度表達[72]。前面提到,通過己糖轉運蛋白穿越BBB具有可行性:研究人員將對氨基苯基-α-D-吡喃甘露糖苷(葡萄糖衍生物)[57-58]結合于脂質體表面, 從而探究其跨越BBB的潛力。結果表明,細胞攝取在C6神經膠質瘤細胞和GLUT1及GLUT3過表達細胞中得到增強[57]。盡管經CMT遞送的藥物分子量一般不大,但也有研究發現,分子量相對較大的葡萄糖衍生物仍然能夠穿過血腦屏障。Wu等[61-63]合成了一系列膽固醇的糖基衍生物, 使葡萄糖和膽固醇側鏈與PEG骨架結合。這些衍生物作為脂質材料形成用于腦靶向的脂質體藥物遞送系統,都顯示出增強跨內皮能力的潛力。其中,中等鏈長的PEG衍生物具有最強的大腦遞送能力。

表1 基于AMT的納米材料給藥系統Table 1 AMT-based NPs drug delivery systems

表2 基于CMT的納米材料給藥系統及其對BBB和腦部的影響Table 2 CMT-based NPs drug delivery systems
另一個載體介導轉運的例子是苯丙氨酸經1型大型中性氨基酸轉運蛋白 (large neutral amino-acid transporter type 1,LAT1) 的轉運。LAT1在BBB的管腔和離體膜側豐富且選擇性表達,顯示出比外周組織更高的底物親和力,并在膠質母細胞瘤細胞中過表達。上述特性均可指導LAT1 介導的靶向藥物遞釋系統的設計,NPs表面用LAT1特異性配體進行修飾,有助于藥物在腦部及神經膠質瘤部位的積聚。此外,運輸短鏈單羧酸(如乙酸)的單羧酸轉運系統(monocarboxylic acid transport system,MCT)對于腦內代謝也至關重要。MCT1是一種乳酸和其他單羧酸化合物的雙向轉運蛋白,在腦毛細血管內皮細胞的管腔和管腔外膜上均得到鑒定。目前已有許多關于操縱這些載體以設計跨越BBB的新型藥物載體研究。氨基酸及其衍生物,如苯丙氨酸和色氨酸衍生物及谷胱甘肽結合于SLNs[65]、Pluronic F127共聚物NPs[64]和PLGA NPs[66-68]表面,分別用于研究 BBB 通透性和腦部積累。β-羥基丁酸修飾[69]和乳酸修飾[70]SLNs也得以研發。與空白NPs相比,修飾后的NPs都具有更高的BBB 滲透率,并且在大腦中有更高的積累。
然而,當存在兩種或多種營養素或其類似物時,營養物與其相應的類似物產生競爭效應,可能會影響藥物經該運輸途徑的效率。例如,將2-脫氧-d-葡萄糖結合在聚乙二醇-共聚三亞甲基碳酸酯NPs(D-Glu NPs)上后,該遞藥系統呈現出良好的 BBB 穿透能力,并能在神經膠質瘤細胞中積聚;然而,隨著葡萄糖濃度的升高,體外模型中藥物的轉運率和 D-Glu NPs的細胞攝取量均明顯降低[56]。
3.4 受體介導的轉胞吞作用(receptor-mediated transcytosis,RMT)
相比上文介紹的AMT, RMT對結合部位的特異性和親和力都更強。這是由于經RMT介導的相互作用都具有高度選擇性的靶標,這也就意味著配體和受體之間將具有更高的特異性和結合親和力。RMT 始于配體與其受體的結合,接著是受體介導的內吞作用,使得配體偶聯的藥物載體能夠進入細胞內部或跨細胞入腦。與AMT不同,RMT遞送系統的表面無需帶有正電荷,甚至可帶中性或負電荷,從而避免了陽離子給細胞帶來的巨大毒性。表3總結了基于 RMT 的NPs給藥系統。

表3 基于 RMT 的納米材料給藥系統Table 3 RMT-based NPs drug delivery systems
根據配體類型和應用場景的不同,可將RMT的受體分為多個類別,如轉鐵蛋白(Tf)受體[53,82]、乳鐵蛋白(Lf)受體[77]、胰島素受體[81]、白蛋白結合蛋白[83]、低密度脂蛋白受體[78]和αvβ3和 αvβ5整聯蛋白[79]。其中, Tf受體是一種跨膜糖蛋白, 負責通過Tf的胞內和胞吐作用攝取鐵,在毛細血管內皮的腔膜中廣泛表達[82],在大腦的內皮細胞、上皮細胞、神經元和神經膠質細胞中均有分布[84]。基于此,轉鐵蛋白和轉鐵蛋白受體單克隆抗體(如 OX26、R17217 和 8D377)是最常用于穿過 BBB 的藥物遞送載體的配體。轉鐵蛋白相關配體可與各種載藥基質結合,例如人血清白蛋白納米顆粒74、聚乙二醇化脂質體75、聚乳酸 (PLA)-D-PEG83和PLGA[76]。這些載體均使得藥物獲得了更強的BBB穿透能力和更快的運輸速度。然而,由于游離Tf也遵循RMT機制,藥物遞送過程將受到其競爭性抑制[82]。同時,Tf 受體并非單向跨越,它具備雙向調節的機制。在腦部內皮細胞外膜上的 Tf 受體可以作為大腦中鐵吸收和清除的“儲庫”和“調節器”,通過感知腦內鐵濃度并調節管腔膜上 Tf 受體的表達及再循環率,從而相應地增減血液中鐵-Tf的攝取[85]。當腦內鐵濃度較高時,將對經Tf受體轉運入腦的藥物遞送產生較強的抑制,甚至導致已入腦的藥物反向泵出。
Lf是一種鐵結合糖蛋白,是轉鐵蛋白家族的成員,也可用作轉鐵蛋白受體介導的轉胞吞作用的配體[77]。與雙向運輸的Tf相比,Lf為單向運輸,因而在藥物遞送方面可能更具優勢。當與PEG結合的磁性納米顆粒被Lf官能團化后注射到大鼠的血液中,在大腦中實現了更高對比度的血管磁共振成像,體現出Lf-Fe3O4NPs通過Lf受體介導途徑穿過BBB的能力[77]。另外,胰島素調節大腦中的葡萄糖代謝,其受體在腦血管內皮細胞表面也有大量分布[86]。Pardridge等報道,與使用轉鐵蛋白受體的配體相比,使用胰島素受體的配體具有更高的轉運功效[87];然而Ulbrich等在比較負載胰島素受體的人血清白蛋白NPs和轉鐵蛋白修飾的NPs或抗轉鐵蛋白受體單克隆抗體時,發現轉運功效沒有顯著差異[81]。
盡管RMT具有特異性和高親和力,但藥物載體仍有可能與外周器官受體結合,造成不良反應。例如,與低分子量魚精蛋白結合的白蛋白NPs的目標靶向為膠質瘤和腫瘤血管內皮的白蛋白結合蛋白(例如 SPARC 和 gp60)。然而,在其他網狀內皮系統(如肺和肝臟)也能夠檢測到這種白蛋白標記的結合[83]。
此外,在藥物載體系統中同時使用AMT和RMT對BBB的滲透性具有協同作用。例如,基于Pluronic的納米載體[54]即被用于研究這種協同效應,用聚陽離子分子殼聚糖修飾來促進AMT,同時用狂犬病病毒糖蛋白RVG29(一種細胞穿膜肽,同時也是煙堿型乙酰膽堿受體的配體)對NPs表面進行修飾,并與單獨配體修飾的組別進行對照,結果表明,帶有RVG29和殼聚糖的納米載體對BBB的滲透性最高,并滲透到大腦中[54]。
4 展望
目前涉及腦靶向納米藥物的臨床試驗已在廣泛進行,基于NPs的給藥系統領域目前已接近臨床應用階段。盡管近幾十年來腦靶向NPs逐漸被人們接受并且取得了一系列技術突破,但靶向部位的局限性、較低的穿透效率、對BBB造成潛在損傷等問題,仍使NPs的進一步推廣受到限制。研究人員正在提出多種策略,以期進一步提升腦靶向NPs遞藥系統的性能,主要包括以下方向:
多功能(multifunctional)NPs:為了應對生理、病理過程與藥物復雜的相互作用所帶來的挑戰,NPs的設計與構架已經歷了一系列革新。然而,一類NPs可以解決一種遞送障礙,但卻難以解決遞送全過程中的多重困難。例如,用于腦膠質瘤治療的藥物遞送NPs,各步驟中的體積和表面特性(包括全身轉運、腫瘤定位、細胞攝取和有效藥物釋放)很多時候不能同時滿足,甚至是相互矛盾的[88]。因而,通過對NPs表面進行多重修飾,使其在不同階段、不同部位發生特異性響應,有助于解決多過程中面臨的問題,從而使NPs實現更強的特異性及更高的遞藥效率。有研究基于谷胱甘肽響應自發熒光納米凝膠、樹枝狀大分子介孔二氧化硅NPs和金NPs的組合,開發了一種可追蹤與細胞內微環境響應的藥物遞送系統的光。這類新型雜交(hybrid)NPs遞藥系統,可以在各個階段有效地運載、控制含巰基藥物進入神經元的釋放,并為未來的腦疾病治療提供光示蹤(light-traceable)監測[89]。此外,有研究將聚合物和蛋白質結合設計NPs遞藥系統,并指出由多個內部隔室組成的新型聚合物/蛋白質混合NPs有潛力成為基于納米藥物的聯合療法中極具吸引力的候選材料[90]。這種方法結合了合成 NPs的多功能性和靶向能力,同時還獲得了蛋白質在內皮網狀系統器官中優異的循環能力和高度的生物相容性,同時還能通過基因工程靈活調整氨基酸序列,從而增加NPs的可調節性。
基于病理變化的NPs設計:上述NPs腦靶向遞藥策略利用腦組織和外周生理結構、理化性質的區別,靶向腦部特異的載體、受體等結構,從而增強藥物的穩定性和對腦部的靶向特異性。與此同時,腦部疾病的發生、發展過程中存在一系列和正常腦組織明顯不同的病理特征。例如,神經退行性疾病(阿爾茨海默病、帕金森病、亨廷頓病和肌萎縮側索硬化癥)的特征是中樞神經系統不同區域的神經元逐漸喪失。 神經元細胞的死亡會導致認知、行為、感覺及運動功能等障礙。神經退行性疾病可由多種因素引起,如錯誤折疊蛋白的積累、內源性抗氧化酶活性的降低、線粒體功能障礙、腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)的缺乏、神經炎性反應以及各種遺傳因素突變[91]。因而,進一步深入理解具體腦部疾病的發病機制和病理學特征,充分利用這類特征來定制靶向腦部病灶的NPs,將有助于減少對正常BBB的損傷,進一步提升腦靶向NPs的特異性,開發靶向腦部受損區域的新型NPs 制劑[12]。
除此之外,近期研究還開發了一系列新型NPs,可能在未來進一步促進腦靶向遞藥系統的發展,包括 (i) 含抗氧化劑和 omega-3 脂肪酸的脂質納米載體[92]; (ii) 提供持續控釋的多孔聚合物納米顆粒[93]; (iii) 神經營養基因的非病毒基因載體[94]; (iv) 用于個性化醫療(personalized medicine)的診療納米載體[95]。 通過進一步探究血腦屏障、腦部疾病的特征及各類NPs的藥理特性,相信在未來,腦靶向藥物遞送系統能得到更長足的發展,從而真正達到投入臨床使用的要求,為患者帶來福音。

