人源解旋酶樣轉(zhuǎn)錄因子的表達、純化和功能研究
龔曉昕,沈苗苗,李徐梓超,向嵩
(天津醫(yī)科大學基礎(chǔ)醫(yī)學院生物化學與分子生物學系,天津 300070)
準確而順利的DNA復制對于細胞生存至關(guān)重要。大量的外源性和內(nèi)源性因素,例如核苷酸耗竭、DNA二級結(jié)構(gòu)、蛋白質(zhì)-DNA復合物、DNA堿基損傷等都會對DNA復制造成壓力,從而導致復制停滯[1-2]。停滯的復制叉是一種非常不穩(wěn)定的DNA結(jié)構(gòu),容易導致DNA雙鏈斷裂和核溶解,從而導致基因組不穩(wěn)定,最終造成細胞死亡[3-4]。細胞進化出復雜的機制來應對這些復制壓力。其中,高度保守的真核生物DNA損傷耐受通路(DNA damage tolerance,DDT)通過易出錯的跨損傷合成(translesionsynthesis,TLS)和無錯誤的模板轉(zhuǎn)換DNA合成(template switch,TS)兩條分支來恢復被中斷的DNA復制[5-6]。解旋酶樣轉(zhuǎn)錄因子(helicase-like transcription factor,HLTF)在人類細胞的DDT通路中起到關(guān)鍵作用。DDT中TLS分支與TS分支都是通過將增殖細胞核抗原(proliferating cell nuclear antigen,PCNA)高度保守的Lys164泛素化修飾而啟動的。泛素連接酶Rad18和泛素結(jié)合酶Rad6將該殘基單泛素化修飾,啟動TLS分支[7]。HLTF具有泛素連接酶活性,它可進一步使用Lys63相連接的泛素鏈標記PCNA,啟動無錯誤的TS分支。這一反應以單泛素化的PCNA為底物,還需要泛素結(jié)合酶復合物Ubc13-Mms2的共同參與[8-10]。除此之外,HLTF還能通過催化ATP水解驅(qū)動復制叉退行[11]。在停滯的復制叉處,TS分支可通過復制叉退行實現(xiàn);復制叉退行也能保護停滯的復制叉[2,12-13]。與HLTF在DNA復制壓力應對中的關(guān)鍵功能一致,研究發(fā)現(xiàn)HLTF與早衰、神經(jīng)系統(tǒng)疾病及多種癌癥密切相關(guān)[1,14]。
HLTF的分子量為114 kD,是一個較為復雜的多結(jié)構(gòu)域蛋白。它由HIRAN結(jié)構(gòu)域、Snf2家族的DNA解旋酶結(jié)構(gòu)域(Snf2結(jié)構(gòu)域)和嵌在其中的RING結(jié)構(gòu)域構(gòu)成。Snf2結(jié)構(gòu)域驅(qū)動復制叉退行;RING結(jié)構(gòu)域編碼泛素連接酶活性;HIRAN結(jié)構(gòu)域在復制叉退行中發(fā)揮關(guān)鍵作用[8,13,15-17]。本課題組近期對HLTF的酵母同源蛋白Rad5的結(jié)構(gòu)和功能研究為理解HLTF的功能機制提供了線索[18]。本研究表明,HLTF與Rad5催化差異巨大的PCNA的泛素化修飾及復制叉退行。因此,迫切需要對HLTF本身的結(jié)構(gòu)和功能研究以理解它在人體細胞的DNA復制壓力應對中發(fā)揮作用的機制。制備大量、高純度且正確折疊的HLTF對該研究至關(guān)重要。雖然已有研究人員利用酵母表達系統(tǒng)表達并純化HLTF[8],但該表達系統(tǒng)操作較為繁瑣,蛋白產(chǎn)量也較為有限。與酵母表達系統(tǒng)相比,細菌表達系統(tǒng)通常耗時更短、蛋白產(chǎn)量更高。然而高等真核生物與細菌之間存在密碼子偏好性差異,可能會阻礙高等真核生物蛋白在細菌中的表達。這些物種細胞中蛋白折疊環(huán)境的差異,也可能導致在細菌中表達的高等真核生物蛋白不能正確折疊[19-21]。本課題組在前期研究中發(fā)現(xiàn),通過優(yōu)化HLTF基因的密碼子偏好性能夠在大腸桿菌表達系統(tǒng)中表達HLTF[18]。本研究優(yōu)化了HLTF的表達和純化方式,獲得了大量高純度的HLTF。體外實驗結(jié)果發(fā)現(xiàn),重組HLTF具有完整的生化活性,提示它是正確折疊的。另外,結(jié)果發(fā)現(xiàn)HLTF在發(fā)揮泛素連接酶活性時對底物PCNA與泛素的連接方式不敏感。本研究提供了一種高效制備大量、高純度且折疊正確HLTF的方法,并為深入理解其泛素連接酶活性提供了線索,為HLTF的進一步研究奠定了基礎(chǔ)。
1 材料和方法
1.1 蛋白表達和純化本研究對本課題組之前報道的HLTF的表達和純化方法進行了優(yōu)化[18]。HLTF基因的密碼子偏好性優(yōu)化有利于其在大腸桿菌中表達,由化學方法合成(生工生物技術(shù))。HLTF的氨基酸殘基46-1013對應的基因片段插入pET28a載體(Novagen),構(gòu)建HLTF的表達質(zhì)粒。將質(zhì)粒轉(zhuǎn)化大腸桿菌BL21 Rosetta(DE3)感受態(tài)細胞,在添加34 mg/L卡那霉素和25 mg/L氯霉素的LB培養(yǎng)基中培養(yǎng),用終濃度為0.25 mmol/L的異丙基-β-D-硫代半乳糖苷(Bio Basic)在16℃誘導14 h。收集的細胞重懸在含有20 mmol/L Tris(pH 7.5)、300 mmol/L NaCl、10 mmol/L苯甲基磺酰氟和2 mmol/Lβ-巰基乙醇的緩沖液中,每克細胞使用50 mL緩沖液重懸,冷卻到4℃,以50 mL/min的流速通過AH-2010高壓破碎儀(ATS Engineering),破碎壓力設(shè)為900磅每平方英尺。經(jīng)過3次破碎循環(huán)后,細胞裂解液經(jīng)過15 000×g離心50 min,上清部分經(jīng)過鎳-次氮基三乙酸純化瓊脂糖樹脂(nickel-nitrilotriacetic acid,Ni-NTA,Smart-Lifesciences)、DEAE柱(Hitrap DEAE HP,GE Healthcare)、SP柱(Hitrap SP HP,GE Healthcare)和分子篩柱(Superose 6 10/300,GE Health care)依次純化,得到純度大于95%的HLTF蛋白。
從人乳腺癌MDA-MB-231細胞的cDNA文庫(天津醫(yī)科大學于林教授贈送)中擴增出泛素、PCNA的基因;從人乳腺癌T-47D細胞的cDNA文庫(天津醫(yī)科大學于林教授贈送)中擴增出Mms2基因。Ubc13基因密碼子優(yōu)化為利于在大腸桿菌中表達(生工生物技術(shù))。將泛素基因插入pET28a載體;將Mms2基因插入pTYb2載體(New England Biolabs);將Ubc13基因插入pTXb1載體(New England Biolabs),構(gòu)建表達質(zhì)粒。將FLAG肽段寡核苷酸序列、泛素基因、連接肽段(VQIPGK)核苷酸序列和PCNA基因插入pET28a載體,構(gòu)建His-FLAG-泛素-PCNA融合蛋白表達質(zhì)粒。上述重組蛋白均在大腸桿菌BL21 Rosetta(DE3)細胞中表達。泛素和His-FLAG-泛素-PCNA融合蛋白均用Ni-NTA和分子篩柱純化(泛素蛋白用Superdex 75 Increase 10/300,His-FLAG-泛素-PCNA融合蛋白用Superdex 200 Increase 10/300,均來自GE Healthcare)。Mms2和Ubc13用幾丁質(zhì)樹脂(New England Biolabs)和分子篩柱(Superdex 75 Increase 10/300)進行純化。
所有蛋白質(zhì)在含有20 mmol/L Tris(pH 7.5)、200 mmol/L NaCl和2 mmol/L二硫蘇糖醇的緩沖液中,用液氮速凍后保存在-80℃。
1.2 ATP酶活性實驗ATP酶活性實驗中使用的雙鏈DNA是通過將互補寡核苷酸(ACCAGTGCCAGTGAT和ATCACTGGCACTGGT,生工生物技術(shù)合成)加熱至95℃,隨后緩慢冷卻至4℃生成。實驗采用丙酮酸激酶和乳酸脫氫酶耦聯(lián)反應,通過監(jiān)測NADH減少來測定ATP酶活性[22]。利用ultraspec 2100 pro分光光度計(GE Healthcare)來監(jiān)測NADH在340 nm處吸收值的變化。反應體系包括2.5μmol/L HLTF、40 mmol/L Tris(pH 7.5)、50 mmol/L NaCl、0.5 mmol/L ATP(Sigma)、1 mmol/L磷酸烯醇式丙酮酸(Sigma)、0.2 g/L NADH(Sigma)、80單位/mL丙酮酸激酶(源葉生物)、100單位/mL乳酸脫氫酶(源葉生物)、10 mmol/L MgCl2和不同濃度的雙鏈DNA。每次實驗重復3次,數(shù)據(jù)用QTIPLOT分析(www.qtiplot.com)。
1.3 HLTF促進自由泛素鏈的形成實驗反應體系包括20 mmol/L Tris(pH7.5)、50 mmol/L NaCl、10 mmol/L MgCl2、1 mmol/L ATP(Sigma)、0.02 mg/mL BSA、1 mmol/L DTT、33 nmol/L人源泛素激活酶(UBE1,R&D Systems)、667 nmol/L Ubc13、667 nmol/L Mms2、33μmol/L泛素和233 nmol/L HLTF。需要時,將單鏈DNA(序列為TTTTTTTCGTCTTCGGCAATTTTTTT,生工生物技術(shù)合成)或雙鏈DNA(與ATP酶活性實驗相同)加入反應體系中,終濃度為6.7μmol/L。
30℃孵育12 min后,加入SDS-PAGE上樣緩沖液[20 mmol/L Tris-HCl(pH 6.8),40 mmol/L DTT,0.8%SDS,0.02%溴酚藍,4%甘油]煮沸終止反應。通過SDS-PAGE分析反應結(jié)果。
1.4 HLTF催化PCNA的泛素鏈標記實驗反應體系包括40 mmol/L Tris(pH7.5)、50 mmol/L NaCl、10 mmol/L MgCl2、1 mmol/L ATP(Sigma)、0.15μmol/L人源泛素激活酶(UBE1,R&D Systems)、2μmol/L Ubc13、2μmol/L Mms2、10μmol/L泛素、0.5μmol/L HLTF和0.05μmol/L His-FLAG-泛素-PCNA融合蛋白。30℃孵育30 min后,加入SDS-PAGE上樣緩沖液煮沸終止反應。用抗FLAG抗體(a8592,Sigma-Aldrich)進行Western印跡分析反應結(jié)果。
2 結(jié)果
2.1 重組HLTF蛋白在細菌中的表達和純化DEAE柱可去除Ni-NTA純化HLTFec蛋白時殘留的大量雜蛋白和錯誤折疊的蛋白。通過在純化流程的Ni-NTA柱步驟后添加DEAE柱步驟可以有效地提高蛋白質(zhì)的產(chǎn)量和純化產(chǎn)物的純度。優(yōu)化的純化流程可從7 L的大腸桿菌培養(yǎng)液中制備6 mg純度大于95%的HLTFec蛋白(圖1A)。蛋白從Supersose 6 10/300分子篩柱的16 mL處洗脫出來(圖1B),與溶液中HLTF蛋白的單體形式一致(預期分子量為109 kD)。
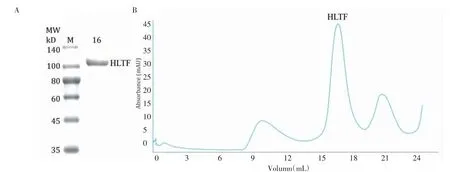
圖1 HLTFec蛋白的純化Fig 1 Purification of HLTFec protein
2.2 重組HLTF的ATP水解酶活性在沒有雙鏈DNA時HLTFec只有非常小的ATP水解酶活性,而當雙鏈DNA存在時該活性被強烈地促進超過300倍(圖2)。數(shù)據(jù)分析顯示當雙鏈DNA存在時,該活性的激活常數(shù)(Ka)為(81.4±14.1)nmol/L,該反應的最大反應比速率(定義為最大反應速率除以HLTF的濃度,Vmax)為(4.3±0.2)/min。這些數(shù)據(jù)表明,HLTFec具有強大的受雙鏈DNA激活的ATP酶活性,與其催化復制叉退行的功能一致。
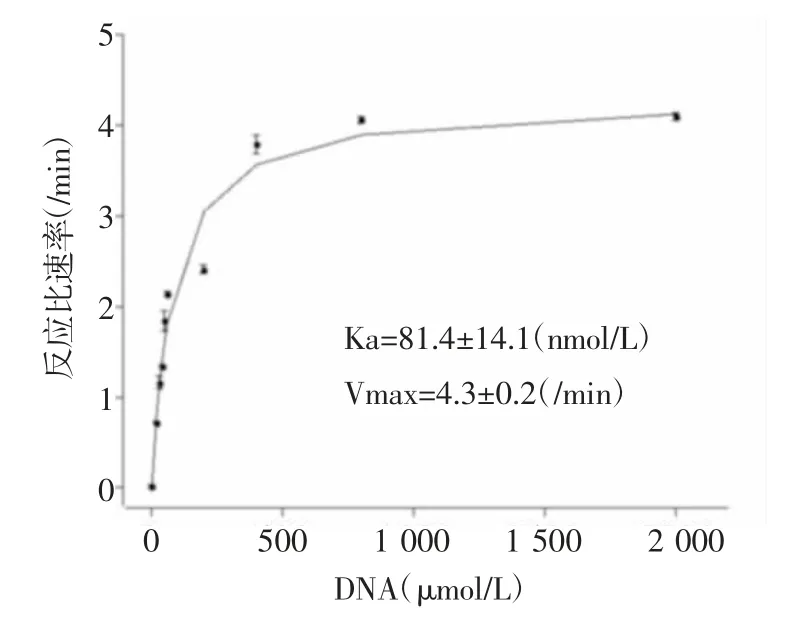
圖2 DNA激活的HLTFec的ATP酶活性Fig 2 DNA-stimulated ATPase activity of HLTFec
2.3 重組HLTF的泛素連接酶活性HLTFec可強烈地促進泛素激活酶與Ubc13-Mms2復合物催化的自由泛素鏈的形成(圖3),說明其具有很強的泛素連接酶活性。筆者發(fā)現(xiàn)加入雙鏈DNA或單鏈DNA會進一步促進泛素鏈的形成。這些數(shù)據(jù)表明,HLTFec具有較強的泛素連接酶活性,且可被DNA激活。

圖3 HLTFec促進Ubc13-Mms2復合物催化自由泛素鏈形成Fig3 Stimulation of free ubiquitin chain formation catalyzed by Ubc13-Mms2 complex through HLTFec
2.4 重組HLTF催化PCNA泛素鏈標記的活性該反應需要單泛素化的PCNA作為底物,在該底物中泛素以共價鍵連接在PCNA的164號位賴氨酸的側(cè)鏈上。本研究使用類似的泛素-PCNA融合蛋白作為底物檢測HLTFec是否能催化PCNA的泛素鏈標記。結(jié)果表明,HLTFec可與Mms2、Ubc13、泛素激活酶等蛋白協(xié)作,在泛素-PCNA融合蛋白底物上催化PCNA的泛素鏈標記(圖4)。這些數(shù)據(jù)表明,HLTFec可催化PCNA的泛素鏈標記,且對底物中泛素與PCNA的連接方式不敏感。
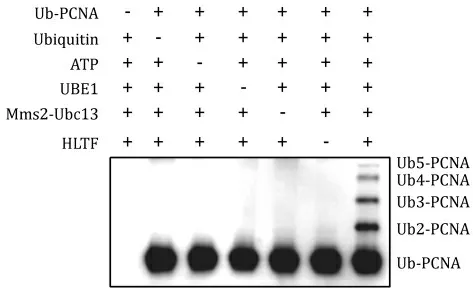
圖4 HLTFec催化PCNA的泛素鏈標記Fig 4 PCNA-anchored poly-ubiquitination by HLTFec
3 討論
在常用的蛋白表達系統(tǒng)中,細菌表達系統(tǒng)所需要的工作量和材料最少[23-24]。然而,由于真核生物和細菌在密碼子偏好性上存在差異,真核生物的蛋白一般無法很好地在細菌中表達[20-21]。此外,由于細菌與真核細胞中的蛋白折疊環(huán)境有很大的不同,一些真核生物的蛋白即使能在細菌中表達,也可能無法正確折疊從而缺乏生物活性[19]。在細菌中表達來自高等真核生物的大分子量多結(jié)構(gòu)域蛋白尤其困難。大分子量多結(jié)構(gòu)域的人源HLTF蛋白在細胞的DNA復制壓力應對中發(fā)揮關(guān)鍵作用,對它的結(jié)構(gòu)和功能研究急需建立大規(guī)模制備高純度、折疊正確的HLTF的方法。本課題組前期的工作表明,通過優(yōu)化密碼子偏好性可以在大腸桿菌中表達HLTF。本研究優(yōu)化了從大腸桿菌中制備HLTF的方案,建立了一個有效的制備大量、高純度的HLTF的方法。更為重要的是,體外實驗表明制備的HLTF具有完整的生物活性,提示它是正確折疊的。已有報道表明HLTF可以使用酵母表達系統(tǒng)表達[8]。該系統(tǒng)較為耗時,轉(zhuǎn)化、細胞培養(yǎng)及誘導蛋白表達需2周左右的時間。另外,研究人員僅利用該系統(tǒng)純化了少量的HLTF進行功能實驗,能否將該系統(tǒng)用于制備結(jié)構(gòu)研究所需的大量、高純度、正確折疊的HLTF還不清楚。與該方法相比,本研究建立的方法耗時更短,細胞培養(yǎng)和誘導蛋白表達僅需2 d。而且,此方法可以方便的制備5~6 mg的高純度、正確折疊的HLTF。因此,本研究提供了一個有效的方案來制備正確折疊的HLTF蛋白,為該蛋白的結(jié)構(gòu)和功能研究奠定了基礎(chǔ)。
HLTF催化PCNA的泛素鏈標記反應以單泛素化的PCNA作為底物,其生成需要Rad18、Rad6、PCNA和復制因子C(replication factor C,RFC)將PCNA加載到雙鏈DNA上[8,25]。HLTF的酵母同源蛋白Rad5催化類似的反應,也需要一組相似的蛋白因子[26]。然而,研究表明Rad5對泛素與PCNA之間的連接方式并不敏感,可以將泛素-PCNA融合蛋白作為底物來催化PCNA的泛素鏈標記。本研究發(fā)現(xiàn)HLTF同樣對泛素與PCNA之間的連接方式不敏感,泛素-PCNA融合蛋白也可作為HLTF催化PCNA泛素鏈標記反應的底物。本課題組最近發(fā)現(xiàn),Rad5和HLTF以截然不同的機制催化PCNA的泛素鏈標記。Rad5通過其HIRAN結(jié)構(gòu)域招募PCNA并對其泛素化,而HLTF的HIRAN結(jié)構(gòu)域與PCNA沒有相互作用[18]。有意思的是,本研究表明,HLTF和Rad5催化的差異巨大的PCNA的泛素鏈標記反應對泛素-PCNA連接方式均不敏感。這一發(fā)現(xiàn)為深入理解Rad5和HLTF催化的PCNA泛素鏈標記反應的機制提供線索,也提供一種操作簡便的實驗體系來研究HLTF催化的PCNA泛素鏈標記反應。

